- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Галогены, их нахождение в природе, свойства и применение
Содержание
- 2. Урок на тему: «Галогены, их нахождение в природе, свойства и применение»
- 3. Обучающая : Дать общую характеристику галогенов, рассмотреть
- 4. «Для тех, кто мало знает и
- 5. Галогены (от греч. halos - соль и
- 6. АСТАТ Этот элемент
- 7. фтор Фтор – от греческого phthoros –
- 8. ХЛОР Хлор хвалился: «Нет мне равных!
- 9. БРОМ Бром разлился океаном, Хоть
- 10. ЙОД Йод красой
- 11. Физические свойства
- 12. Ядовиты !ФТОР – ГАЗ(Н.У.)
- 13. Нахождение в природеХлор Cl2Бром Br2Йод I2
- 14. МИНЕРАЛЬНОЕ СОЕДИНЕНИЕ ФТОРАНахождение в природе
- 15. Биологическое значение
- 16. Поступает в
- 17. Поступает в организм:Хлеб, яйца, молоко, вода, морская
- 20. Викторина «Угадай-ка!» ***Парадокс? Противоречье? Разрушитель зубы лечит!
- 21. ***Хлорофилл не любит… Это ведь отнюдь не вздор. Слов стечение роковое, В ... гибнет все живое.***
- 22. ***Мне сегодня … помог:Я спокоен, словно йог.Помни,
- 23. ***Мечта познать его пуста. Он сам –
- 24. Кроссворд «Галогены»По вертикали: 1. Агрегатное состояние
- 25. Ответы на кроссворд «галогены» По вертикали: Газы
- 26. Группа семь аборигены: Солероды – галогены. Окислительный
- 27. Домашнее задание : §18Спасибо за урок!
- 28. Скачать презентацию
- 29. Похожие презентации

























Слайд 3 Обучающая : Дать общую характеристику галогенов, рассмотреть их
свойства, нахождение в природе и применение.
Развивающая : развитие
познавательного интереса и умений делать выводы;Воспитательная : воспитывать у учащихся внимание, инициативу, воспитание культуры умственного труда.
Цели урока:
Слайд 4
«Для тех, кто мало знает и этого
много,
а для тех, кто хочет знать много
и этого мало»Л.Зорина
Девиз урока:
Слайд 5 Галогены (от греч. halos - соль и genes
- образующий) - элементы главной подгруппы VII группы периодической
системы: фтор, хлор, бром, йод, астат. Все элементы данной подгруппы - ярко выраженные неметаллы. В свободном состоянии галогены образуют вещества, состоящие из двухатомных молекул F2, Cl2, Br2, I2.Содержание в земной коре: фтор - 0,028%, хлор - 0,19%, бром - 0,0006%, йод - 0,000006%, астат - следы
Слайд 6
АСТАТ
Этот элемент
был предсказан Д.И.Менделеевым под названием экайода и стал вторым
(после технеция) синтезированным элементом. Его синтез провели американские ученые Д.Корсон, К.Мак-Кензи и Э.Сегре (1940) по ядерной реакции:
Слайд 7
фтор
Фтор – от греческого phthoros –
разрушение.
Фтор был открыт в 1866 году
французским
химиком Анри Муассаном.
В 1906 г. за выделение,
изучение фтора и его
соединений Анри Муассон был
удостоен Нобелевской премии.
Слайд 8
ХЛОР
Хлор хвалился:
«Нет мне равных!
Галоген я
самый главный.
Зря болтать я не люблю:
Все на свете отбелю!»
Хлор от греческого – желто -зеленый.В 1774 г. шведский химик К.Шееле при
нагревании с концентрированной соляной
кислотой минерала пиролюзита MnО2
получил хлор.
Слайд 9
БРОМ
Бром разлился океаном,
Хоть зловонным, но
румяным. Бил себя он грозно в грудь: «Я
ведь бром! Не кто-нибудь!..»Бром от греческого – зловоние.
В 1825 г. французский химик А.Ж.Балар выделил бром из золы морских водорослей, действуя на них концентрированной серной кислотой и пиролюзитом (MnO2).
Бром – тяжелая темно-красная жидкость (ρ = 3,1055 г/см3), образующая желто-бурые пары с резким запахом, способные вызвать поражение дыхательных путей. При попадании жидкого брома на кожу образуются очень болезненные ожоги и трудно заживающие язвы.
Слайд 10
ЙОД
Йод красой своей
гордился,
Твердым был, но испарился.
Фиолетовый, как ночь,
Далеко умчался прочь.
Йод
был открыт французским химиком Б.Куртуа в 1811 г. Ученый наблюдал появление фиолетовых паров с запахом, похожим на запах хлора, при действии концентрированной серной кислоты на золу морских водорослей. Название йод образовано от греческого– цвет фиалки, фиолетовый.
Слайд 11 Физические свойства
галогенов
а) C увеличением атомной массы уменьшается неметаллический
характер элементов.б) С увеличением атомной массы окраска становится более темной.
в) С увеличением атомной массы возрастает температура плавления и кипения
Слайд 12
Ядовиты !
ФТОР – ГАЗ(Н.У.)
СВЕТЛО-ЗЕЛЕНЫЙ
Резкий раздражающий запах
Хлор- газ (н.у.)
Жёлто-зелёный
Резкий
удушающий запахБром- Жидкость(н.у)
Тёмно-бурый
Запах резкий зловонный
Иод – твёрдое вещество
Цвет фиолетовый с металлическим блеском
Запах резкий
Возгоняется , т.е переходит в газ, минуя жидкое состояние
Слайд 14
МИНЕРАЛЬНОЕ СОЕДИНЕНИЕ
ФТОРА
Нахождение в природе
Важнейшие минералы
фтора — это флюорит (плавиковый шпат) СaF2 , а
также фторапатит 3Са3(РО4)2· СaF2 и криолит Na3AlF6.Слайд 15 Биологическое значение
галогенов
Нервные клетки
железы( обмен веществ)F
Зубная эмаль кости
мышцы
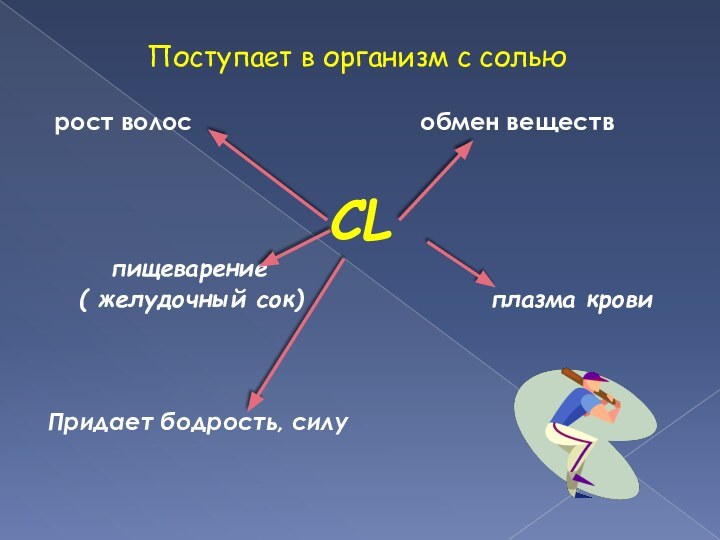
Слайд 16 Поступает в организм
с солью
рост волос
обмен веществCL
пищеварение
( желудочный сок) плазма крови
Придает бодрость, силу
Слайд 17
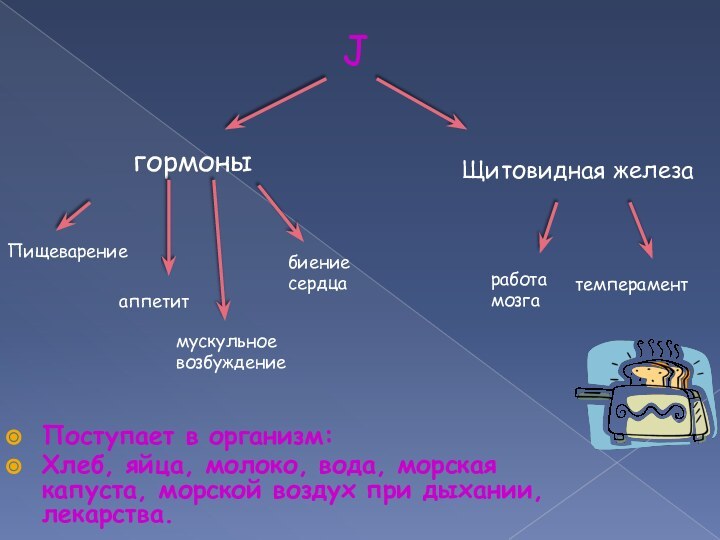
Поступает в организм:
Хлеб, яйца, молоко, вода, морская капуста,
морской воздух при дыхании, лекарства.
J гормоны
Щитовидная железа
Пищеварение
аппетит
мускульное
возбуждение
работа
мозга
темперамент
биение сердца
Слайд 18
ЦНС(возбуждение
и торможение)
Br
Содержится в морских водорослях ,при дыхании морским воздухом ,лекарства
Слайд 19
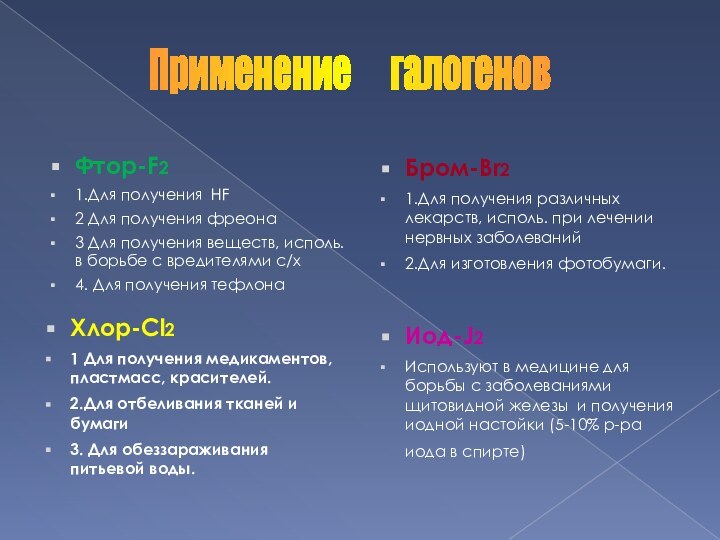
Фтор-F2
1.Для получения HF
2 Для получения фреона
3 Для
получения веществ, иcполь. в борьбе с вредителями с/х
4. Для
получения тефлона Бром-Br2
1.Для получения различных лекарств, исполь. при лечении нервных заболеваний
2.Для изготовления фотобумаги.
Хлор-Cl2
1 Для получения медикаментов, пластмасс, красителей.
2.Для отбеливания тканей и бумаги
3. Для обеззараживания питьевой воды.
Иод-J2
Используют в медицине для борьбы с заболеваниями щитовидной железы и получения иодной настойки (5-10% р-ра иода в спирте)
Применение галогенов
Слайд 20
Викторина
«Угадай-ка!»
***
Парадокс? Противоречье?
Разрушитель зубы лечит!
Подсказал науке слон:
«Кариесу
... заслон!»
***
Слайд 21
***
Хлорофилл не любит…
Это ведь отнюдь не вздор.
Слов стечение
роковое,
В ... гибнет все живое.
***
Слайд 22
***
Мне сегодня … помог:
Я спокоен, словно йог.
Помни, боевой
народ:
Первый лекарь – это ...
Раны мажь, не ойкай,
... настойкой.
***
Слайд 23
***
Мечта познать его пуста.
Он сам – сплошная тайна.
Секунды
счет ведет ...
И, исчезая, тает.
***
1. Отсутствие какого элемента в
организме человека вызывает заболевание щитовидной железы? 2. В переводе с греческого его название означает «желто-зеленый».
Слайд 24
Кроссворд «Галогены»
По вертикали: 1. Агрегатное состояние первых
двух представителей галогенов при нормальных условиях. 2. Самый тяжелый
галоген, полученный искусственно в 1940 г. с помощью ядерной реакции. Обнаружен в природе в 1943 г. По свойствам близок к йоду. 3. Наиболее характерное свойство галогенов – присоединение электрона, отдаваемого металлами, поэтому о них говорят: «Галогены – сильные ...» 4. Самый химически активный галоген. Впервые получен в 1886 г. А.Муассаном (Франция). 5. Переход из твердого состояния непосредственно в пар, способный превращаться в твердое тело, минуя стадию жидкого состояния. Легко осуществляется для йода. Используется для очистки веществ. 6. Количество электронов на внешнем энергетическом уровне в атомах галогенов. 7. Значение слова «бром» в переводе с греческого языка на русский. 8. Название солей, которые получаются в результате взаимодействия хлора с металлами; соли хлороводородной кислоты.
Слайд 25
Ответы на кроссворд «галогены» По вертикали:
Газы
2. Астат 3. Окислители
4. Фтор
5. Возгонка 6. Семь7. Зловоние 8. Хлориды
Слайд 26
Группа семь аборигены:
Солероды – галогены.
Окислительный народ –
Эти
F, Cl, Br и I !
В клетках 9 и
17
Два преступника томятся.Главный электронный вор,
Разрушитель фтор – флюор,
С водородом заодно Влезет запросто в окно.
Ядовит зеленый Хлор, Замышляет страшный ор. Он побег готовит в роли Самой безобидной соли.
Жидкий и зловонный Бром Притаился за бугром. Вот сейчас петлю накинет На Алкены и Алкины…
И хитер в разбойный род Фиолетовый Йод. Твердый только до поры, На глазах уйдет в пары. Посмотри, каков нахал: Перепортил весь крахмал!
Заключение