- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Гибридизация атомов углерода
Содержание
- 2. 1s2px2py1s2px2py2pzsp3 – ГИБРИДИЗАЦИЯЭлектронная структура атома углерода 2s2pzС – 1s22s22p2С* – 1s22s12p3
- 3. Процессы выравнивания орбиталей по форме и энергии называют гибридизацией.
- 4. Первое валентное состояние углерода sр3-Гибридизация - смешение
- 5. 1s2s2px2py2pz1s2px2py2pzЧЕТЫРЕ ВАЛЕНТНЫЕ σ- СВЯЗИ, НАПРАВЛЕННЫЕ К ВЕРШИНАМ
- 6. Атомы углерода в молекулах алканов находятся в
- 7. Молекулярная структура алканов СХЕМА ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СВЯЗЕЙ В МОЛЕКУЛЕ МЕТАНАОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ ЭТАНАОБРАЗОВАНИЯ σ-СВЯЗЕЙ в этане
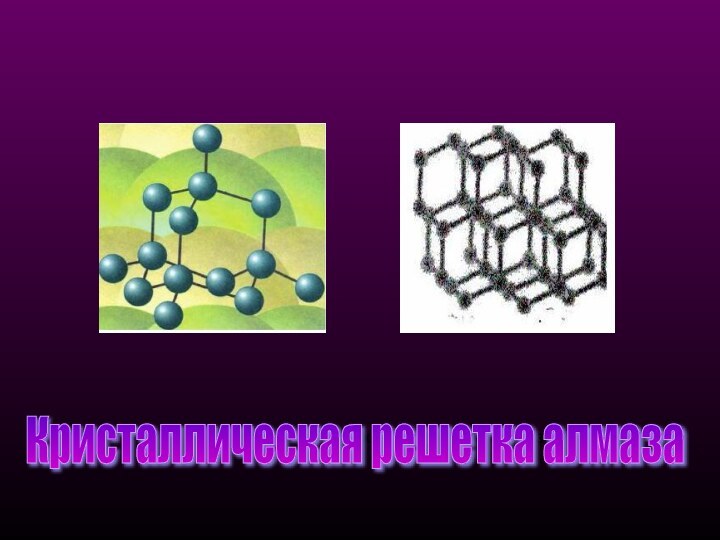
- 8. Кристаллическая структура алмазаКристаллическая решетка алмаза
- 9. Для атома углерода возможны три типа гибридизации (три валентных состояния). sр3-Гибридизацияsр2-Гибридизация sр -Гибридизация
- 10. sр2-Гибридизация - смешение одной 2s- и двух
- 11. sp2– ГИБРИДИЗАЦИЯ1s2s2px2py2pz1s2s2px2py2pzСхема образования трех sр2-гибридных орбиталей: a
- 12. sр2-Гибридизация
- 13. ОБРАЗОВАНИЕ σ- и π-СВЯЗЕЙ В ЭТИЛЕНЕМолекулярная структура алкенов
- 14. Третье валентное состояние углерода sр-Гибридизация - смешение
- 15. Схема образования двух sp-гибридных орбиталей: а -
- 16. sр-Гибридизация
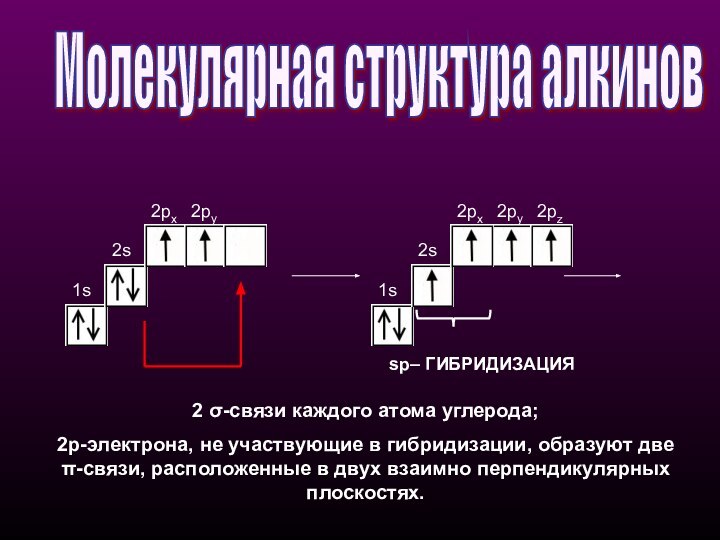
- 17. Молекулярная структура алкинов 1s2s2px2py1s2s2px2py2pzsp– ГИБРИДИЗАЦИЯ2 σ-связи каждого
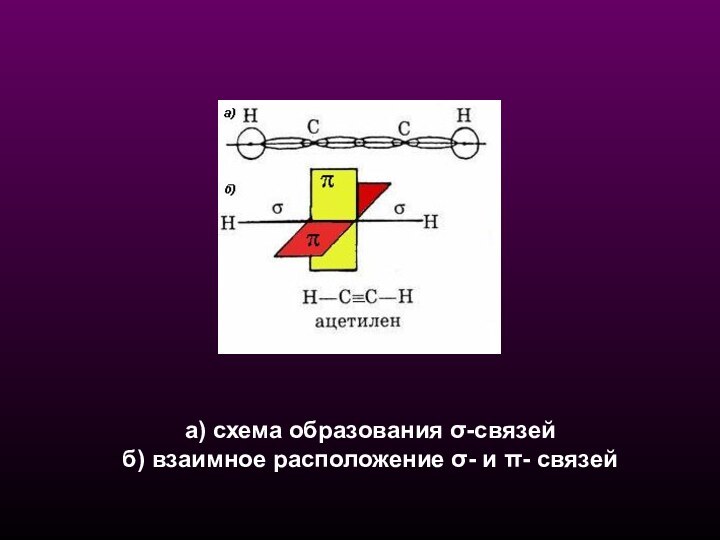
- 18. а) схема образования σ-связей б) взаимное расположение σ- и π- связей
- 19. Молекулярная структура алкинов СХЕМА ОБРАЗОВАНИЯ σ-СВЯЗЕЙ В АЦЕТИЛЕНЕОБРАЗОВАНИЯ π- СВЯЗЕЙ в АЦЕТИЛЕНЕ
- 20. Достигли ли вы цели урока? В какой
- 21. Скачать презентацию
- 22. Похожие презентации
1s2px2py1s2px2py2pzsp3 – ГИБРИДИЗАЦИЯЭлектронная структура атома углерода 2s2pzС – 1s22s22p2С* – 1s22s12p3
















Слайд 2
1s
2px
2py
1s
2px
2py
2pz
sp3 – ГИБРИДИЗАЦИЯ
Электронная структура атома углерода
2s
2pz
С
– 1s22s22p2
Слайд 4
Первое валентное состояние углерода
sр3-Гибридизация - смешение одной
2s- и трех 2р-орбиталей. Все четыре гибридные орбитали строго
ориентированы в пространстве под углом 109°28' друг к другу, создавая утолщенными "лепестками" геометрическую фигуру - тетраэдрПоэтому sp3-гибридизованный атом углерода часто называют "тетраэдрическим".
Состояние углеродного атома с sp3-гибридными орбиталями (первое валентное состояние) характерно для предельных углеводородов - алканов.
sp3 - тетраэдрическое
строение
sр3-Гибридизация
Слайд 5
1s
2s
2px
2py
2pz
1s
2px
2py
2pz
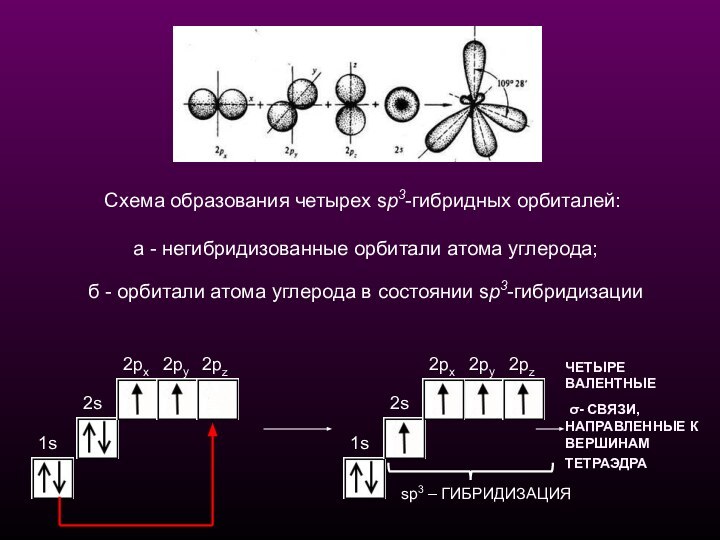
ЧЕТЫРЕ ВАЛЕНТНЫЕ
σ- СВЯЗИ, НАПРАВЛЕННЫЕ К ВЕРШИНАМ ТЕТРАЭДРА
sp3 – ГИБРИДИЗАЦИЯ
Схема образования четырех sp3-гибридных орбиталей:
а -
негибридизованные орбитали атома углерода;
б - орбитали атома углерода в состоянии sp3-гибридизации
Слайд 6
Атомы углерода в молекулах алканов находятся в состоянии
sp3-гибридизации. Каждый такой атом способен образовывать четыре одинарные σ
-связи как с атомами углерода, так и с атомами водорода. Например, в этане каждый атом углерода образует одну σ -связь за счет осевого перекрывания гибридной орбитали с гибридной орбиталью другого атома углерода и три σ -связи за счет перекрывания гибридных орбиталей с s -орбиталями трех атомов водорода
Слайд 7
Молекулярная структура алканов
СХЕМА ОБРАЗОВАНИЯ
ХИМИЧЕСКИХ СВЯЗЕЙ
В
МОЛЕКУЛЕ МЕТАНА
ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ ЭТАНА
ОБРАЗОВАНИЯ σ-СВЯЗЕЙ в этане
Слайд 9 Для атома углерода возможны три типа гибридизации (три
валентных состояния).
sр3-Гибридизация
sр2-Гибридизация
sр -Гибридизация
Слайд 10 sр2-Гибридизация - смешение одной 2s- и двух 2р-орбиталей,
одна 2p не гибридизована и перпендикулярна плоскости, в которой
расположены три sp2-гибридные орбитали.Состояние атома углерода с sp2-гибридными орбиталями (второе валентное состояние) характерно для непредельных углеводородов ряда этилена - алкенов
Второе валентное состояние углерода
sp2 - плоскостное
строение
sр2-Гибридизация
Слайд 11
sp2– ГИБРИДИЗАЦИЯ
1s
2s
2px
2py
2pz
1s
2s
2px
2py
2pz
Схема образования трех sр2-гибридных орбиталей:
a -
негибридизованные орбитали атома углерода;
б - орбитали атома углерода
в состоянии sp2-гибридизации.
Слайд 14
Третье валентное состояние углерода
sр-Гибридизация - смешение одной
2s- и одной 2р-орбитали. Две гибридные орбитали расположены на
одной прямой линии под углом 180° друг к другу. Остальные две негибридизованные 2р-орбитали расположены во взаимно перпендикулярных плоскостях.Состояние атома углерода с sp-гибридными орбиталями (третье валентное состояние) характерно для непредельных углеводородов ацетиленового ряда - алкинов.
sp - линейное
строение
sр-Гибридизация
Слайд 15
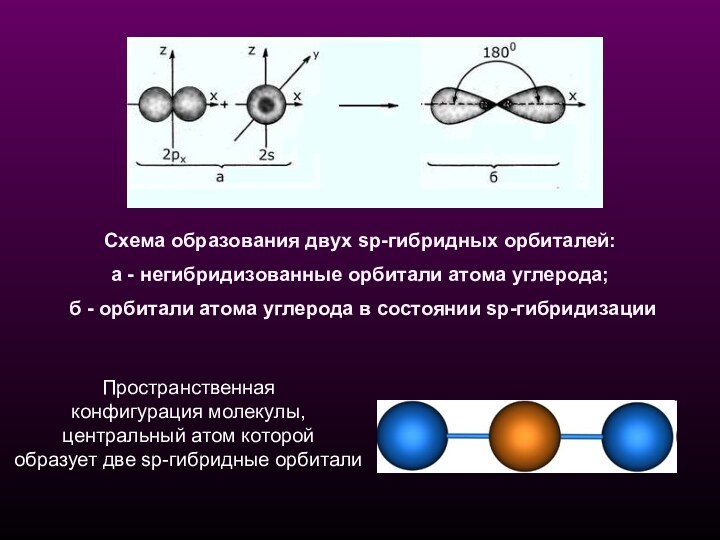
Схема образования двух sp-гибридных орбиталей:
а - негибридизованные
орбитали атома углерода;
б - орбитали атома углерода в
состоянии sp-гибридизации Пространственная
конфигурация молекулы,
центральный атом которой
образует две sp-гибридные орбитали