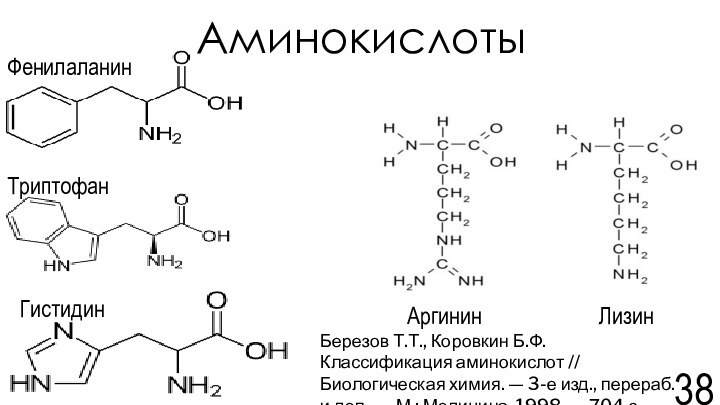
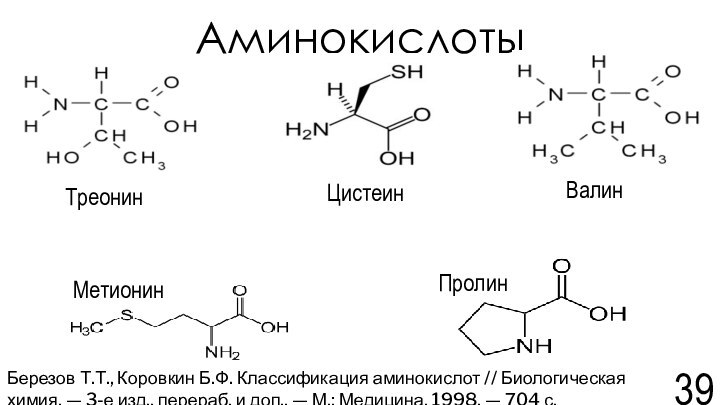
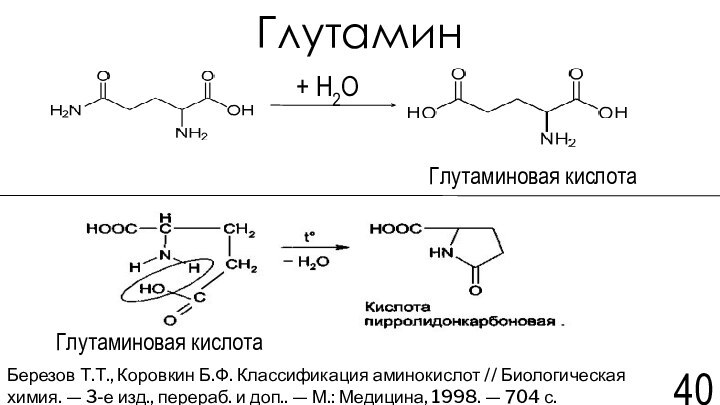
химия. — 3-е изд., перераб. и доп..-М.: Медицина, 1998. — 704 с.
Глинка
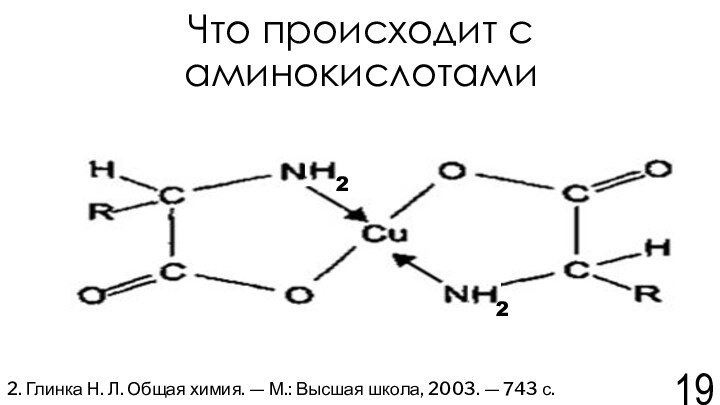
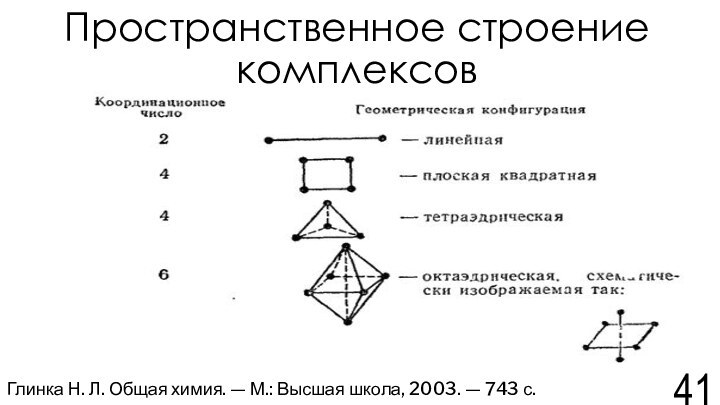
Н. Л. Общая химия. — М.: Высшая школа, 2003. — 743 с.
Дятлова Н. М., Телкина В. Я , Попов К. И. – Комплексоны и комплексонаты металлов.-М.: Химия, 1988. — 544 с.
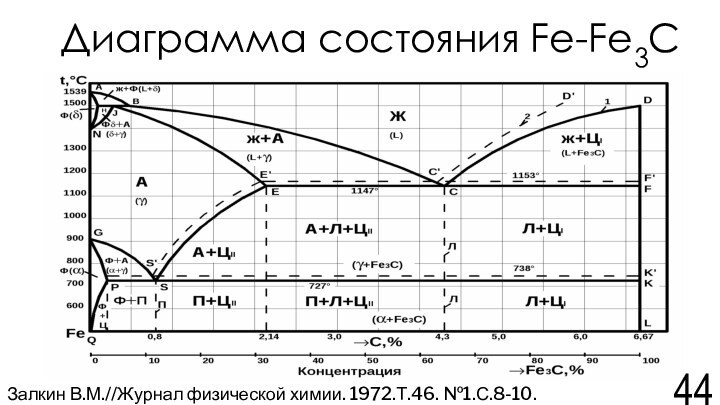
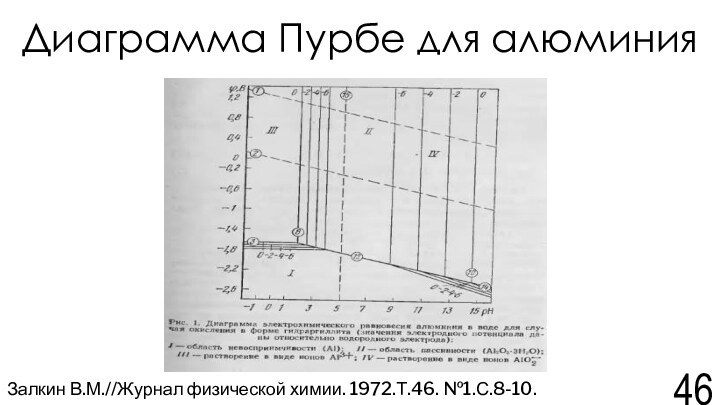
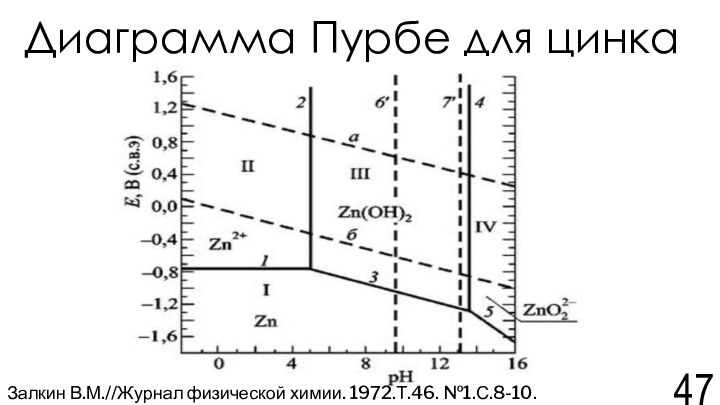
Залкин В.М.//Журнал физической химии. 1972.Т.46. №1.С.8-10.
Киселев Ю. М. – Химия координационных соединений. — М.: Интеграл-Пресс, 2008. — 728 с.
Ляликов Ю.С., Кличко Ю.А. Теоретические основы современного качественного анализа. М.: «Химия», 1978, 312с.
Михайлов В.А., Сорокина О.В., Савинкина Е.В., Давыдова М.Н.; под ред. Академика РАН А.Ю. Цивадзе. – Химическое равновесие. М.: Бином. Лаборатория знаний, 2011. – 197с.
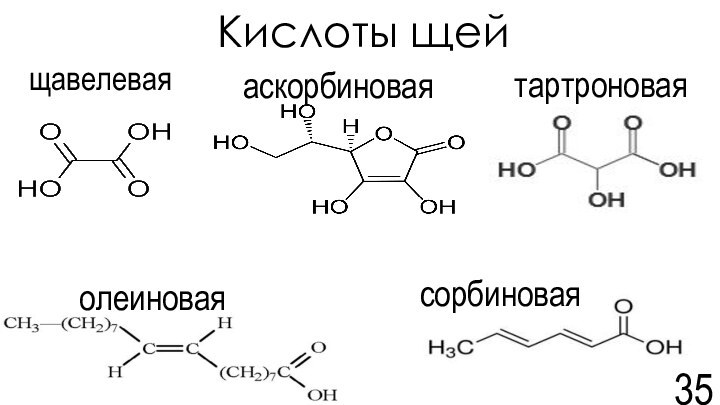
Похлебкин В.В. Большая кулинарная книга. М.:«Эксмо» - 2014, - 992с.
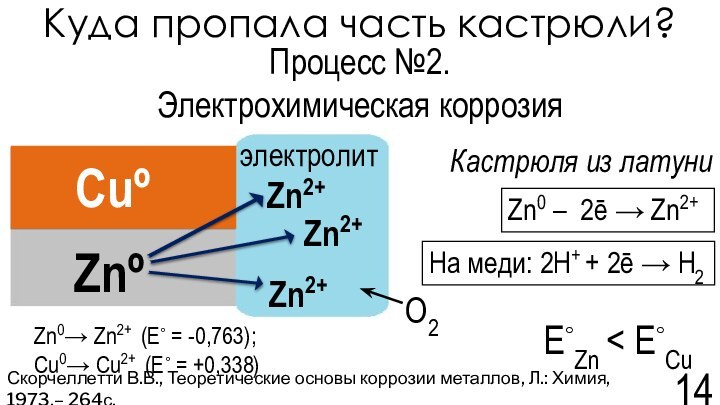
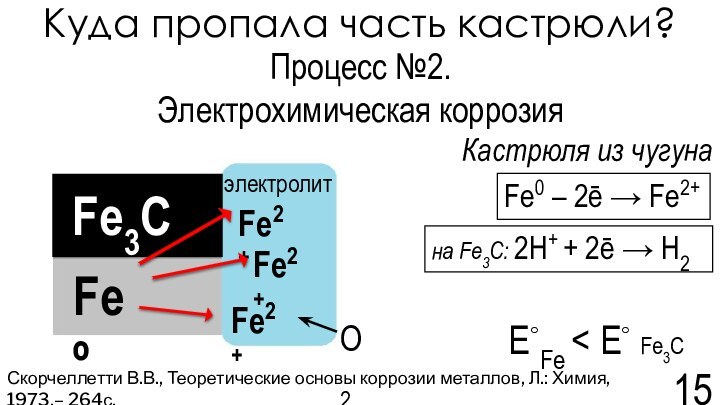
Скорчеллетти В.В., Теоретические основы коррозии металлов, Л.: Химия, 1973,– 264с.
Славгородская М.В., Имсырова А.Ф., Сячинова Н.В. – Аналитическая химия. Методические указания к лабораторно-практическим занятиям по качественному химическому анализу. – ВСГУТУ, Улан-Удэ, 2002 г.
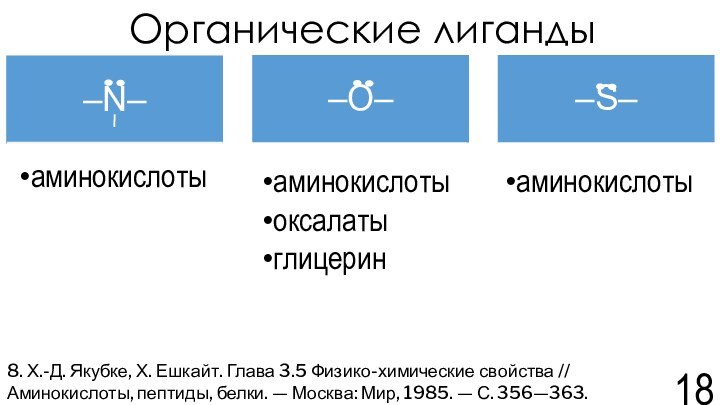
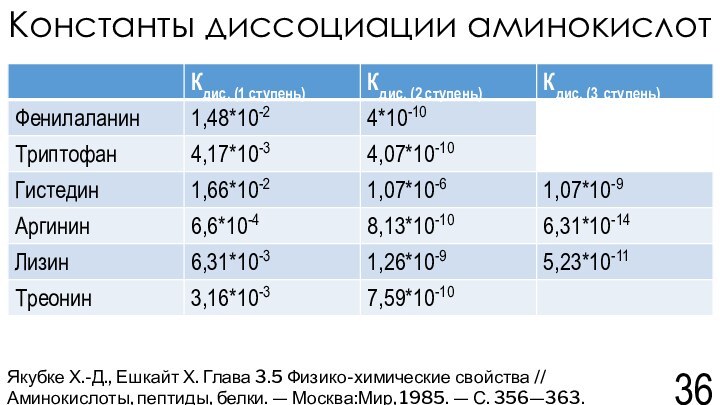
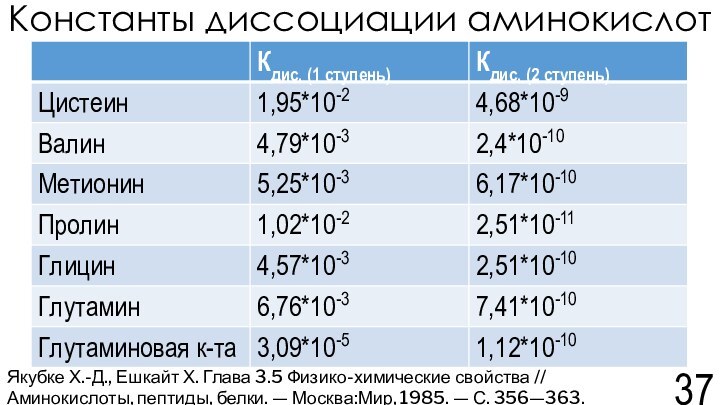
Якубке Х.-Д., Ешкайт Х. Глава 3.5 Физико-химические свойства // Аминокислоты, пептиды, белки. — Москва:Мир, 1985. — С. 356—363.
Яцимирский К. Б., Крисс Е.Е., Гвяздовская В. Л. Константы устойчивости комплексов металлов с биолигандами.
-К.: Наук. мнение, 1979. -228 с.
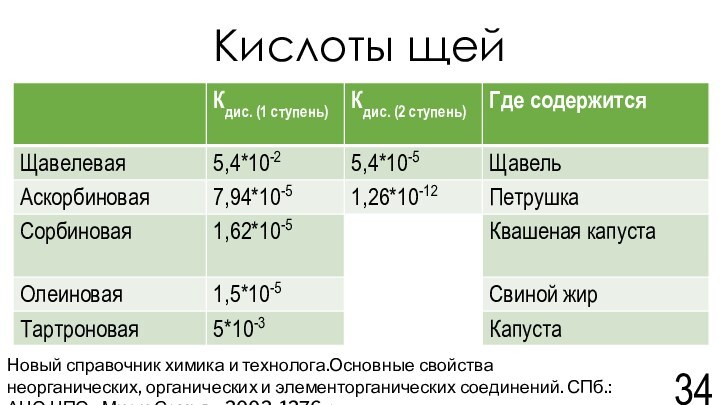
Новый справочник химика и технолога.Основные свойства неорганических, органических и элементорганических соединений. СПб.: АНО НПО «Мир и Семья», 2002. 1276 с.
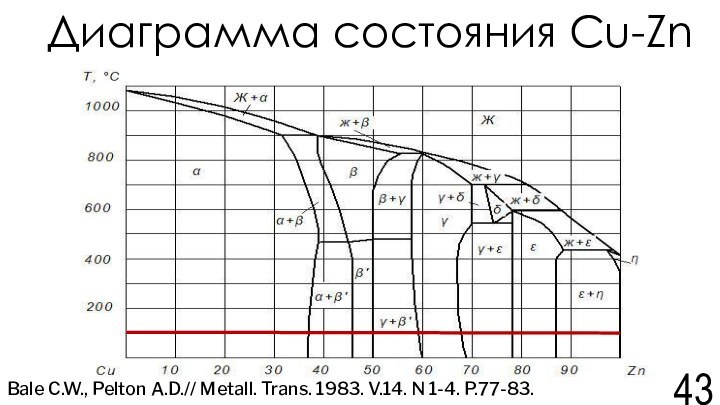
Bale C.W., Pelton A.D.// Metall. Trans. 1983. V.14. N 1-4. P.77-83.
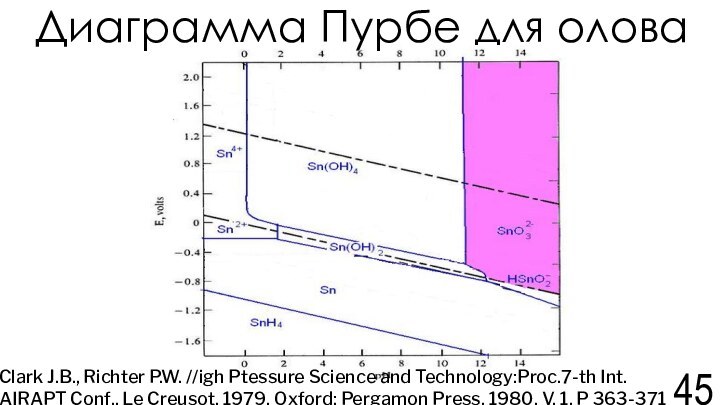
Clark J.B., Richter P.W. //igh Ptessure Science and Technology:Proc.7-th Int. AIRAPT Conf., Le Creusot. 1979, Oxford: Pergamon Press, 1980. V. 1. P 363-371
Литература







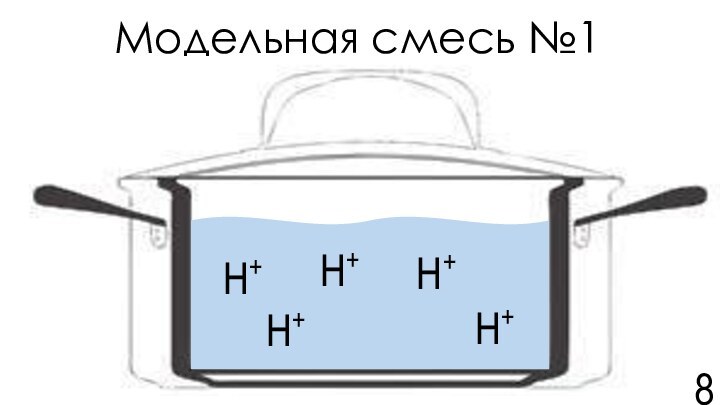


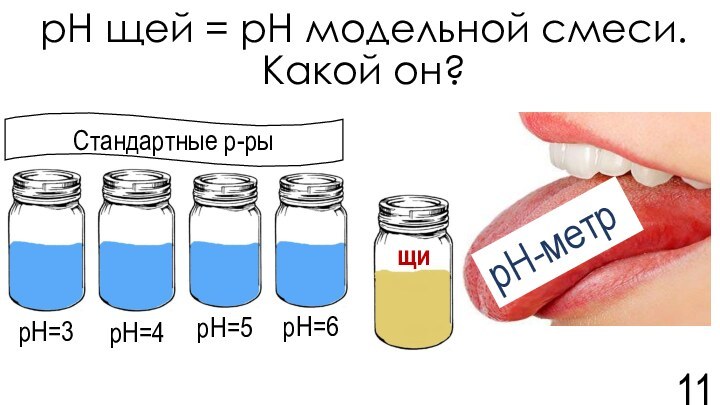


![Задача №7. По щам! Команда Карбораны Модельная смесь №2[Ме+n(орг.л-ды)-k2n]n-2knН+Которая представляет собой водный раствор слабой кислоты с органическими лигандами](/img/tmb/15/1479533/d180d1452649f8e70e4f3e2f50ecfea5-720x.jpg)