Слайд 2
Цели:
1.Образовательные:
1.1. Сфoрмировать у обучающихся понятия о получении и
применении карбоновых кислот;
1.2. Дать представление о значении кислот в
жизни человека.
2. Развивающие:
2.1. Сформировать знания в области кислородсодержащих органических веществ на основе самостоятельных и творческих способностей обучающихся;
2.2. Формировать и развить интеллектуальные умения: логически мыслить, использовать приемы сравнения, выделять главное, делать выводы.
2.3. Анализировать динамику собственных образовательных результатов.
3. Воспитательные:
3.1. Пробудить желание к активной деятельности по охране окружающей среды, воспитать чувство бережного и гуманного отношения к природе.
3.2. Развивать экологическое мышление, уметь применять его в познавательной практике.
Тип урока: комбинированный.
Слайд 3
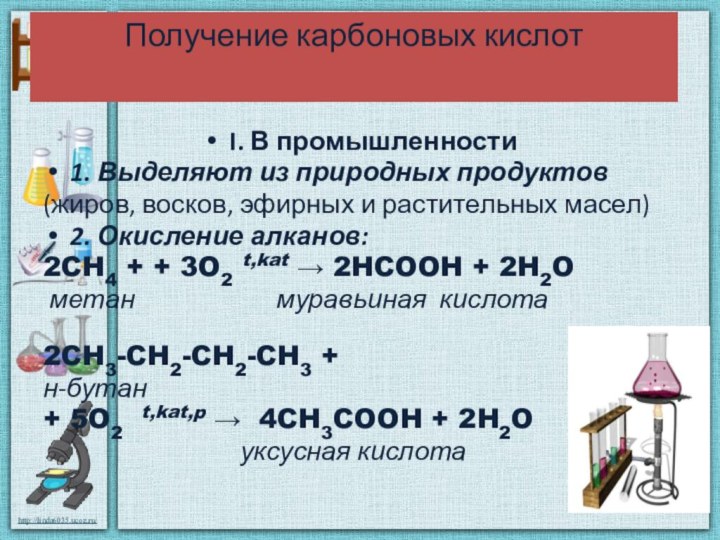
Получение карбоновых кислот
I. В промышленности
1. Выделяют из природных
продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов:
2CH4 + +
3O2 t,kat → 2HCOOH + 2H2O
метан муравьиная кислота
2CH3-CH2-CH2-CH3 +
н-бутан
+ 5O2 t,kat,p → 4CH3COOH + 2H2O
уксусная кислота
Слайд 4
Получение
3. Окисление из алкенов:
CH2=CH2 + O2 t,kat → CH3COOH
этилен
СH3-CH=CH2 +
4[O] t,kat →
CH3COOH + HCOOH (уксусная кислота+муравьиная кислота)
Слева – раствор перманганата калия,
справа – результат его взаимодействия с алкеном.
Слайд 5
Получение бензойной кислоты
4. Окисление гомологов бензола (получение бензойной
кислоты):
5C6H5-CH3 + 6KMnO4 + 9H2SO4 →
толуол
5C6H5-COOH+3K2SO4 +6MnSO4 +14H2O
бензойная кислота
Слайд 6
Получение
5. Получение муравьиной кислоты:
1 стадия: CO + NaOH t,p → HCOONa (формиат натрия – соль)
2 стадия: HCOONa
+ H2SO4 → HCOOH + NaHSO4
6. Получение уксусной кислоты:
CH3OH + CO t,p → CH3COOH
Метанол
Слайд 7
II. В лаборатории
1. Гидролиз сложных эфиров:
2. Из солей
карбоновых кислот:
R-COONa + HCl → R-COOH + NaCl
Слайд 8
В лаборатории
3. Растворением ангидридов карбоновых кислот в воде:
(R-CO)2O
+ H2O → 2 R-COOH
4. Щелочной гидролиз галоген производных
карбоновых кислот:
Слайд 9
III. Общие способы получения карбоновых кислот
1. Окисление альдегидов:
R-COH
+ [O] → R-COOH
Например, реакция «Серебряного зеркала» или окисление
гидроксидом меди (II) – качественные реакции альдегидов
2. Окисление спиртов:
R-CH2-OH + 2[O] t,kat → R-COOH + H2O
Слайд 10
Общие способы получения
3. Гидролиз галогензамещённых углеводородов, содержащих три
атома галогена у одного атома углерода.
Слайд 11
Общие способы получения
4. Из цианидов (нитрилов) – способ
позволяет наращивать углеродную цепь:
СH3-Br + Na-C≡N → CH3-CN +
NaBr
CH3-CN - метилцианид ( нитрил уксусной кислоты)
СH3-CN + 2H2O t → CH3COONH4
ацетат аммония
CH3COONH4 + HCl → CH3COOH + NH4Cl
Слайд 12
Общие способы получения
5. Использование реактива Гриньяра
R-MgBr + CO2 → R-COO-MgBr H2O → R-COOH + Mg(OH)Br
Слайд 13
Применение
Муравьиная кислота — одноосновная предельная карбоновая кислота, бесцветная жидкость
с резким запахом. Применяется в медицине в качестве антисептика.
Пищевая добавка E236, консервант при заготовке кормов в сельском хозяйстве. Используется в качестве растворителя, для уничтожения паразитов в пчеловодстве, реактив для протравы в текстильной индустрии.
Слайд 14
Это интересно
Муравьиная кислота, выделяемая муравьями в момент опасности,
служит сигналом для всех остальных особей этого вида и
является средством защиты при нападении хищников. Благодаря этой кислоте муравьи имеют не так уж много врагов.
Муравьиная кислота полезна для крупных млекопитающих, так, медведи после зимней спячки избавляются от паразитов, ложась на муравейник. Муравьи, кусая его, впрыскивают муравьиную кислоту.
НСООН широко встречается в природе. Она содержится в соке крапивы, хвое, фруктах, а также в небольших количествах в поте и моче.
Слайд 15
Уксусная кислота
В пищевой и химической промышленности (производство ацетилцеллюлозы,
из которой получают ацетатное волокно, органическое стекло, киноплёнку; для
синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество. Ледяная уксусная кислота
Слайд 16
Это интересно
Первая кислота обнаруженная человеком - уксусная. Возможно
уксусную кислоту в древности так бы и не выявили,
если бы не пристрастие людей прошлого к вину. Если нарушить технологию винодельческого процесса, то вместо ароматного и вкусного вина получится уксус. Это очень огорчало и расстраивало. Применения для винного уксуса древний человек найти не мог, поэтому просто выливал прокисший продукт. Лишь спустя много лет, винный уксус стали использовать в качестве лекарства, приправы и даже растворителя. Кстати, само название "кислота" происходит от латинского слова "acetum" - уксус.ф
Слайд 17
Уксус
Он был известен в Китае еще в 3
веке до нашей эры. Это настолько древнее и часто
используемое вещество, что про него у многих народов даже пословицы есть:
ПОСЛОВИЦЫ
На свете только добротою нашей удаляется осадок и уксус превращается в вино (персидская пословица).
Медом больше мух наловишь, чем уксусом.
Для скопидома уксус даровой, приятнее, чем мускус покупной.
Ложь — не правда, уксус — не мед (азербайджанская пословица).
На дурняк и уксус сладкий (украинская пословица).
Бесплатный уксус слаще меда (персидская поговорка).
Слайд 18
Лимонная кислота
Многоосновная (трехосновная) карбоновая кислота. Твердое вещество
с бесцветными кристаллами. Хорошо растворяется в воде. Считается слабой
кислотой. Востребована в пищепроме как регулятор кислотности, вкусовая добавка, консервант (Е330). Используется в медицине, производстве косметических продуктов и препаратов бытовой химии; для травления печатных плат. В нефте- и газодобыче входит в состав буровых растворов; в строительстве ее добавляют в цементные и гипсовые смеси для замедления схватывания.
Слайд 19
Интересные факты о лимонной кислоте
Лимонная кислота впервые
была выделена (из сока лимонов) в 1784 году шведским
аптекарем Карлом Шееле. В организме каждого человека содержится лимонная кислота. Лимонную кислоту получают не только из лимонов (25кг на тонну лимонов), но и из плесневого гриба Aspergillus niger. Больше 50% лимонной кислоты производится в Китае.
Слайд 20
Продукты богатые лимонной кислотой
Слайд 21
Стеариновая кислота
Высшая одноосновная алифатическая кислота. Белые, нерастворимые
в воде кристаллы. Широко используется для производства мыл, синтетических
ПАВ, резины, густых смазок, клеящих паст; эфиров для пищепрома (стабилизаторы, антиоксиданты); входит в состав свечей, косметических продуктов. Применяется в текстильном и кожевенном производстве.
Слайд 22
Интересный факт
Без этой кислоты невозможно изготовление мыла и
пластичных смазок. Впервые она была выделена из свиного жира,
в котором она занимает до 30% всей массы. Растительные жиры также имеют в своем составе стеариновую кислоту в концентрации до 10%.
Слайд 23
Салициловая кислота
Двухосновная ароматическая кислота. Бесцветное твердое вещество, плохо
растворяется в воде. Проявляет слабые кислотные свойства, а также
свойства фенола. Используется в качестве антисептика в медицине, при производстве фармпрепаратов (наружных мазей и растворов, аспирина, противотуберкулезных средств и др.). Востребована в пищепроме как консервант. Применяется в орг. синтезе для изготовления красителей и ароматических веществ; реактив в колориметрии.
Слайд 24
Интересные факты
Салициловая кислота есть в клубнике, вине и
в кустарнике спирея, который у нас неправильно называют таволгой.
Вот спирея и задержалась в названии лекарства, которое содержит салициловую кислоту: аспирин.
Слайд 25
Чем же уникальна салициловая кислота:
первое, что нужно отметить,

это свойство салициловой кислоты подсушивать папулы – красные прыщи.
Попадая на их поверхность, кислота способствует образованию защитной корочки, тогда заживление проходит быстрее;
кроме подсушивающего эффекта раствор способствует заживлению так называемого постакне – пятен, которые остаются после глубоких прыщей. Применяется кислота и в борьбе с пигментными пятнами;
еще одно важное свойство салициловой кислоты – антибактериальное. Прыщи, которые имеют гнойный характер, называют пустулами. Салициловая кислота способна уничтожить саму бактерию, которая и вызывает появление пустул на коже лица;
если ваша кожа имеет повышенную жирность, салициловая кислота поможет вам снизить активность сальных желез и уменьшить выделение кожного сала. Поры под воздействием кислоты сужаются и не так закупориваются излишками жира;
при угревой сыпи салициловую кислоту используют как обесцвечивающее и растворяющее средство;
а еще это уникальное средство в соединении с другими компонентами действует на кожу как скраб, удаляя омертвевшие частички кожи, и ускоряет регенеративные процессы.
Слайд 26
Бензойная кислота
Одноосновная ароматическая кислота. Твердое кристаллическое вещество без
цвета. Сильное антисептическое средство в пищепроме (добавка Е210) и
медицине; сырье в органических синтезах для получения фенола, бензоилхлорида, пластификаторов (гликолей). Применяется в парфюмерии. В химпроме используется для изготовления красителей.
Слайд 27
Е210
Каждый из нас не раз видел в составе
продуктов питания добавку Е 210. Это условное обозначение бензойной
кислоты. Она встречается не только в продуктах, но и в ряде косметических и медицинских препаратов, так как обладает отличными консервирующими и противогрибковыми свойствами, являясь при этом по большей части натуральным веществом. Бензойная кислота содержится клюкве, бруснике, кисломолочных продуктах. Разумеется, в ягодах ее концентрация меньше, чем в производимых на предприятиях продуктах. Бензойная кислота, употребляемая в допустимых количествах, считается безопасной для здоровья человека. Ее применение разрешено практически во всех странах мира, в том числе в России, Украине, странах Европейского Союза, Соединенных Штатах Америки.
Слайд 28
Продукты богатые бензойной кислотой
Брусника
Клюква
Желе
Алкогольные напитки
Соки фруктовые
Консервы
Фрукты и овощи консервированные
Конфеты
Желе
Жвачка
Мясо (засоленное, маринованное)
Маргарин
Вермишель
Слайд 29
Интересные факты
Да, как оказалось, потребление овощей и фруктов
способствует производству собственного аспирина нашим организмом. Для создания этого
химического соединения нужна бензойная кислота, которая как раз и содержится во фруктах и овощах. Это вещество служит производной для синтезирования салициловой кислоты, ключевого соединения в аспирине. Вот такая вот собственная аптека.
Слайд 30
Щавелевая кислота
Двухосновная предельная кислота. Твердое вещество, водорастврима, токсична. Достаточно
сильная для органических кислот. Используется в металлургии для удаления
окалины и ржавчины, в процессе окрашивания тканей, пряжи, кож; сырье в органическом синтезе, реагент в аналитической химии. Применяется в процессах анодирования; для осаждения редкоземельных металлов.
Слайд 32
Интересный факт о щавелевой кислоте
Щавелевая кислота впервые была
получена во второй половине XVIII столетия и носила название
«сахарная», так как была произведена путем соединения азотной кислоты и сахара. Эксперимент стал первым случаем синтезирования щавелевой кислоты искусственным путем. В природе вещество встречается только в виде солей или в одном из видов грибов семейства трутовиков.
Слайд 33
Подготовка к ГИА
1 В порядке усиления кислотных свойств
расположены кислоты
1) стеариновая - уксусная - трихлоруксусная
2) уксусная -
стеариновая - трихлоруксусная
3) трихлоруксусная - уксусная - стеариновая
4) стеариновая - трихлоруксусная – уксусная
2 При кислотном гидролизе этилацетата образуются
1) этанол и муравьиная кислота
2) этанол и уксусная кислота
3) метанол и муравьиная кислота
4) метанол и уксусная кислота
3.Формиат калия не получится при действии на муравьиную кислоту
1) гидроксида калия
2) карбоната калия
3) сульфата калия
4) калия
Слайд 34
Подготовка к ГИА
4 Среди утверждений:
А. В карбонильной группе
альдегидов электронная плотность смещена к атому кислорода.
Б. Для предельных
альдегидов характерна геометрическая (цис-транс-) изомерия.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) неверны оба утверждения
5. Ацетальдегид не реагирует с
1) аммиачным раствором оксида серебра
2) гидроксидом меди(II)
3) водородом
4) гидроксидом натрия
Слайд 35
Подготовка к ГИА
6 В цепи превращений
CH3COOH + Na2CO3
?X1
Х1+ конц. H2SO4 ?X2
веществами Х1 и Х2 являются соответственно
1)
CO2 и H2CO3
2) CH3COONa и CH3COOH
3) CH3COONa и C2H5OH
4) CH3CH=O и C2H5OH
7 Муравьиная кислота реагирует с
1) хлоридом натрия
2) аммиачным раствором оксида серебра
3) медью
4) гексаном
Слайд 36
Подготовка к ГИА
8 Для муравьиной кислоты не характерна
реакция
1) этерификации
2) «серебряного зеркала»
3) гидратации
4) нейтрализации
9 Уксусная кислота реагирует
с
1) хлором
2) водородом
3) медью
4) хлоридом натрия
Слайд 37
Ответы
1-1
2-2,
3-3
4-1,
5-1
6-2
7-2
8-2
9-1


![Презентация по химии 10 класс Получение и применение карбоновых кислот Получение3. Окисление из алкенов: CH2=CH2 + O2 t,kat → CH3COOH этилен СH3-CH=CH2 + 4[O] t,kat → CH3COOH + HCOOH (уксусная](/img/tmb/6/568099/a93865865bcb0aeae3ff08c8ba72ef37-720x.jpg)




![Презентация по химии 10 класс Получение и применение карбоновых кислот III. Общие способы получения карбоновых кислот 1. Окисление альдегидов: R-COH + [O] → R-COOHНапример,](/img/tmb/6/568099/8df3363735046174b1ff196eba9bee1c-720x.jpg)


























































