- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Гидролиз
Содержание
- 2. ГИДРОЛИЗот греч. Hydro –вода,Lysis – разложение, распадГидролиз – это реакция обменного разложения веществ водой
- 3. Гидролиз органических веществC2H5Cl + H2O
- 4. Гидролиз бинарных соединенийКарбиды металлов: CaC2 +
- 5. Гидролиз солей Водные растворы солей имеют
- 6. Любую соль можно представить как продукт взаимодействия
- 7. Сильные основания
- 8. Гидролиз по аниону (соль образована сильным основанием
- 9. Гидролиз по катиону (соль образована слабым основанием
- 10. Необратимый гидролиз (соли образованы слабым основанием и
- 11. Изменение направления гидролизаУсилениеДобавить воды;Нагреть раствор;Связать один из
- 12. Применение гидролизаОсновной компонент мыла – это натриевые
- 13. Контрольный тест 1. Гидролиз солей – это
- 14. 3. Соль, гидролизуемая по аниону, - это
- 15. Скачать презентацию
- 16. Похожие презентации
ГИДРОЛИЗот греч. Hydro –вода,Lysis – разложение, распадГидролиз – это реакция обменного разложения веществ водой














Слайд 2
ГИДРОЛИЗ
от греч. Hydro –вода,
Lysis – разложение, распад
Гидролиз –
это реакция обменного разложения веществ водой
Слайд 3
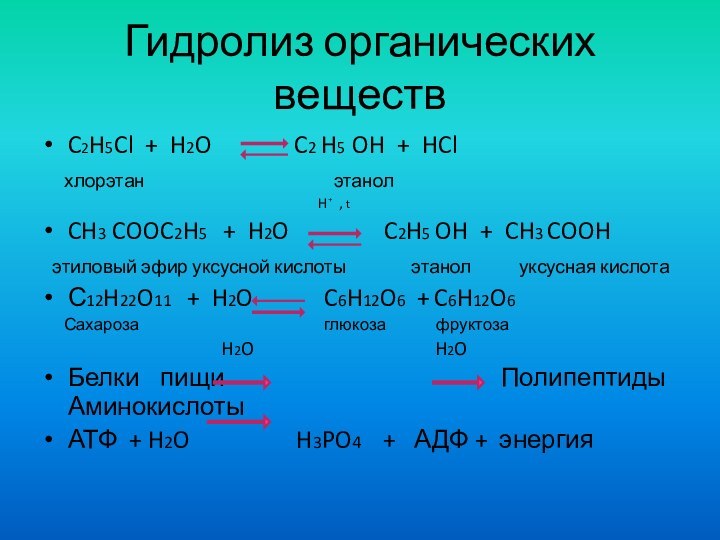
Гидролиз органических веществ
C2H5Cl + H2O
C2 H5 OH + HCl
хлорэтан этанол H⁺ , t
CH3 COOC2H5 + H2O C2H5 OH + CH3 COOH
этиловый эфир уксусной кислоты этанол уксусная кислота
С12H22O11 + H2O C6H12O6 + C6H12O6
Сахароза глюкоза фруктоза
H2O H2O
Белки пищи Полипептиды Аминокислоты
АТФ + H2O H3PO4 + АДФ + энергия
Слайд 4
Гидролиз бинарных соединений
Карбиды металлов:
CaC2 + 2H2O
Ca(OH)2 +C2H2
Al4C3 + 12H2O 4Al(OH)3 +3CH4 Галогениды неметаллов:
SiCl4 + 3H2O H2SiO3 + 4HCl
Фосфиды, нитриды некоторых металлов:
Mg3P2 + 6H2O 3Mg(OH)2 + 2PH3
Ca3N2 + 6H2O 3Ca(OH)2 + 2NH3
Слайд 5
Гидролиз солей
Водные растворы солей имеют разные
значения pH и различные типы сред – кислую (pH
< 7), щелочную (pH > 7), нейтральную (pH = 7). Сущность гидролиза сводится к обменному химическому взаимодействию катионов и анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов H⁺ или OH¯, и раствор соли становится кислотным или щелочным соответственно.Слайд 6 Любую соль можно представить как продукт взаимодействия основания
с кислотой. В зависимости от силы основания и кислоты
можно выделить 4 типа солей.
Слайд 7
Сильные основания
(Щелочи)
LiOH NaOH KOH
RbOH CsOH
Ca(OH)2 Sr(OH)2
Ba(OH)2
Cильные кислоты
HClO4 HNO3
H2SO4 HCl
HBr HI
Слайд 8 Гидролиз по аниону (соль образована сильным основанием и слабой
кислотой)
KNO2 = K⁺ + NO2¯
NO2¯ + HOH HNO2 + OH ¯ сокращенное ионное уравнение KNO2 +H2O HNO2 + KOH
молекулярное уравнение
Выводы:
По аниону соли, как правило, гидролизуются обратимо;
Химическое равновесие смещено влево;
Реакция среды – щелочная (pH > 7);
При гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
Слайд 9 Гидролиз по катиону (соль образована слабым основанием и сильной
кислотой)
Ni(NO3)2 = Ni²⁺ + 2 NO3¯
Ni²⁺
+ HOH NiOH⁺ + H⁺ сокращенное ионное уравнение
Ni(NO3)2 + H2O NiOHNO3 + HNO3
молекулярное уравнение
Выводы:
По катиону соли, как правило, гидролизуются обратимо;
Химическое равновесие смещено влево;
Реакция среды – кислотная (pH < 7);
При гидролизе солей, образованных слабыми многокислотными основаниями, получаются основные соли.
Слайд 10
Необратимый гидролиз
(соли образованы слабым основанием и слабой кислотой)
Al2S3 + 6H2O = 2Al(OH)3
+ 3H2S NH4(CH3COO) + H2O NH3 ∙ H2O + CH3COOH
Выводы:
Если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо;
Реакция среды при этом нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующегося основания и кислоты;
Гидролиз необратим, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
Слайд 11
Изменение направления гидролиза
Усиление
Добавить воды;
Нагреть раствор;
Связать один из продуктов
гидролиза в труднорастворимое соединение или в газовую фазу.
Подавление
Увеличить концентрацию
растворенного вещества;Охладить раствор;
Ввести в раствор один из продуктов гидролиза (подкислять раствор, если его среда кислотная, или подщелачивать, если щелочная).
Слайд 12
Применение гидролиза
Основной компонент мыла – это натриевые или
калиевые соли высших жирных кислот: стеараты, пальмитаты, которые гидролизуются.
С17H35COONa + H2O C17H35COOH + NaOH2. В фотографическом проявителе содержатся соли, создающие щелочную среду раствора (Na2CO3, K2CO3, Na2B4O7 – бура ).
Повышение кислотности почвы за счет внесения в нее (NH4)2SO4.
В составе крови содержатся: NaHCO3, Na2H2PO4. Они поддерживают определенную реакцию среды.
В составе слюны есть ионы HPO4¯, благодаря им в полости рта поддерживается определенная среда (pH =7 -7,5).
Слайд 13
Контрольный тест
1. Гидролиз солей – это взаимодействие
с водой
а) катионов или анионов любой (по растворимости)
солиб) катионов или анионов некоторых растворимых солей
в) молекул некоторых растворимых солей
г) только анионов некоторых растворимых солей
2. При гидролизе соли по аниону взаимодействует с водой
а) анион любой кислоты
б) анион любой слабой кислоты
в) анион любой сильной кислоты
г) не знаю
Слайд 14
3. Соль, гидролизуемая по аниону, - это
а)
Rb2CO3 б)
RbCl в) AgCl г) CaCO34. При гидролизе соли по катиону взаимодействует с водой
а) катион щелочи
б) катион гидроксида любого металла
в) катион любого гидроксида металла, кроме щелочей
г) не знаю
5. Соль гидролизуемая по катиону
а) Сa(NO3)2 б) FeCl3 в) RbSO4 г) KBr
6. Гидролизу не подвергается
а) SnCl4 б) FeCl3 в) ZnCl2 г) RbCl





























