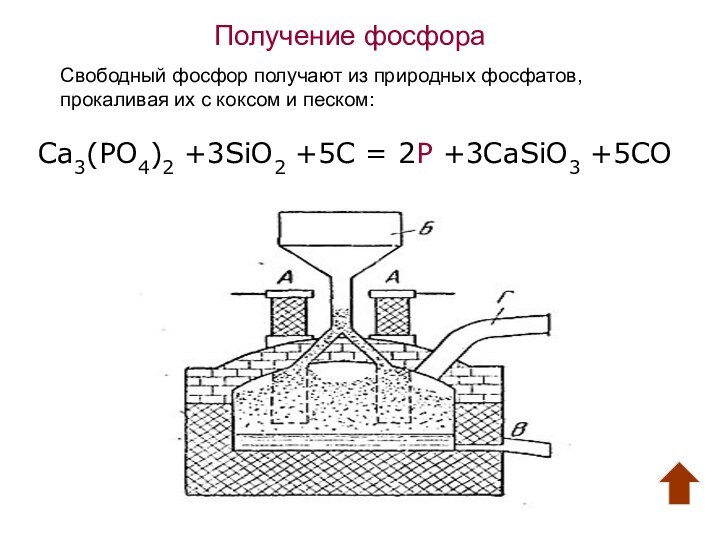
1669 г. Позже А. Лавуазье доказал, что фосфор самостоятельный
химический элемент. Ж. Пруст и М. Клапорт установили его широкое распространение в земной коре, в основном в виде фосфата кальция.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



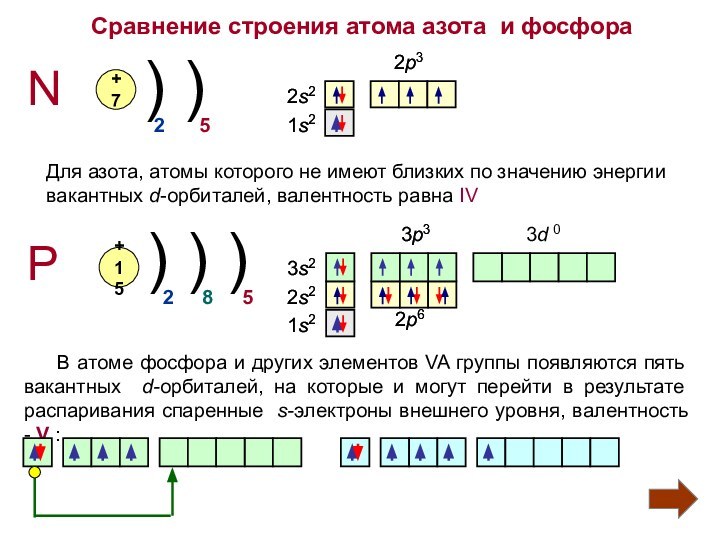



















1s22s22p63s23p3
валентные электроны
1s2
2s2
1s2
2s2
2p3
3p3
2p6
3s2
3d 0
1s2
1s2
2s2
2s2
2p3
2p6
3s2
3p3
В атоме фосфора и других элементов VA группы появляются пять вакантных d-орбиталей, на которые и могут перейти в результате распаривания спаренные s-электроны внешнего уровня, валентность - V :
3) с хлором
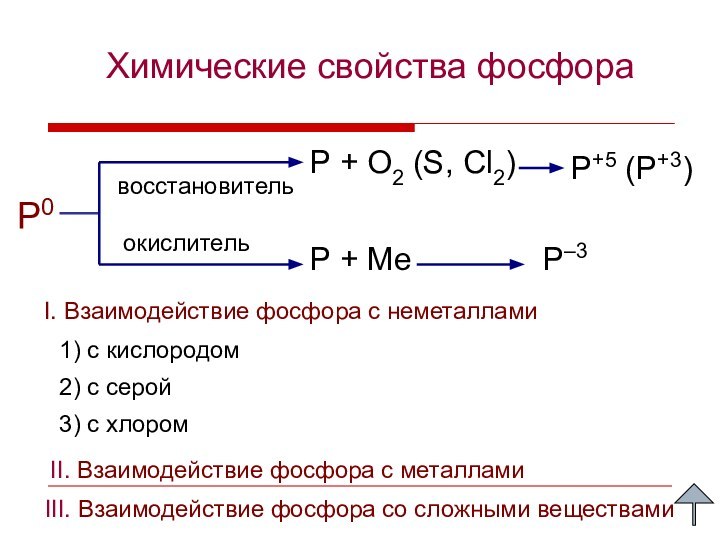
I. Взаимодействие фосфора с неметаллами
III. Взаимодействие фосфора со сложными веществами
P0 + O20 = P2+5O5–2
P0 –5e → P+5 5 4
O20 + 4e → 2O–2 4 5
4
5
2
Р0 – восстановитель, процесс окисления;
О20 – окислитель, процесс восстановления
Опыт №1
Опыт №2
При окислении фосфора в недостатке кислорода образуется Р2О3
4P0 +3O20 =2P2+5O3–2
Взаимодействие фосфора с кислородом
P0 – 3e → P+3 3 2
S0 + 2e → S–2 2 3
4
3
2
Р0 – восстановитель, процесс окисления;
S0 – окислитель, процесс восстановления
P0 + S0 = P2+5S3–2
P0 – 5e → P+3 5 2
S0 + 2e → S–2 2 5
4
5
2
Р0 – восстановитель, процесс окисления;
S0 – окислитель, процесс восстановления
5
2
P0 –5e → P+5 5 2
Cl20 + 2e → 2Cl–1 2 5
2
2
3
При пропускании хлора через трубку с красным фосфором в приемнике собирается бесцветная жидкость – хлорид фосфора (III). В избытке хлора фосфор сгорает бледно-зеленым пламенем с образованием хлорида фосфора (V), которые при охлаждении конденсируются в светло-желтые кристаллы.
Р0 – восстановитель, процесс окисления;
Cl20 – окислитель, процесс восстановления
Р0 – восстановитель, процесс окисления;
Cl20 – окислитель, процесс восстановления
Опыт
2
P0 + Ca0 = Ca3+2P2–3
P0 + 3e → P–3 3 2
Ca0 — 2e → Ca+2 2 3
2
3
Р0 – окислитель, процесс восстановления;
Cа0 – восстановитель, процесс окисления.
P + 5HNO3 = H3PO4 + 5NO2 + H2O
2P + 5H2SO4= 2H3PO4 + 5SO2 + 2H2O
2. Фосфор, особенно легко белый, вступает в реакцию с горячим
раствором щелочи:
4P + 3NaOH + 3H2O = PH3 + 3NaH2PO2
гипофосфит
натрия
3. В роли окислителя фосфора может быть бертолетова соль (хлорат
калия):
6P + 5KClO3 = 5KCl + 3P2O5
опыт
опыт
Фосфор применяется как раскислитель и компонент некоторых
металлических сплавов
Производство лекарственных
препаратов
Средства борьбы с вредителями
сельского хозяйства
Производство моющих средств
Органический синтез
Р2О5 как осушитель газов и
жидкостей