- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химический элемент фосфор
Содержание
- 2. Цель: рассмотреть особенности фосфора как химического элемента и простого вещества.
- 3. Задачи:1)Изучить теоретический материал о фосфоре ( строение
- 4. ФОСФОРЭлектронная формула: +15 Р 1s2 2s2
- 5. Относительная атомная масса 30,9738Порядковый номер 15Число протонов
- 6. Фосфор в природе Из-за большой химической
- 7. Аллотропные модификации фосфора
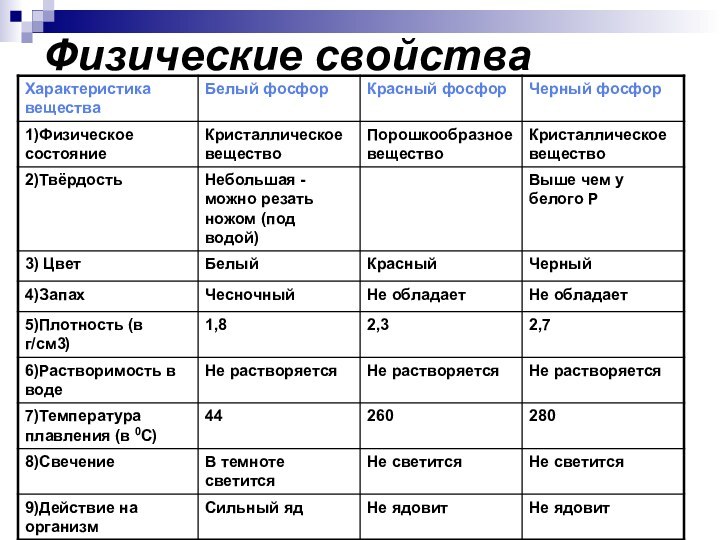
- 8. Физические свойства
- 9. Химические свойства При длительном нагревании
- 10. ПолучениеФосфор получают из фосфоритов и апатитов, нагревая
- 11. Применение Красный фосфор применяют в производстве спичек.
- 12. Важнейшие соединенияН3РО4 фосфорная кислота
- 13. Физические свойства P2O5 Белый, рыхлый порошок, гигроскопичный. Хранят в герметически закрытых сосудах.
- 14. Химические свойства P2O5 Проявляет свойства кислотного оксида.
- 15. Получение P2O5 Образуется при горении фосфора в
- 16. Применение P2O5Для осушки газовВ качестве водоотнимающего вещества
- 17. Скачать презентацию
- 18. Похожие презентации
Цель: рассмотреть особенности фосфора как химического элемента и простого вещества.
















Слайд 3
Задачи:
1)Изучить теоретический материал о фосфоре ( строение атома,
нахождение в природе, физические и химические свойства, получение и
применение).2)Результаты изучения теоретического материал представить в наглядном виде.
3)Сделать вывод о химической активности фосфора.
Слайд 5
Относительная атомная масса 30,9738
Порядковый номер 15
Число протонов в
ядре 15
Число нейтронов 16
Наиболее характерная степень окисления +3,
+5, реже встречается -3, -2, +1, +4
Слайд 6
Фосфор в природе
Из-за большой химической активности
фосфор в природе встречается только в соединениях.
Фосфор входит в состав:минералов фосфоритов и апатитов, в виде соединения фосфата кальция Ca3 (PO4)2;
крупнейшее месторождение апатитов находится на Кольском полуострове, в районе Хибинских гор. Залежи фосфоритов находятся в районе гор Каратау, в Московской, Калужской, Брянской областях и в других местах.
белковых веществ, содержащихся в генеративных органах растений;
нервной и костной тканей организмов животных и человека;
мозговых клеток.
Слайд 9
Химические свойства
При длительном нагревании белого
фосфора без доступа воздуха он желтеет и постепенно
превращается в красный фосфор. При нагревании красного фосфора в тех же условиях он превращается в пар, при конденсации которого образуется белый фосфор.Фосфор проявляет окислительные и восстановительные свойства.
Фосфор – восстановитель:
5О2 (изб.) + 4Р = 2Р2О5
3О2 (недост.) + 4Р = 2Р2О3
3Сl2 + 2P = 2PCl3 PСl3 + Cl2 = PCl5
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
4P + 16H2O = 4H3PO4 + 10H2
Фосфор – окислитель:
2Р + 3Mg = Mg3P2
Слайд 10
Получение
Фосфор получают из фосфоритов и апатитов, нагревая их
в электрической печи без доступа воздуха в присутствии оксида
кремния (IV) и угляСа3(РО4)2+5С+3SiO2 t 3CaSiO3+2P+5CO
пары фосфора конденсируются под водой, и при этом образуется белый фосфор, в узлах кристаллической решётки которого находятся молекулы Р4.
Слайд 11
Применение
Красный фосфор применяют в производстве спичек. Его
вместе с тонко измельченным стеклом и клеем наносят на
боковую сторону коробка. При трении спичечной головки, в состав которой входят хлорат калия KClО3 и сера, происходит воспламенение:6Р+5KClO3 5KCl+3P2O5
Белый фосфор в военное время использовали в зажигательных бомбах и для создания дымовых завес.
Слайд 13
Физические свойства P2O5
Белый, рыхлый порошок, гигроскопичный.
Хранят в герметически закрытых сосудах.
Слайд 14
Химические свойства P2O5
Проявляет свойства кислотного оксида.
1)
реагирует с водой:
P2O5 + H2O
2HPO3 P2O5 + 3H2O t 2H3PO4
2) реагирует с основными оксидами:
P2O5 + 3К2O 2К3РО4
3) реагирует с основаниями:
P2O5 + 6NaOH 2Na3РО4 + 3H2O