- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Иммобилизованные ферменты в микроанализе
Содержание
- 2. Иммобилизованные ферменты(от лат. immobiiis - неподвижный), препараты ферментов, молекулы
- 3. Аналитические проточные реакторы с иммобилизованными ферментами
- 4. Ферментный микрокалориметрический датчик состоит из двух идентичных
- 5. Ферментные электроды.новый тип электрохимических систем в ионометрии.
- 6. Устройство ферментного электрода.Ферментный электрод, специфичный по отношению
- 7. Ферментный электрод можно использовать для определения концентрации
- 8. Применение ферментных электродовПрименение ферментных электродов существенно расширило
- 9. Биолюминесцентный микроанализ является одним из наиболее перспективных
- 10. Применение биолюминесцентного анализа.Светящиеся штаммы бактерий из Коллекции
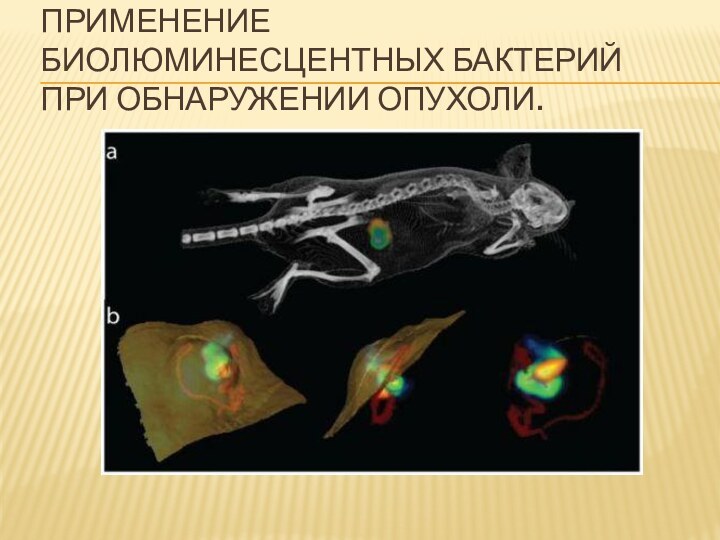
- 11. Применение биолюминесцентных бактерий при обнаружении опухоли.
- 12. Скачать презентацию
- 13. Похожие презентации
Иммобилизованные ферменты(от лат. immobiiis - неподвижный), препараты ферментов, молекулы которых связаны с матрицей, или носителем (как правило, полимером), сохраняя при этом полностью или частично свои каталитические свойства.











Слайд 2
Иммобилизованные ферменты
(от лат. immobiiis - неподвижный), препараты ферментов, молекулы которых
Слайд 3
Аналитические проточные реакторы с иммобилизованными ферментами
Оригинальный вариант ферментного
реактора предложили итальянские химики (В. Маркони и др., 1975).
Они разработали метод включения фермента внутрь полых волокон триацетатцеллюлозы в момент ее формования, т. е. в момент вытягивания нити из раствора. Фермент оказывался включенным во внутреннюю полость, куда могут проникать только низкомолекулярные субстраты. Эти нити накручивали в виде катушек, заключали в стеклянную оболочку и через такой ферментный реактор пропускали анализируемую смесь.С помощью этого метода В. Маркони определял пенициллин, мочевину, глюкозу и другие важные для клинической химии вещества.
Слайд 4
Ферментный микрокалориметрический датчик
состоит из двух идентичных колонок, заполненных
иммобилизованным на стекле или сефарозе ферментом.
В нижней части
каждой колонки имеется термистор. Если через обе колонки прокачивается буферный раствор и никакой реакции не происходит, то разность температур между двумя термисторами равна нулю. Когда в измерительную колонку вводится буферный раствор, содержащий анализируемый субстрат, то в результате ферментативного превращения субстрата выделяется теплота. Температура в этой колонке повышается. Фиксируемая разность температур пропорциональна количеству превращенного субстрата. Преимущество такого термометрического датчика состоит прежде всего в том, что он может быть использован для любой ферментной системы, непрозрачных сред, для реакций, где не образуется окрашенного продукта. Чувствительность метода позволяет обнаруживать микромолярные количества самых разнообразных веществ.
Слайд 5
Ферментные электроды.
новый тип электрохимических систем в ионометрии.
Они
сочетают селективность и чувствительность энзимных методов анализа со скоростью
и простотой измерений ионометрического метода.Понятие «ферментный электрод» появилось в 1967 г. после выхода из печати работ Апдайка и Хикса с описанием такого электрод для определения глюкозы.
По номенклатуре ШРАС ферментный электрод определяется как датчик, «в котором ионоселективный электрод покрыт слоем, содержащим фермент, вызывающий реакцию органического или неорганического вещества (субстрата) с образованием частиц (ионов), обусловливающих отклик электрода». Б настоящее время понятие «ферментный электрод» несколько расширилось, так как в него включают электрохимические системы с ферментом, иммобилизованным не только на чувствительном элементе ионоселективного электрода, но и на носителе, расположенном на некотором расстоянии от него, или даже в растворе.
Слайд 6
Устройство ферментного электрода.
Ферментный электрод, специфичный по отношению к
определенному субстрату, как правило, можно выполнить в нескольких вариантах,
различающихся типом индикаторного датчика, который регистрирует в процессе реакции изменение либо потенциала,либо тока и способом введения фермента (в растворимом или иммобилизованном виде).В качестве электрохимических датчиков чаще всего применяются: платиновый электрод (амперометрнческий); различные ионоселективные электроды (стеклянный для измерения рН); газовые электроды.
Обычно фермент в ферментном электроде присутствует в иммобилизованном состоянии. Чаще всего применяют эти три способа иммобилизации: ковалентное связывание с поверхностью электрода; внедрение фермента в сетку геля или полимера; ковалентную сшивку молекул фермента друг с другом при помощи би- или полифункционального реагента.
Слайд 7 Ферментный электрод можно использовать для определения концентрации не
только продуктов ферментативной реакции, но любого участвующего в этой
реакции вещества, что особенно важно для многостадийных реакций, а также для определения активности фермента, концентраций его ингибиторов и активаторов.
Слайд 8
Применение ферментных электродов
Применение ферментных электродов существенно расширило рамки
ионометрии, позволив определять концентрацию недиссоциироваиных соединений и проводить анализ
водных растворов многих органических соединений. Важное свойство ферментов, обеспечивающее их применение в ионометрии, уникальная специфичность по отношению к ферментативной реакции и к субстрату.Каждый фермент катализирует только один тип реакции; каталитическая активность фермента максимальна для определенных условий среды— оптимальных значений рН, температуры, окислительного потенциала, ее химического состава. Субстратная специфичность ферментов, выделяющая их из всех катализаторов неферментного происхождения, столь четко выражена, что фермент катализирует реакцию только одного стереоизомера или одного члена гомологического ряда, оставаясь инертным по отношению ко всем другим веществам. Таким образом, применение ферментов для создания нанометрических датчиков в первую очередь определяется их высокой селективностью.