Слайд 2
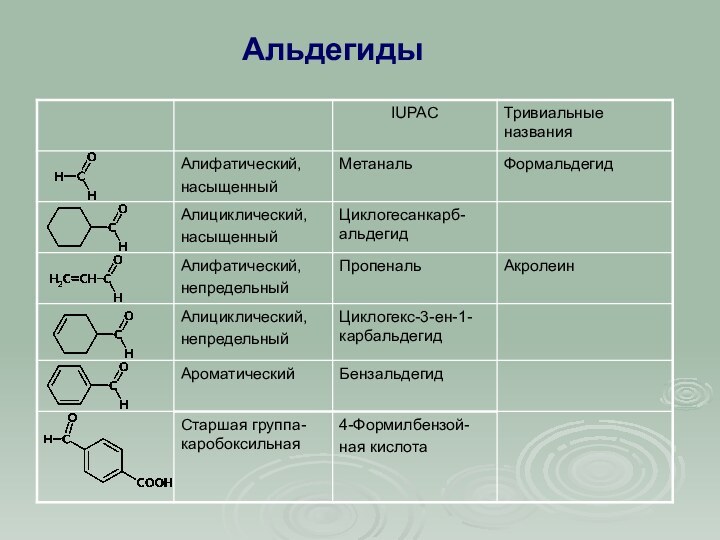
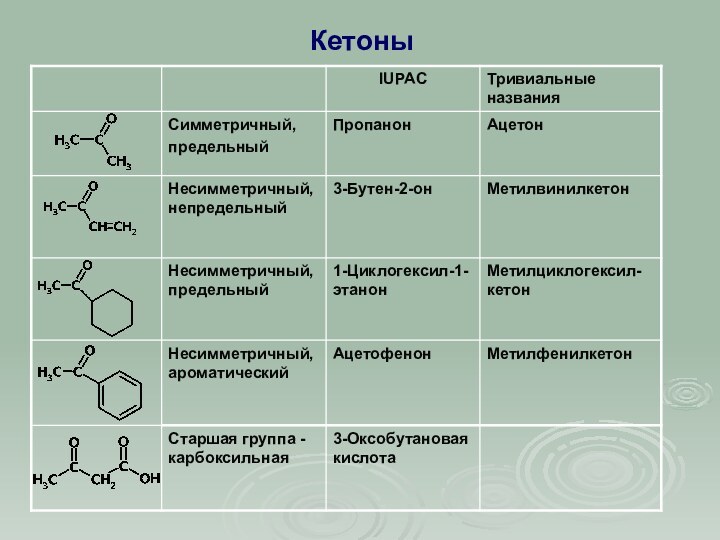
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
К этому классу относятся соединения, в состав
которых входит карбонильная группа
,
соединенная с углеводородным радикалом и
водородом (альдегиды )
или с двумя углеводородными радикалами
(кетоны )
Слайд 5
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Строение карбонильной группы
Атом углерода карбонильной группы
находится в sp2-гибридном состоянии, он соединен с тремя другими
атомами (С, Н, О или С, С, О) -связями, остающаяся р-орбиталь перекрывается с р-орбиталью атома кислорода, образуя -связь. Карбонильный углерод и атомы, связанные с ним, лежат в одной плоскости
Слайд 6
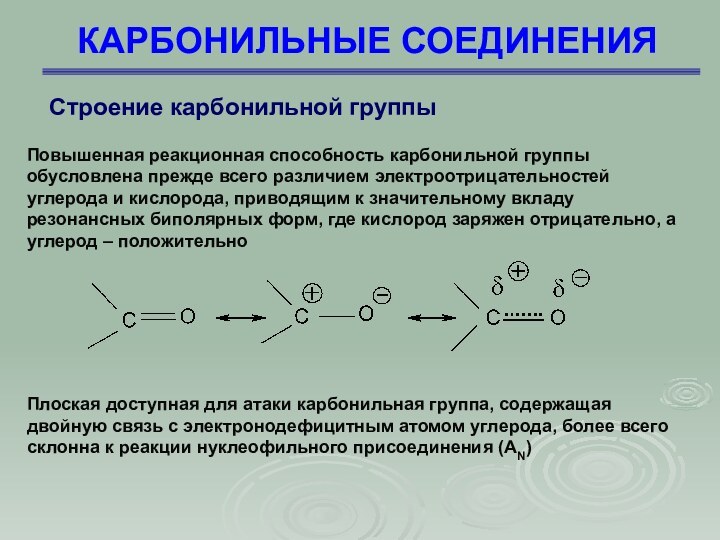
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Строение карбонильной группы
Повышенная реакционная способность карбонильной
группы обусловлена прежде всего различием электроотрицательностей углерода и кислорода,
приводящим к значительному вкладу резонансных биполярных форм, где кислород заряжен отрицательно, а углерод – положительно
Плоская доступная для атаки карбонильная группа, содержащая двойную связь с электронодефицитным атомом углерода, более всего склонна к реакции нуклеофильного присоединения (АN)
Слайд 7
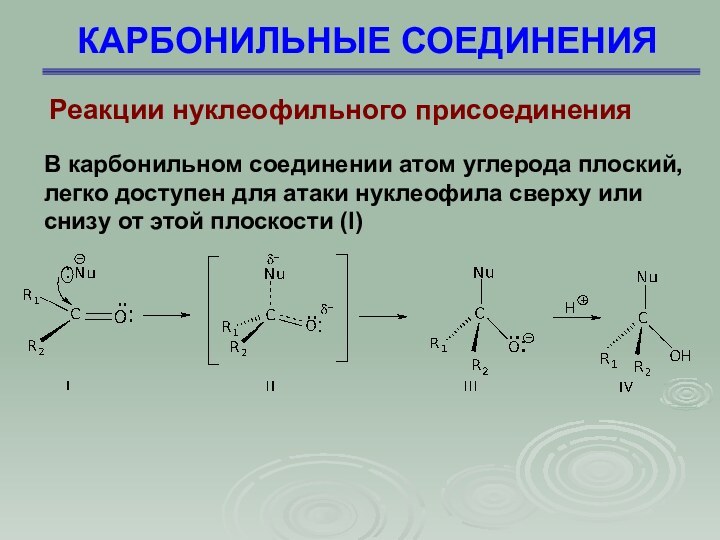
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции нуклеофильного присоединения
В карбонильном соединении атом
углерода плоский, легко доступен для атаки нуклеофила сверху или
снизу от этой плоскости (I)
Слайд 8
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции нуклеофильного присоединения
Нуклеофил, подавая электроны на
атом углерода начинает образовывать с ним -связь, а кислород
- приобретает электроны. Атом углерода становится близок к тетраэдрическому. Продукт реакции присоединения (III) - ион, в котором атом углерода находится в sp3-гибридном состоянии – тетраэдр, на кислороде - целый отрицательный заряд. Именно способность кислорода нести отрицательный заряд обусловливает реакционную способность карбонильных соединений по отношению к нуклеофилам. Стабилизация полученного иона происходит за счет присоединения протона воды или кислоты (IV)
Слайд 9
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
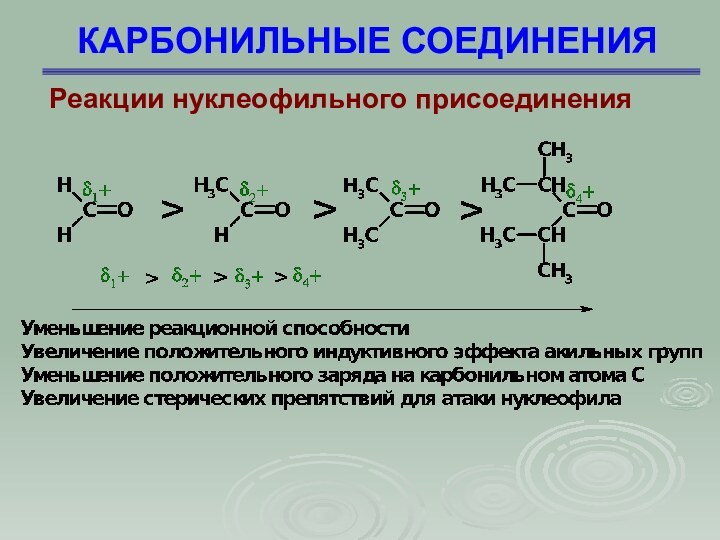
Реакции нуклеофильного присоединения
Реакционная способность карбонильных соединений
определяется пространственными и электронными факторами. Поскольку в переходном состоянии
углерод карбонила начинает принимать тетраэдрическую конфигурацию и атомы, связанные с ним несколько сближаются, то чем больше группы R1 и R2, тем сильнее они препятствуют такому сближению. При увеличении объема заместителей, расположенных у карбонила, реакционная способность уменьшается
В том же направлении действуют и электронные факторы. Алкильные группы проявляют электронодонорный индукционный эффект, дестабилизируют переходное состояние, увеличивая отрицательный заряд на атоме углерода, который подвергается атаке нуклеофила
Слайд 10
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции нуклеофильного присоединения
Слайд 12
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
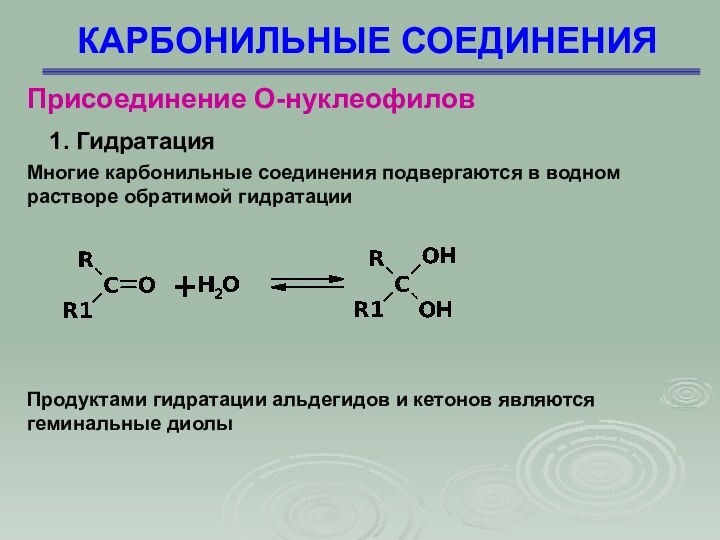
Присоединение О-нуклеофилов
1. Гидратация
Многие карбонильные соединения подвергаются
в водном растворе обратимой гидратации
Продуктами гидратации альдегидов и
кетонов являются
геминальные диолы
Слайд 13
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
1. Гидратация
Гидратация может протекать в
условиях как общего кислотного, так и основного катализа, т.е.
скорость лимитирующая стадия включает или протонирование карбонильного соединения (кислотный катализ), или превращение Н2О в более сильный нуклеофил –ОН
Слайд 14
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
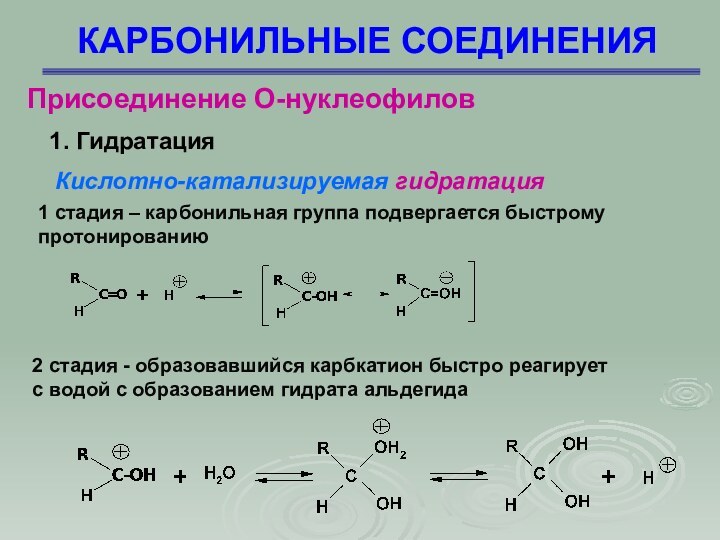
Присоединение О-нуклеофилов
1. Гидратация
Кислотно-катализируемая гидратация
1 стадия –
карбонильная группа подвергается быстрому
протонированию
2 стадия - образовавшийся карбкатион
быстро реагирует
с водой с образованием гидрата альдегида
Слайд 15
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
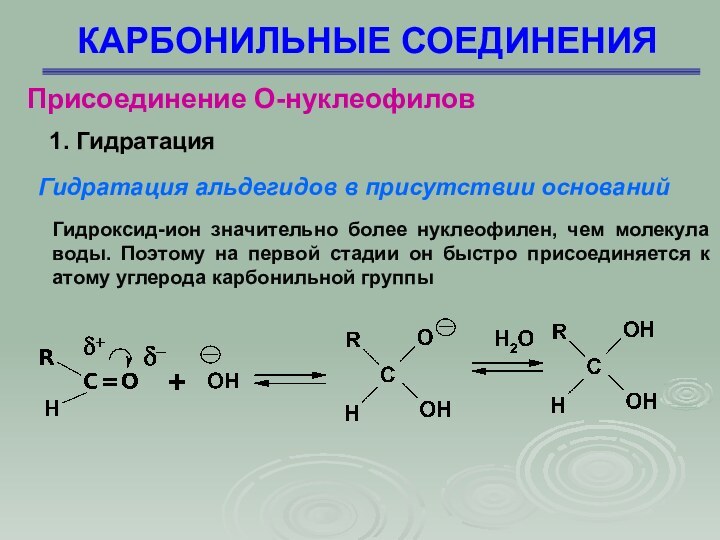
Присоединение О-нуклеофилов
1. Гидратация
Гидратация альдегидов в присутствии
оснований
Гидроксид-ион значительно более нуклеофилен, чем молекула воды. Поэтому на
первой стадии он быстро присоединяется к атому углерода карбонильной группы
Слайд 16
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
1. Гидратация
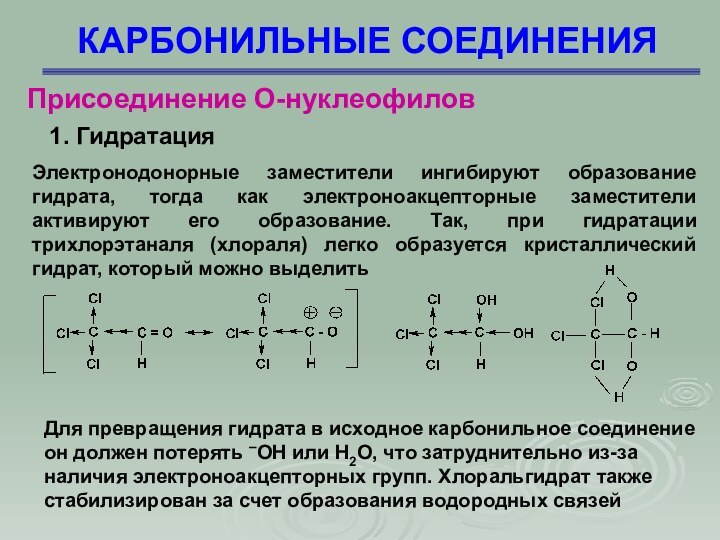
Электронодонорные заместители ингибируют образование
гидрата, тогда как электроноакцепторные заместители активируют его образование. Так,
при гидратации трихлорэтаналя (хлораля) легко образуется кристаллический гидрат, который можно выделить
Для превращения гидрата в исходное карбонильное соединение он должен потерять –ОН или Н2О, что затруднительно из-за наличия электроноакцепторных групп. Хлоральгидрат также стабилизирован за счет образования водородных связей
Слайд 17
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
1. Гидратация
Слайд 18
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
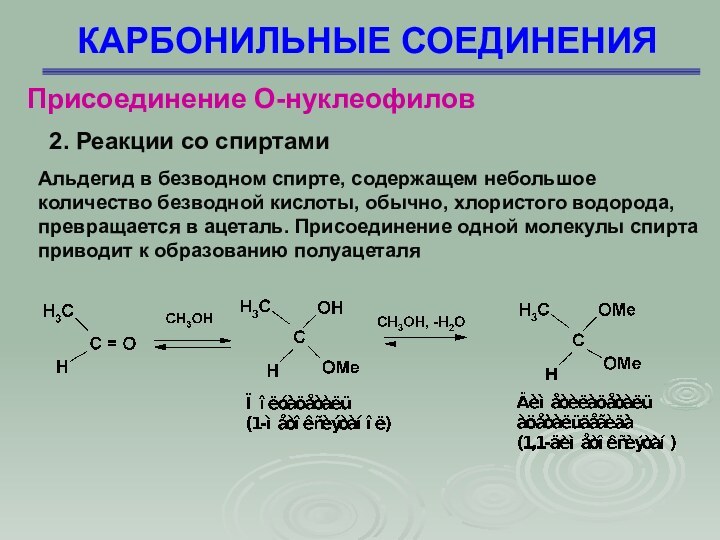
Альдегид в безводном спирте, содержащем небольшое
количество безводной кислоты, обычно, хлористого водорода, превращается в ацеталь.
Присоединение одной молекулы спирта приводит к образованию полуацеталя
2. Реакции со спиртами
Слайд 19
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
2. Реакции со спиртами
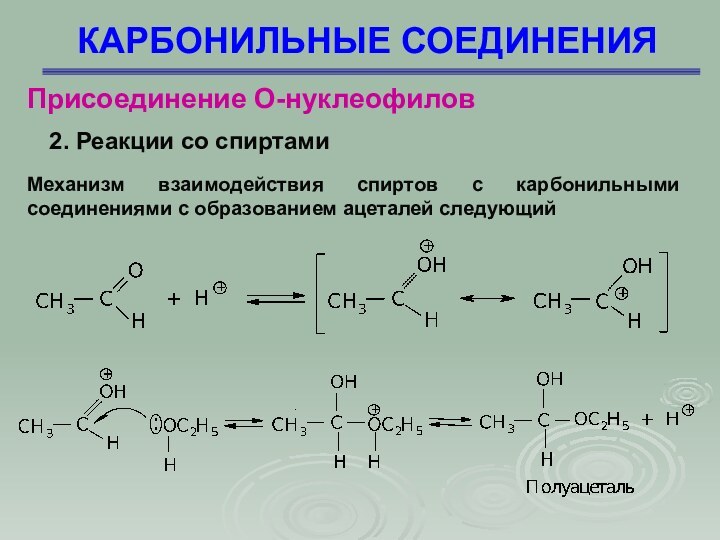
Механизм взаимодействия
спиртов с карбонильными соединениями с образованием ацеталей следующий
Слайд 20
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
2. Реакции со спиртами
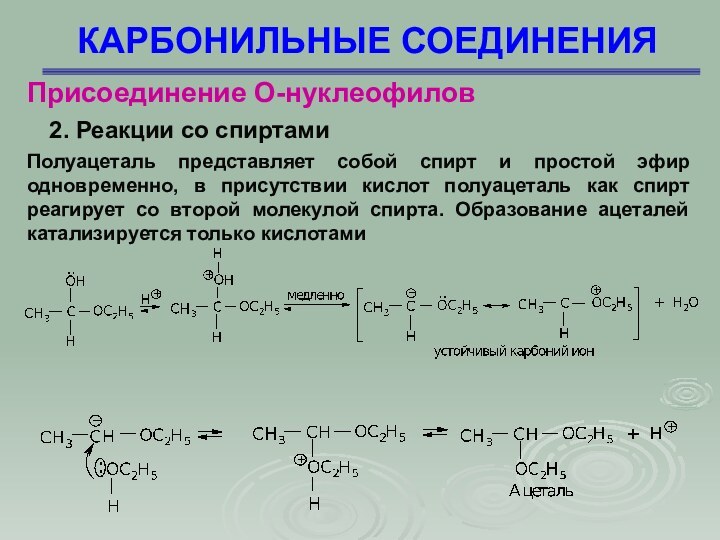
Полуацеталь представляет
собой спирт и простой эфир одновременно, в присутствии кислот
полуацеталь как спирт реагирует со второй молекулой спирта. Образование ацеталей катализируется только кислотами
Слайд 21
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
2. Реакции со спиртами
Ацетали –
простые эфиры и как простые эфиры устойчивы по отношению
к основаниям, но в отличие от них, расщепляются кислотами значительно легче. Это объясняется тем, что на лимитирующей стадии обеих реакций – образование и расщепление ацеталей – образуется устойчивый карбониевый ион.
Слайд 22
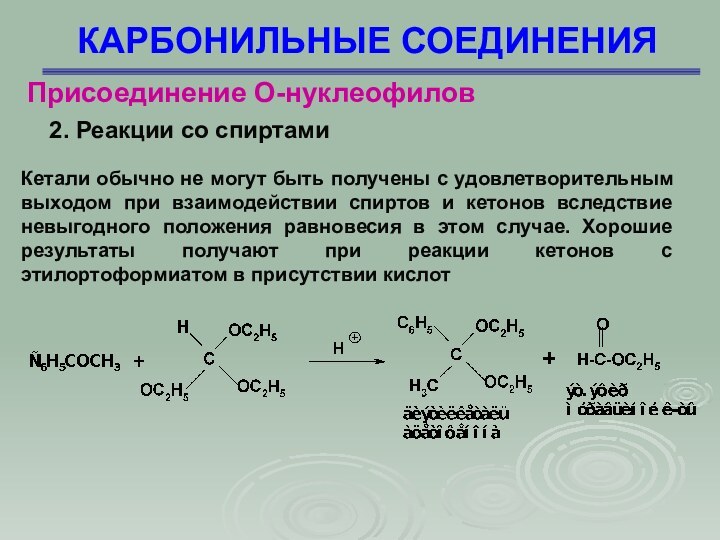
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
2. Реакции со спиртами
Кетали обычно
не могут быть получены с удовлетворительным выходом при взаимодействии
спиртов и кетонов вследствие невыгодного положения равновесия в этом случае. Хорошие результаты получают при реакции кетонов с этилортоформиатом в присутствии кислот
Слайд 23
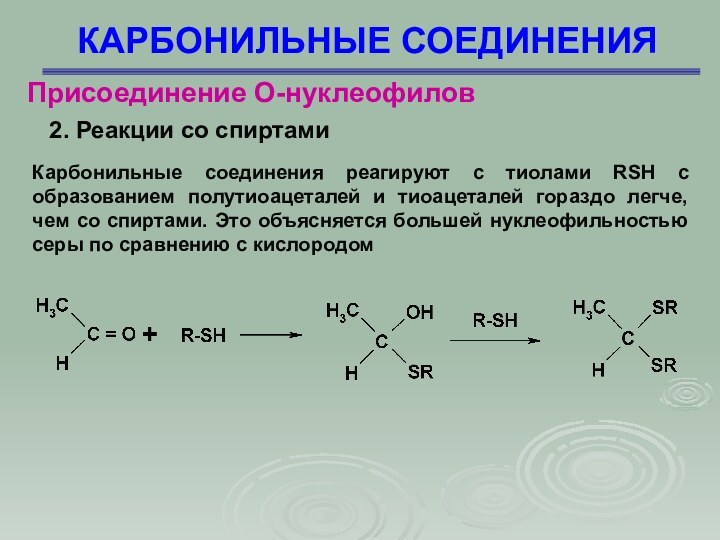
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
2. Реакции со спиртами
Карбонильные соединения
реагируют с тиолами RSH с образованием полутиоацеталей и тиоацеталей
гораздо легче, чем со спиртами. Это объясняется большей нуклеофильностью серы по сравнению с кислородом
Слайд 24
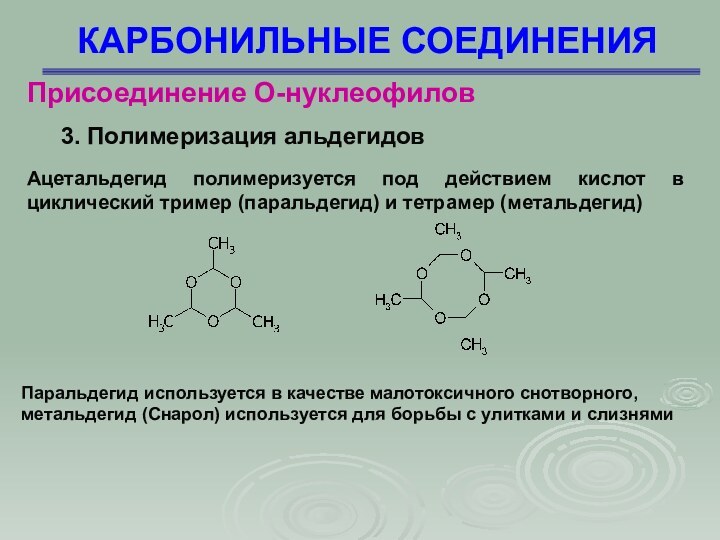
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
3. Полимеризация альдегидов
Реакция имеет много
общего с образованием ацеталей. Образуются как линейные, так и
циклические полимеры
парафрмальдегид (полиоксиметилен)
Это вещество при нагревании регенерирует формальдегид, поэтому служит удобным источником газообразного формальдегида
Слайд 25
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
3. Полимеризация альдегидов
При нагревании с
разбавленной кислотой пароформ образует твердый тример – триоксиметилен (т.пл
61 С)
Полимеры формальдегида нашли в последнее время большое значение в качестве пластических масс. Для получения более стабильных полимеров защищают концевые гидроксильные группы путем алкилирования или ацилирования. Фирма Дюпон выпускает полимер «Дельрин», обладающий исключительной прочностью и легко формующийся
Слайд 26
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов
3. Полимеризация альдегидов
Ацетальдегид полимеризуется под
действием кислот в циклический тример (паральдегид) и тетрамер (метальдегид)
Паральдегид
используется в качестве малотоксичного снотворного, метальдегид (Снарол) используется для борьбы с улитками и слизнями
Слайд 27
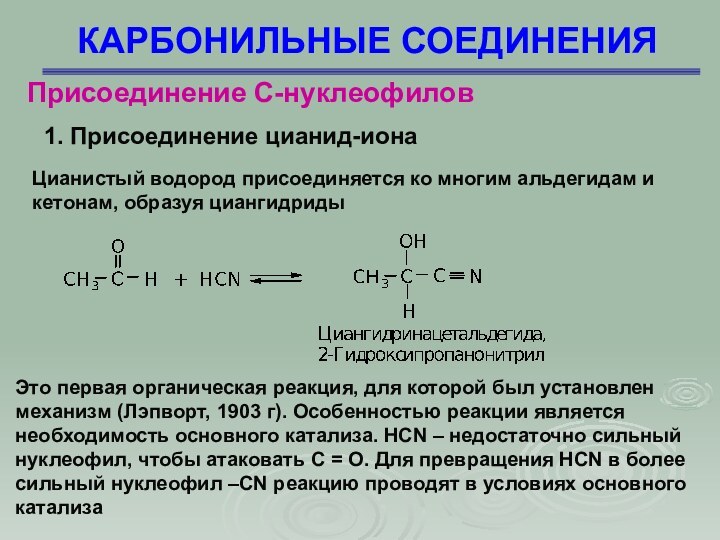
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение С-нуклеофилов
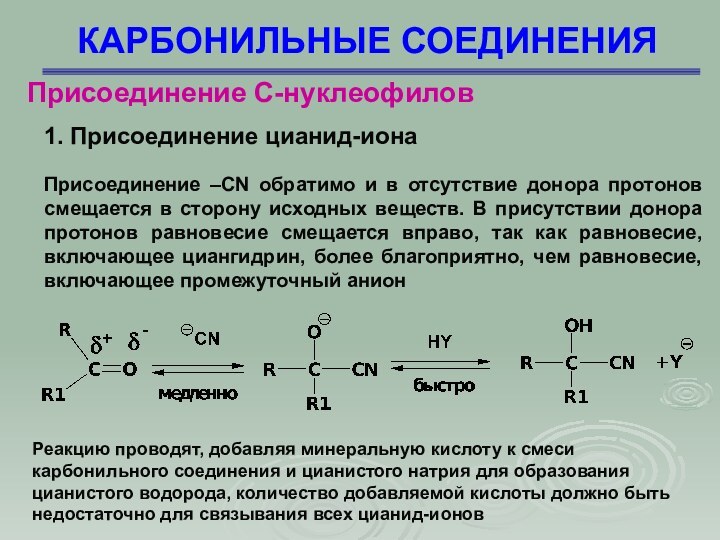
1. Присоединение цианид-иона
Цианистый водород присоединяется
ко многим альдегидам и кетонам, образуя циангидриды
Это первая
органическая реакция, для которой был установлен механизм (Лэпворт, 1903 г). Особенностью реакции является необходимость основного катализа. HCN – недостаточно сильный нуклеофил, чтобы атаковать С = О. Для превращения HCN в более сильный нуклеофил –СN реакцию проводят в условиях основного катализа
Слайд 28
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение С-нуклеофилов
Присоединение –CN обратимо и в отсутствие
донора протонов смещается в сторону исходных веществ. В присутствии
донора протонов равновесие смещается вправо, так как равновесие, включающее циангидрин, более благоприятно, чем равновесие, включающее промежуточный анион
Реакцию проводят, добавляя минеральную кислоту к смеси карбонильного соединения и цианистого натрия для образования цианистого водорода, количество добавляемой кислоты должно быть недостаточно для связывания всех цианид-ионов
1. Присоединение цианид-иона
Слайд 29
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение С-нуклеофилов
Эти реакции имеют практическое применение для
получения
-оксикислот, цианалкенов и непредельных кислот
1. Присоединение цианид-иона
Слайд 30
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
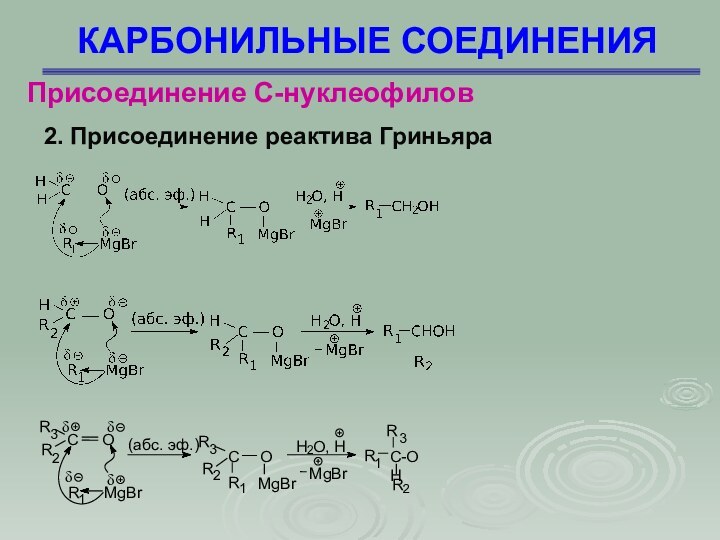
Присоединение С-нуклеофилов
2. Присоединение реактива Гриньяра
Слайд 31
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
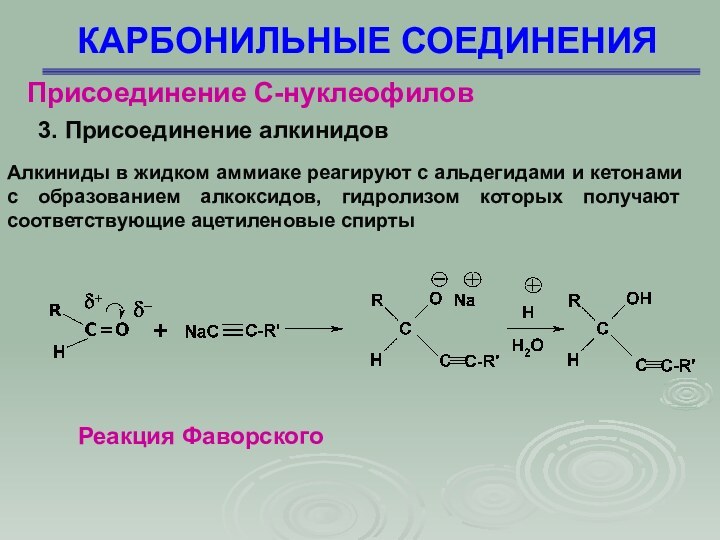
Присоединение С-нуклеофилов
3. Присоединение алкинидов
Алкиниды в жидком
аммиаке реагируют с альдегидами и кетонами с образованием алкоксидов,
гидролизом которых получают соответствующие ацетиленовые спирты
Реакция Фаворского
Слайд 32
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
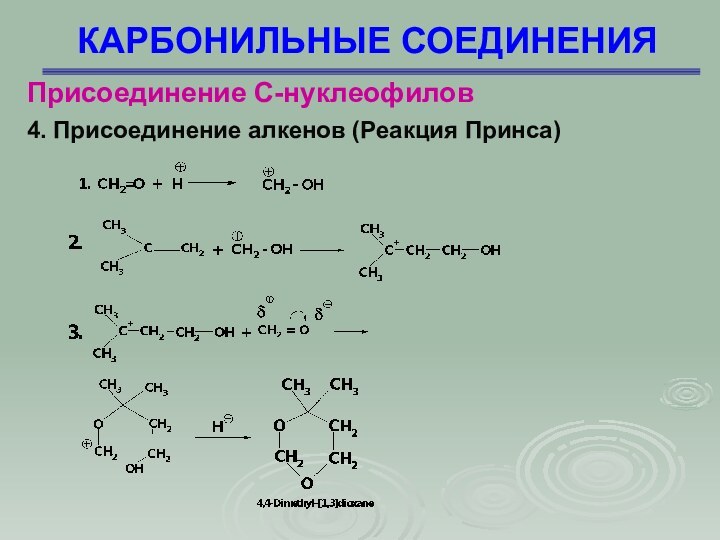
Присоединение С-нуклеофилов
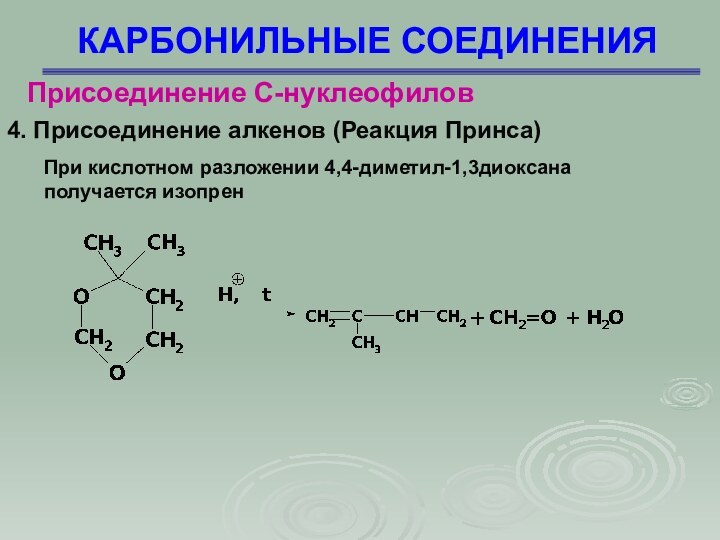
4. Присоединение алкенов (Реакция Принса)
Слайд 33
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение С-нуклеофилов
При кислотном разложении 4,4-диметил-1,3диоксана
получается изопрен
4.
Присоединение алкенов (Реакция Принса)
Слайд 34
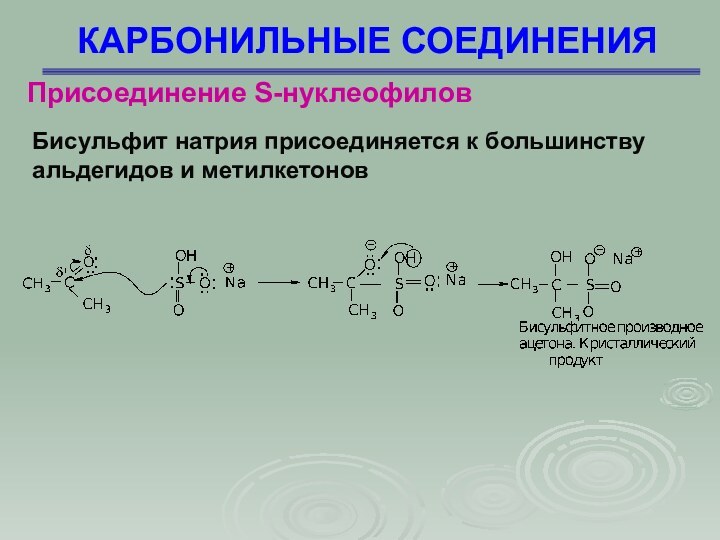
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение S-нуклеофилов
Бисульфит натрия присоединяется к большинству
альдегидов
и метилкетонов
Слайд 35
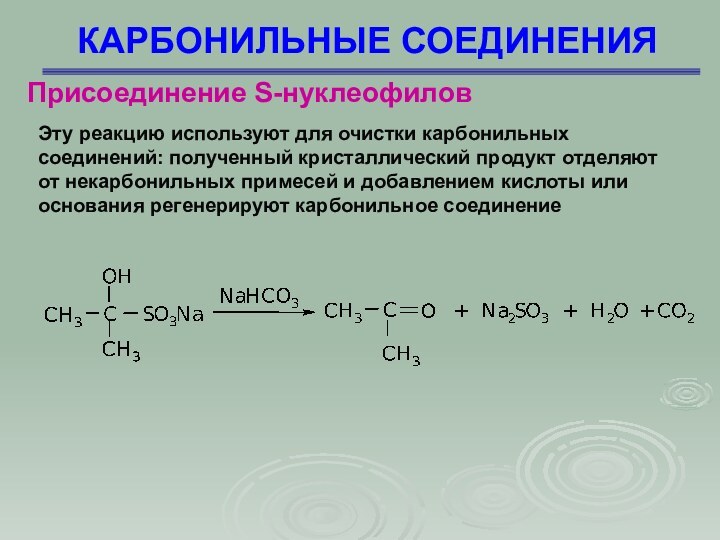
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение S-нуклеофилов
Эту реакцию используют для очистки карбонильных
соединений: полученный кристаллический продукт отделяют от некарбонильных примесей и
добавлением кислоты или основания регенерируют карбонильное соединение
Слайд 36
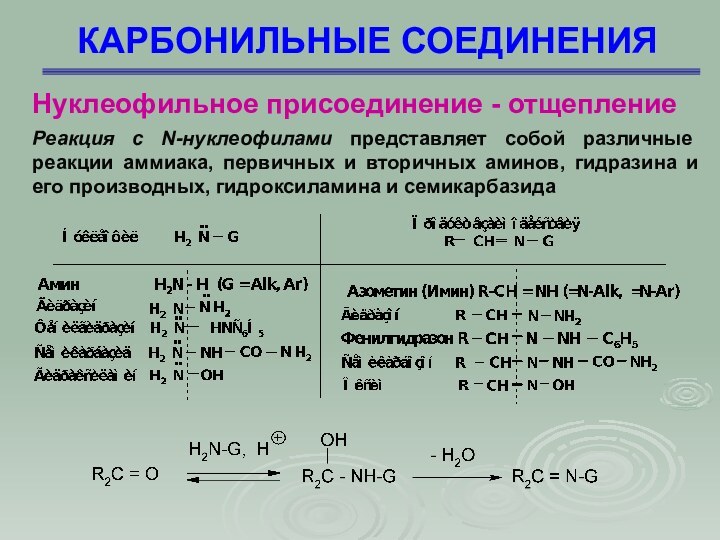
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение - отщепление
Известен ряд реакций
нуклеофильного присоединения к группе С = О , в
которых присоединяющийся нуклеофил содержит кислый протон, поэтому становится возможным последующее отщепление Н2О, т.е. происходит замещение атома кислорода. Например, с альдегидами и кетонами взаимодействуют соединения, родственные аммиаку G-NH2. В этом случае реакция протекает как нуклеофильное присоединение с последующим отщеплением воды (AdN, E)
Слайд 37
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение - отщепление
Реакция с N-нуклеофилами
представляет собой различные реакции аммиака, первичных и вторичных аминов,
гидразина и его производных, гидроксиламина и семикарбазида
Слайд 38
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение - отщепление
Поскольку нуклеофил слабый
– частица, не имеющая заряда, его присоединение катализируется кислотой.
Предварительное протонирование карбонильного соединения делает его более реакционноспособным: на карбонильном углероде увеличивается положительный заряд (I), что позволяет кислороду приобрести пару электронов в результате нуклеофильной атаки, не получая при этом отрицательного заряда (II)
Слайд 39
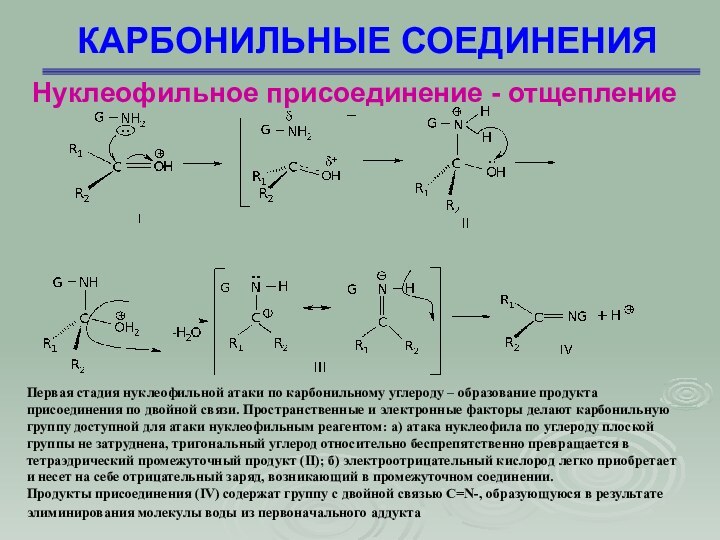
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение - отщепление
Первая стадия нуклеофильной
атаки по карбонильному углероду – образование продукта присоединения по
двойной связи. Пространственные и электронные факторы делают карбонильную группу доступной для атаки нуклеофильным реагентом: а) атака нуклеофила по углероду плоской группы не затруднена, тригональный углерод относительно беспрепятственно превращается в тетраэдрический промежуточный продукт (II); б) электроотрицательный кислород легко приобретает и несет на себе отрицательный заряд, возникающий в промежуточном соединении.
Продукты присоединения (IV) содержат группу с двойной связью C=N-, образующуюся в результате элиминирования молекулы воды из первоначального аддукта
Слайд 40
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение - отщепление
Следует учесть, что
производные аммиака G-NH2 (также как и спирты
R-OH) являются
основаниями и взаимодействуют с кислотами, теряя при этом способность, реагировать как нуклеофилы
раствор должен быть настолько слабокислым, чтобы значительное количество реагента оставалось не протонированным, и настолько сильнокислым, чтобы сделать достаточно реакционноспособным карбонильное соединение
Слайд 41
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
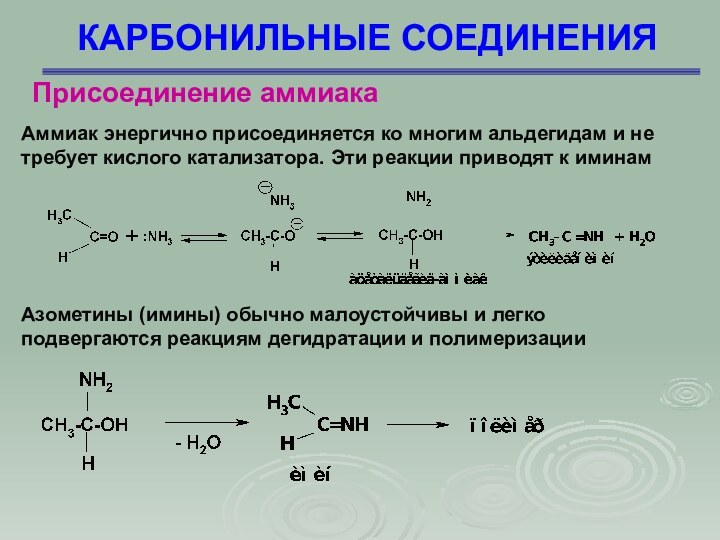
Аммиак энергично присоединяется ко многим альдегидам и
не требует кислого катализатора. Эти реакции приводят к иминам
Присоединение аммиака
Азометины (имины) обычно малоустойчивы и легко подвергаются реакциям дегидратации и полимеризации
Слайд 42
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение аммиака
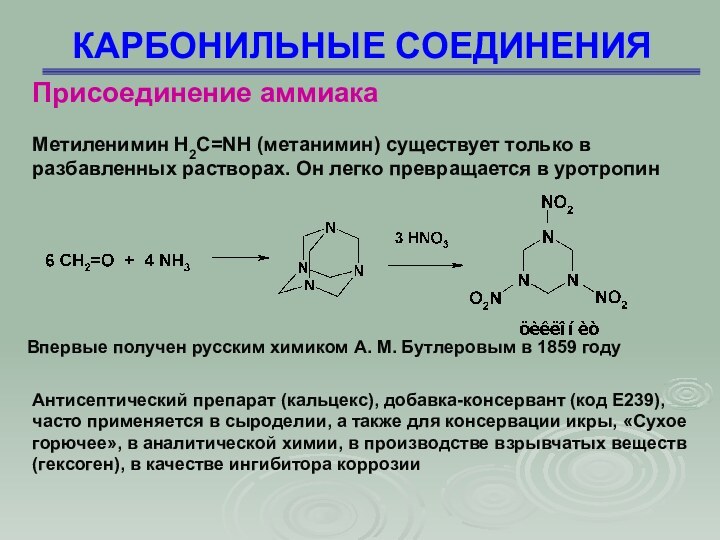
Метиленимин H2C=NH (метанимин) существует только
в разбавленных растворах. Он легко превращается в уротропин
Впервые
получен русским химиком А. М. Бутлеровым в 1859 году
Антисептический препарат (кальцекс), добавка-консервант (код E239), часто применяется в сыроделии, а также для консервации икры, «Сухое горючее», в аналитической химии, в производстве взрывчатых веществ (гексоген), в качестве ингибитора коррозии
Слайд 43
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
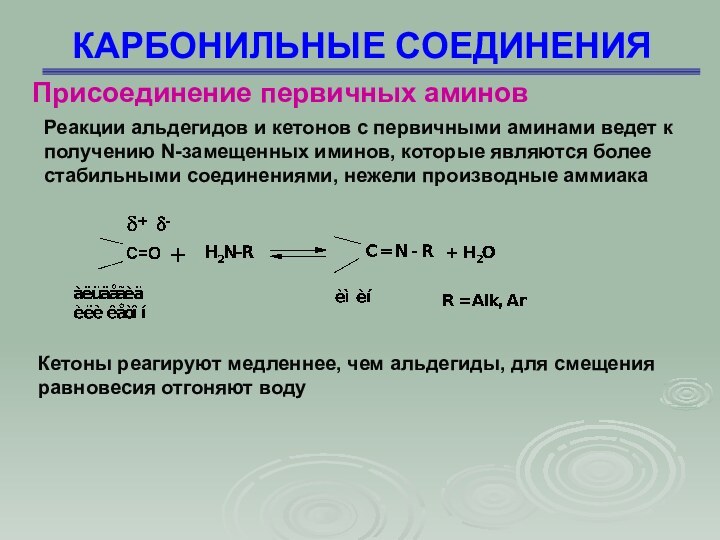
Реакции альдегидов и кетонов с первичными аминами
ведет к получению N-замещенных иминов, которые являются более стабильными
соединениями, нежели производные аммиака
Присоединение первичных аминов
Кетоны реагируют медленнее, чем альдегиды, для смещения равновесия отгоняют воду
Слайд 44
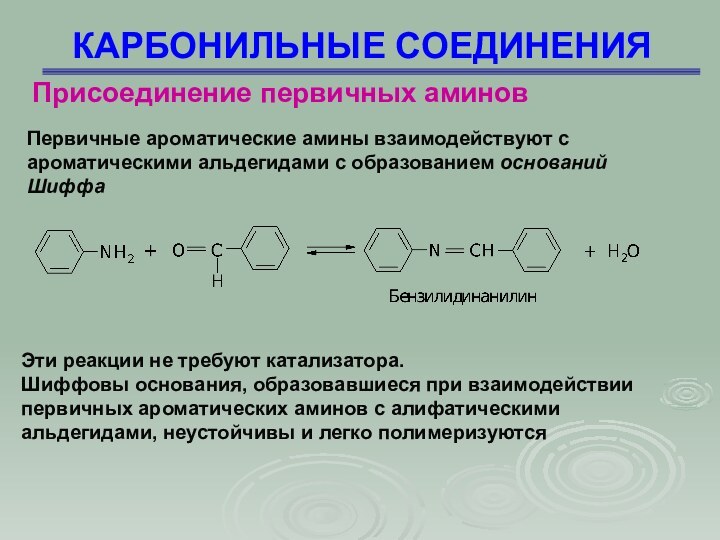
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение первичных аминов
Первичные ароматические амины взаимодействуют с
ароматическими альдегидами с образованием оснований Шиффа
Эти реакции не
требуют катализатора.
Шиффовы основания, образовавшиеся при взаимодействии первичных ароматических аминов с алифатическими альдегидами, неустойчивы и легко полимеризуются
Слайд 45
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
ШИФФ
Хуго Йозеф
1834 – 1915
Присоединение первичных аминов
Хуго
Йозеф Шифф – итальянский химик. В 1857 г. окончил Гёттингенский
университет, где учился у Ф. Вёлера. Основные исследовательские работы относятся к органической химии. В 1857 г. получил тионилхлорид действием диоксида серы на пентахлорид фосфора. Описал (1859) методику капельного анализа. В 1864 г. открыл продукты конденсации альдегидов с анилином и другими аминами – азометины, позднее названные основаниями Шиффа. Предложил качественную реакцию на альдегиды с фуксинсернистой кислотой (реакция Шиффа), а также на фурфурол. Синтезировал дигалловую кислоту. Создал прибор для определения азота по способу, предложенному Ж. Б. А. Дюма.
Совместно с другими выдающимися итальянскими химиками, в числе которых были Э. Патерно и С. Канниццаро, основал в 1871 г. журнал «Gazzetta Chimica Italiana». Написал биографию Дж. Пристли.
Слайд 46
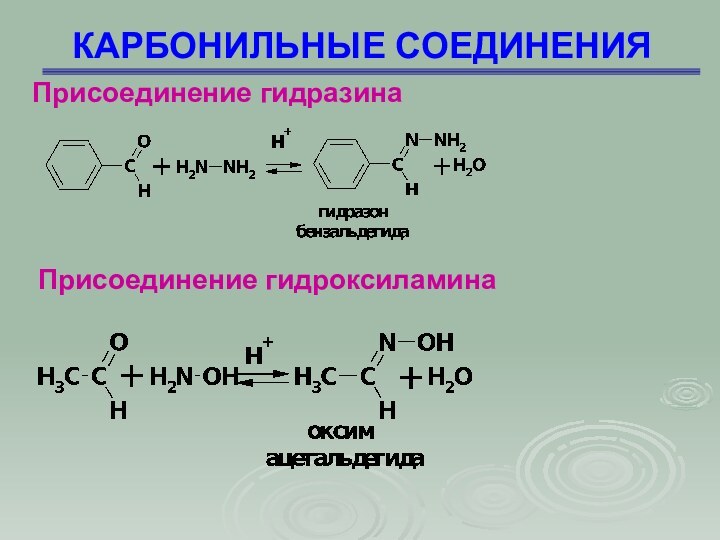
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение гидразина
Присоединение гидроксиламина
Слайд 47
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
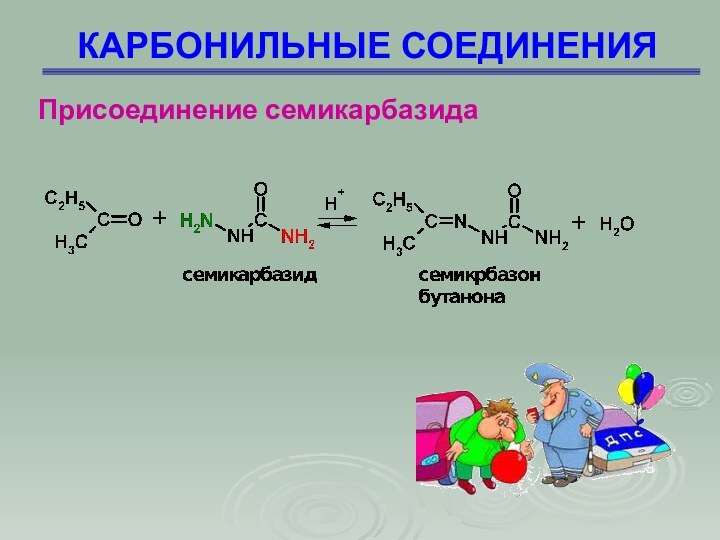
Присоединение семикарбазида
Слайд 48
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
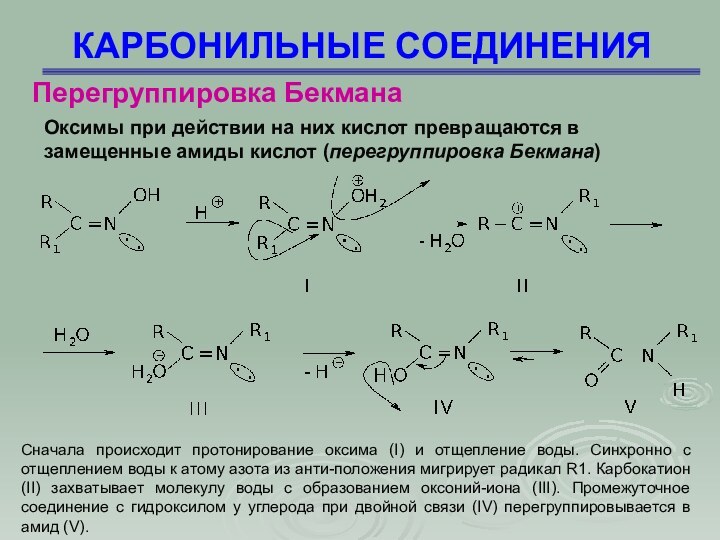
Перегруппировка Бекмана
Оксимы при действии на них кислот
превращаются в замещенные амиды кислот (перегруппировка Бекмана)
Сначала происходит
протонирование оксима (I) и отщепление воды. Синхронно с отщеплением воды к атому азота из анти-положения мигрирует радикал R1. Карбокатион (II) захватывает молекулу воды с образованием оксоний-иона (III). Промежуточное соединение с гидроксилом у углерода при двойной связи (IV) перегруппировывается в амид (V).
Слайд 49
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Бекмановская перегруппировка имеет промышленное значение при получении
капролактама, используемого для получения высокомолекулярного поликапроамида – капрона (найлон-6)
Перегруппировка Бекмана
Слайд 50
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
БЕКМАН
Эрнст Отто
1853 – 1923
Немецкий химик
Эрнст Отто Бекман родился в Золингене. С 1875 по
1878 гг. изучал химию и фармацию в Лейпцигском университете. Научные работы Бекмана относятся к органической и физической химии. Исследовал строение оксимов; в 1886 г. показал, что оксимы под действием кислых агентов перегруппировываются в амиды кислот (перегруппировка Бекмана). В 1891 г. действием металлического натрия на диарилкетоны получил металлкетилы. Разработал методы определения молекулярных масс растворённых веществ на основании открытых Франсуа Раулем законов – по понижению температуры замерзания (1888) и по повышению температуры кипения (1889) их разбавленных растворов. Изобрёл термометр, позволяющий точно определять температуры вблизи точек замерзания или кипения – метастатический (дифференциальный) термометр Бекмана.
Слайд 51
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Оставить надежду,
всяк сюда входящий
Реакции енольных форм альдегидов
и кетонов
Слайд 52
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции енольных форм альдегидов и кетонов
СН-Кислотность
и кетоенольная таутомерия
Под влиянием карбонильной группы атомы водороды, находящиеся
в -положении к карбонилу, приобретают кислый характер, т.е. проявляют СН-кислотность. Этот эффект относится только к -С – Н –связям. Это можно объяснить в терминах резонансной стабилизации карбаниона, образующегося при отщеплении протона у -угелеродного атома
Слайд 53
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции енольных форм альдегидов и кетонов
СН-Кислотность
и кетоенольная таутомерия
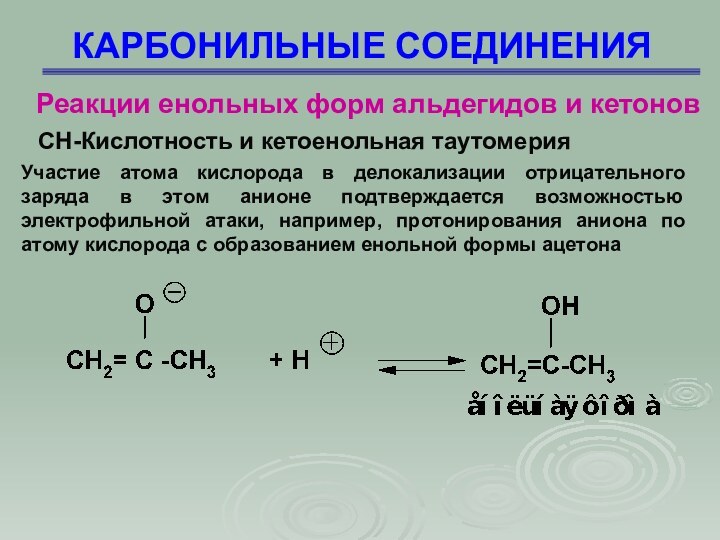
Участие атома кислорода в делокализации отрицательного заряда
в этом анионе подтверждается возможностью электрофильной атаки, например, протонирования аниона по атому кислорода с образованием енольной формы ацетона
Слайд 54
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции енольных форм альдегидов и кетонов
СН-Кислотность
и кетоенольная таутомерия
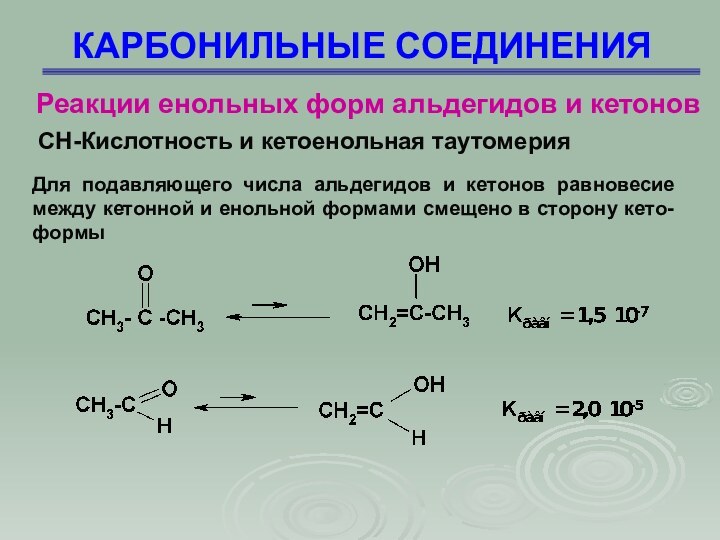
Для подавляющего числа альдегидов и кетонов равновесие
между кетонной и енольной формами смещено в сторону кето-формы
Слайд 55
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции енольных форм альдегидов и кетонов
СН-Кислотность
и кетоенольная таутомерия
Кетонная и енольная форма являются изомерами. Они
различаются положением атома водорода, двойной и простой связей. Такой вид изомерии называется таутомерией. Для альдегидов и кетонов это кето-енольная таутомерия. Хотя содержание енольной фомы в альдегидах и кетонах невелико, их способность переходить в енольную форму в значительной мере определяет их химические свойства
Слайд 56
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции енольных форм альдегидов и кетонов
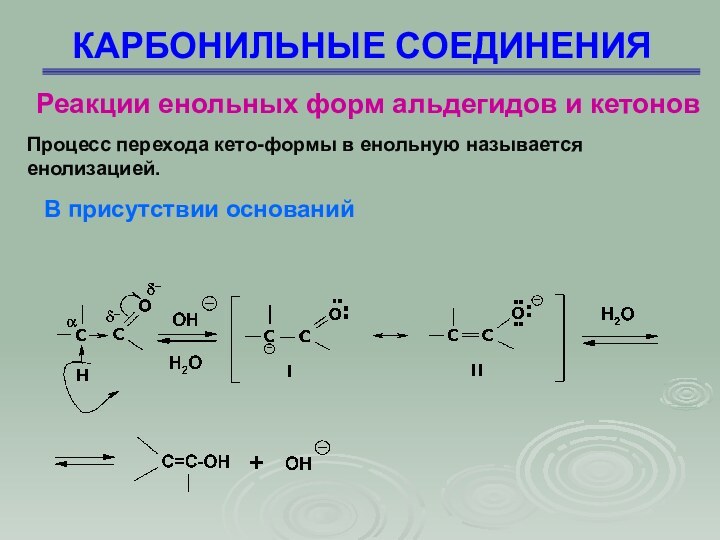
Процесс
перехода кето-формы в енольную называется енолизацией.
В присутствии оснований
Слайд 57
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение, нуклеофил – карбанион. Альдольная конденсация
Альдольная конденсация - это реакция, в которой карбонильное соединение
является одновременно и субстратом, подвергающимся атаке нуклеофилом по карбонильной группе - группе, и источником карбанионов – нуклеофилов
Слайд 58
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Кротоновая конденсация
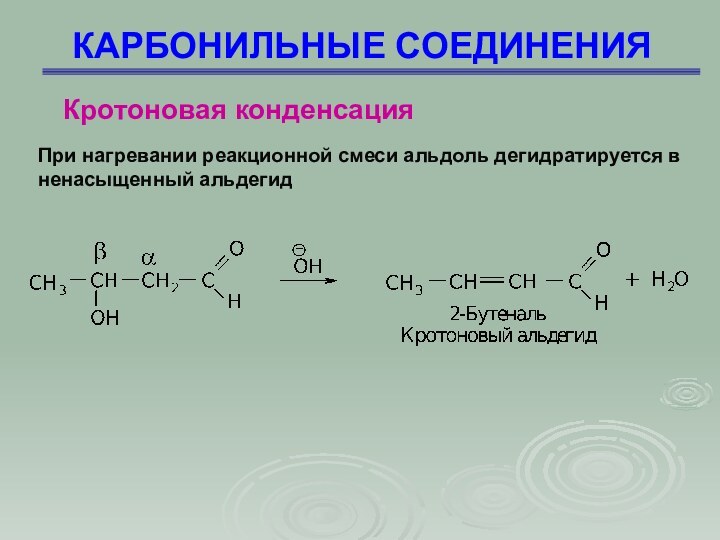
При нагревании реакционной смеси
альдоль дегидратируется в ненасыщенный альдегид
Слайд 59
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Кротоновая конденсация
Протекание реакции дегидратации можно
объяснить тем, что альдоль содержит -Н-атомы, которые могут легко
отщепляться основанием с образованием карбаниона, имеющего достаточно хорошо уходящую группу –ОН у соседнего () атома углерода
Легкость протекания и направление реакции дегидратации также обусловлены устойчивостью образующегося алкена: двойная углерод–углеродная связь сопряжена с двойной углерод-кислородной связью карбонила. В тех случаях, когда в образующихся алкенах в систему сопряжения включено ароматическое кольцо, альдоль выделить не удается
Слайд 60
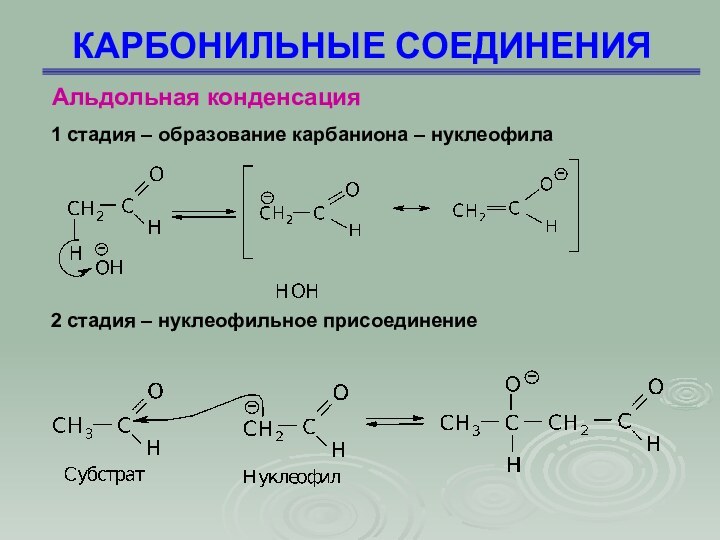
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Альдольная конденсация
1 стадия – образование карбаниона
– нуклеофила
2 стадия – нуклеофильное присоединение
Слайд 61
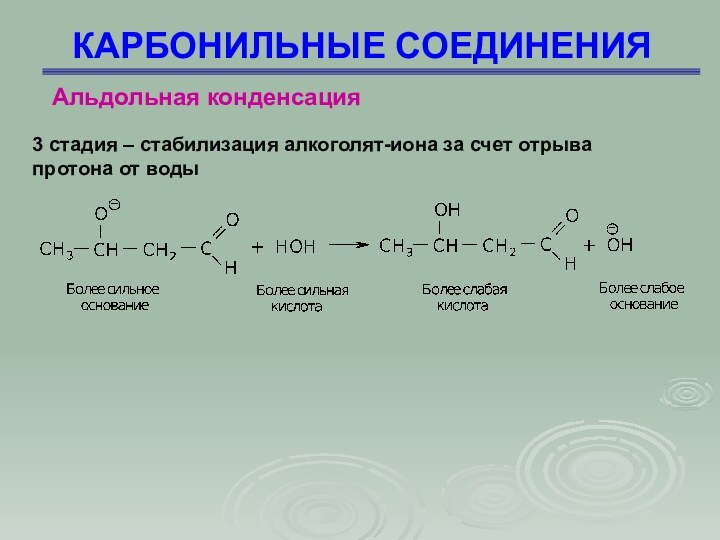
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Альдольная конденсация
3 стадия – стабилизация алкоголят-иона
за счет отрыва
протона от воды
Слайд 62
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Альдольная конденсация
Слайд 63
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
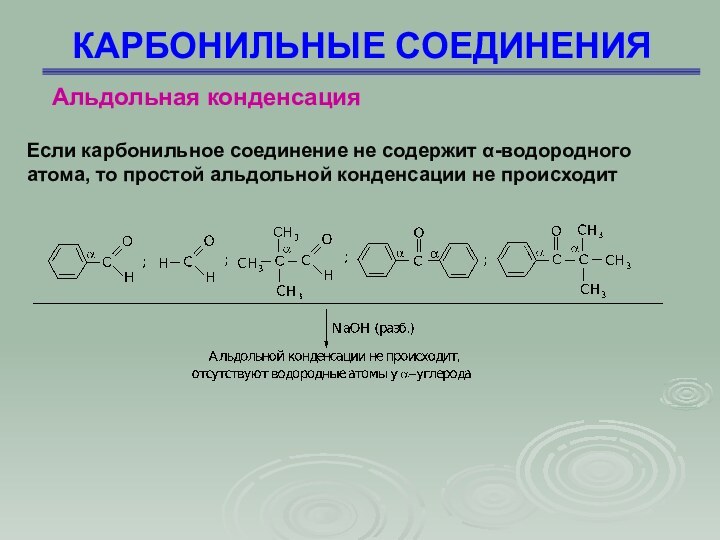
Альдольная конденсация
Если карбонильное соединение не содержит
-водородного атома, то простой альдольной конденсации не происходит
Слайд 64
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
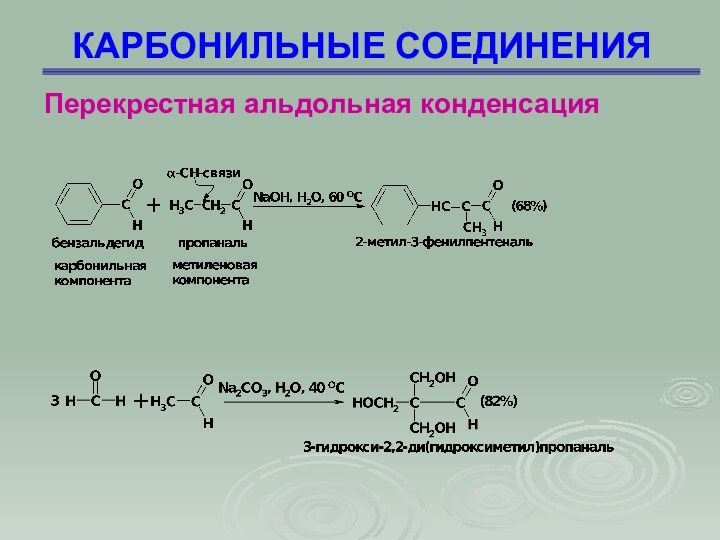
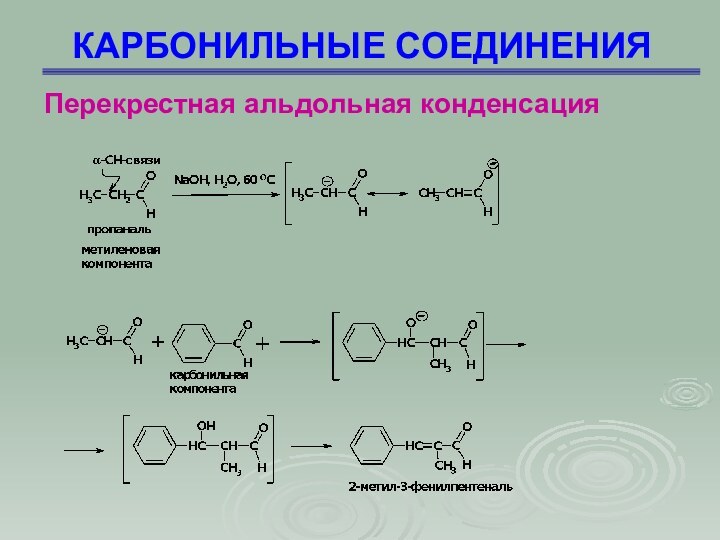
Перекрестная альдольная конденсация
Это альдольная конденсация двух
различных карбонильных соединений, одно из которых не содержит -водородного
атома
Слайд 65
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Перекрестная альдольная конденсация
Слайд 66
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Перекрестная альдольная конденсация
Слайд 68
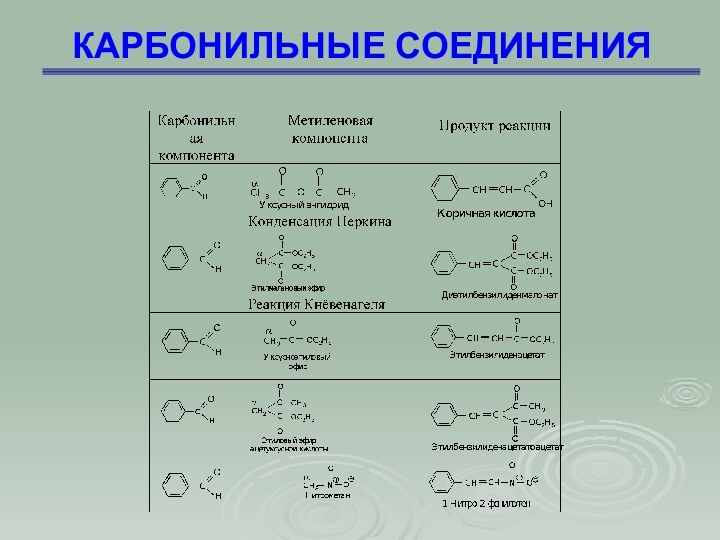
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
С 1853 ученик, а затем ассистент Августа

Гофмана в Королевском химическом колледже в Лондоне. В 1884—1885
гг. президент британского Общества химической промышленности.
В 1856 году Перкин пытался создать новое лекарство от малярии и, экспериментируя с каменноугольной смолой, получил пурпурную краску, которую позже назвал мовеин (от английского названия цветка мальвы) — один из первых синтетических органических красителей.
Огромная заслуга Перкина в том, что он оценил практическое значение своего открытия и уже через год организовал производство мовеина, а также нитробензола и анилина, необходимых для его синтеза. Поэтому 1856 год считается датой возникновения промышленности синтетических красителей и производства смоляных (анилиновых) красителей. Также он открыл (1868 г.) способ получения ароматических ненасыщенных (β-арилакриловых) кислот; исследовал зависимость вращения плоскости поляризации света в магнитном поле от структуры соединения. В конце концов Перкин так преуспел в производстве красителей, что бросил науку и под конец жизни был возведен в рыцари и стал сэром.
Перкин
Уильям Генри
1838 - 1907
Слайд 69
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
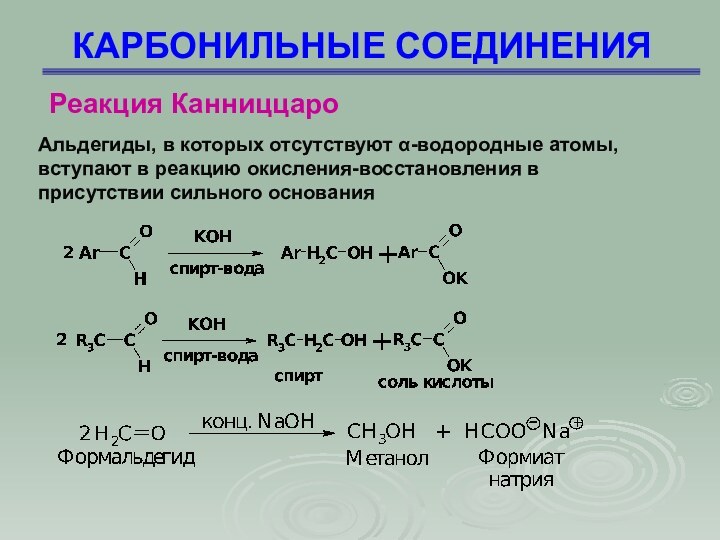
Реакция Канниццаро
Альдегиды, в которых отсутствуют -водородные
атомы, вступают в реакцию окисления-восстановления в присутствии сильного основания
Слайд 70
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
:
1826 - 1910
Станислао
Канниццаро
Слайд 71
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
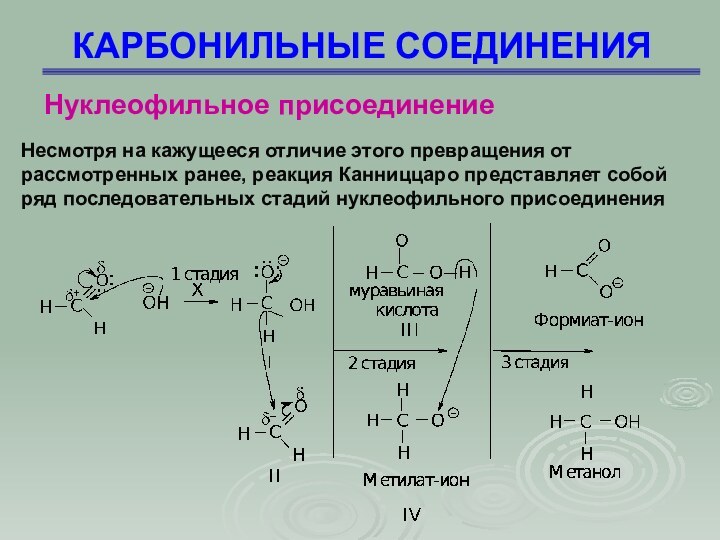
Несмотря на кажущееся отличие этого превращения от
рассмотренных ранее, реакция Канниццаро представляет собой ряд последовательных стадий
нуклеофильного присоединения
Нуклеофильное присоединение
Слайд 72
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение
1 стадия – нуклеофильное присоединение иона
ОН с образованием промежуточного соединения (I);
2 стадия – превращение
иона (I) в молекулу кислоты путем отщепления от него гидрид-иона Н, который является нуклеофилом в реакции присоединения ко второй молекуле альдегида (II), анион (I) превращается в муравьиную кислоту (III);
3 стадия – перенос протона от более слабого основания формиат-иона к более сильному метилат-иону (IV)
Слайд 73
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
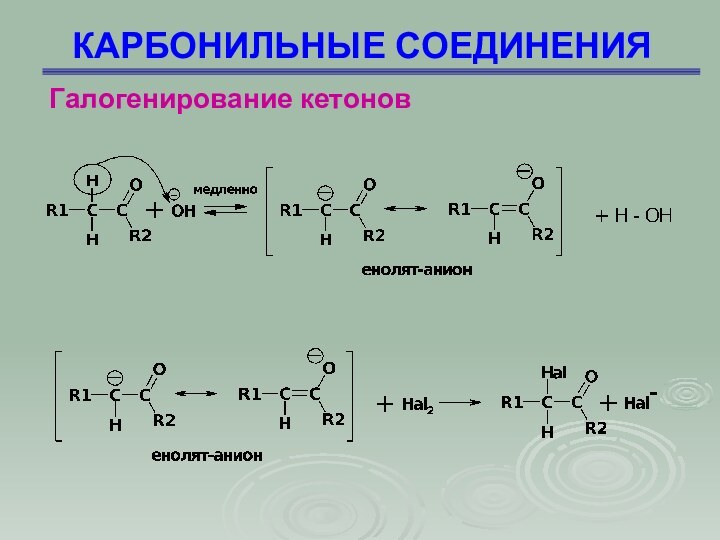
Галогенирование кетонов
Галогенирование кетонов происходит путем замещения
исключительно -водородного атома
Слайд 74
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Галогенирование кетонов
1 стадия – медленная: основание
отрывает протон от ацетона, образуя карбанион (I)
2 стадия
– быстрая: анион (I) взаимодействует с молекулой брома, поляризованной под влиянием отрицательного заряда карбаниона
Слайд 75
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Галогенирование кетонов
Слайд 76
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Галогенирование кетонов
Скорость реакции зависит от концентрации
ацетона и основания, но не зависит от концентрации брома;
скорость галогенирования не зависит также от природы галогена, будь то хлор, бром или иод.
Последующее замещение атомов водорода протекает быстрее
Слайд 77
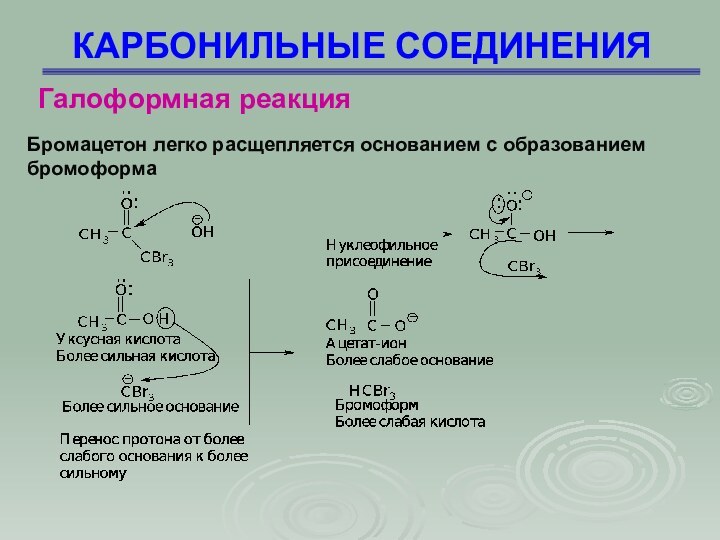
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Галоформная реакция
Бромацетон легко расщепляется основанием с
образованием
бромоформа
Слайд 78
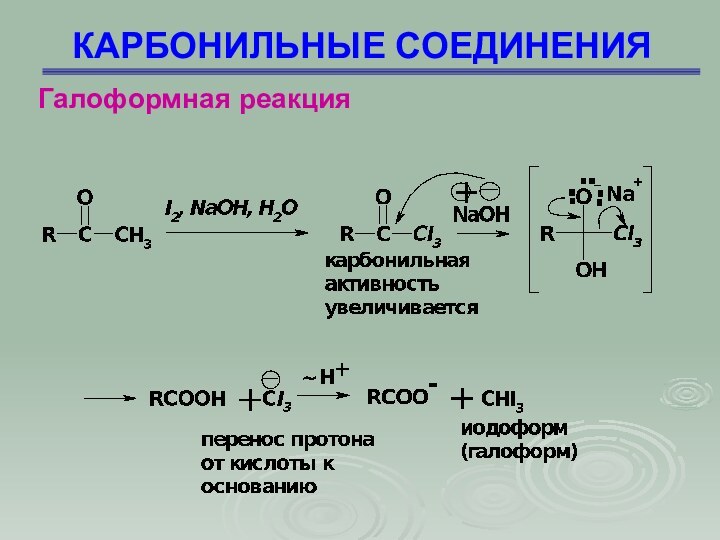
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Галоформная реакция
Слайд 80
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Взаимодействие альдегидов и кетонов
с пентахлоридом фосфора
Альдегиды и кетоны при взаимодействии с РCl5 обменивают атом
кислорода на два атома хлора, что используется для получения геминальных дихлоралканов (оба атома хлора присоединяются к одному и тому же атому углерода
Слайд 81
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
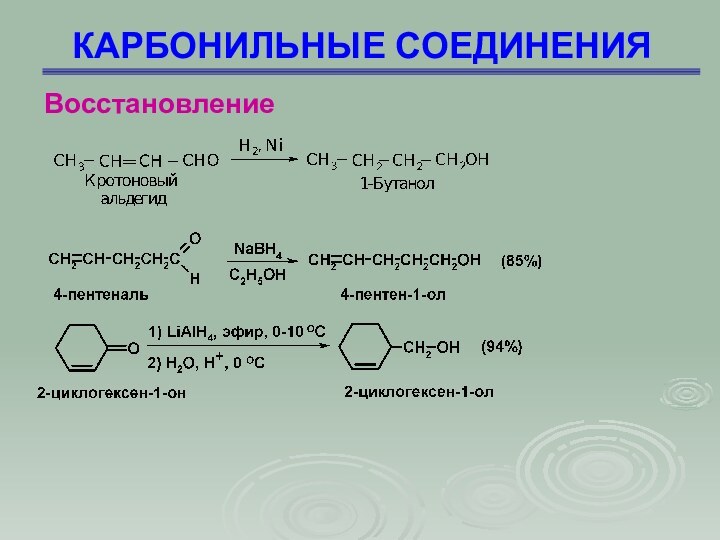
Восстановление
Слайд 82
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Восстановление
Литийалюминийгидрид LiAlН4
Механизм реакции AdN – присоединение
гидрид-иона
Слайд 83
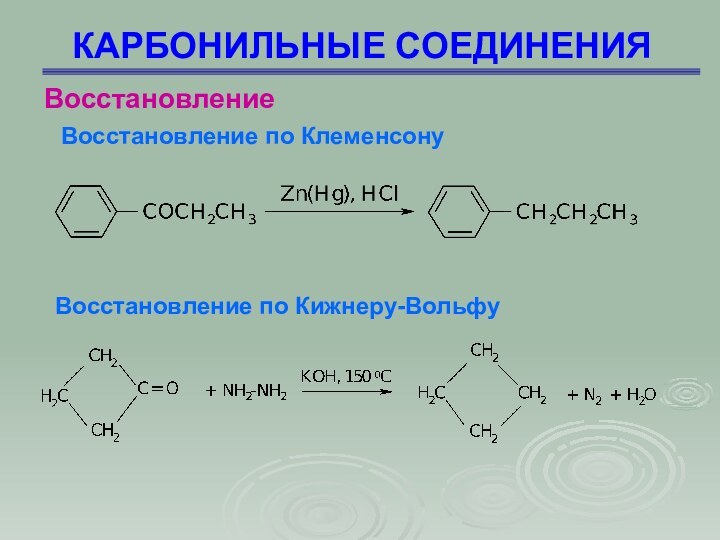
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Восстановление
Восстановление по Клеменсону
Восстановление по Кижнеру-Вольфу
Слайд 84
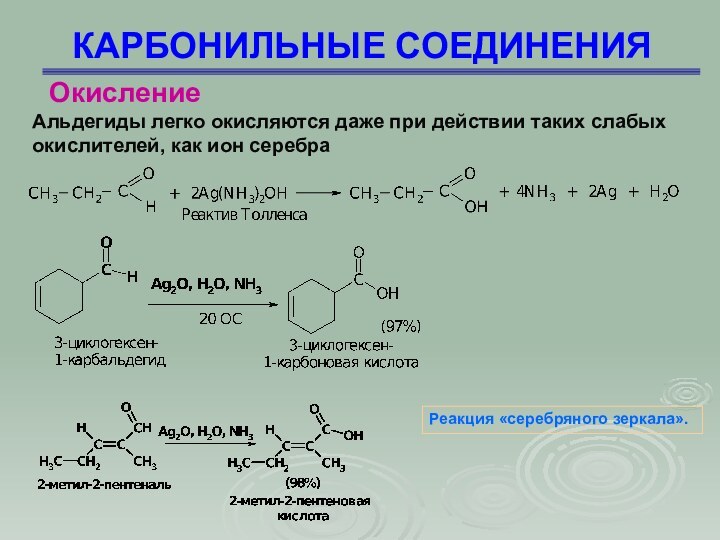
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Альдегиды легко окисляются даже при действии таких
слабых окислителей, как ион серебра
Окисление
Реакция «серебряного зеркала».
Слайд 85
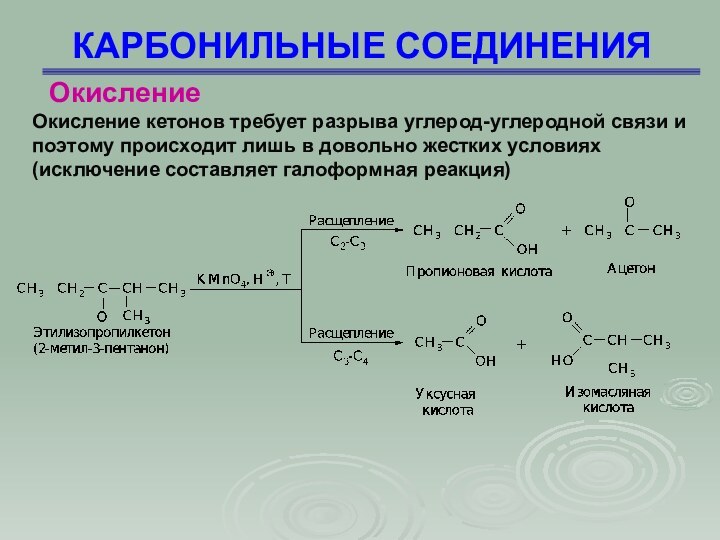
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Окисление кетонов требует разрыва углерод-углеродной связи и
поэтому происходит лишь в довольно жестких условиях (исключение составляет
галоформная реакция)
Окисление
Слайд 86
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Важное значение имеет окисление циклических кетонов, которое
приводит к дикарбоновым кислотам
Окисление
Слайд 87
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Отдельные представители
Муравьиный альдегид
Муравьиный альдегид (формальдегид)
– бесцветный газ с резким запахом, очень ядовит. Хорошо
растворим в воде (40 % р-ор формалин). Получают в промышленности неполным окислением метана и каталитическим окислением метанола при 650-700 Сна серебряном катализаторе. Используется для получения фенолформальдегидных смол, уротропина, пентаэритрита
При нитровании получают пентаэритриттетранитрат – ВВ
Слайд 88
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Уксусный альдегид
Отдельные представители
Уксусный альдегид получают
гидратацией ацетилена, дегидрированием этилового спирта, изомеризацией окиси этилена. Используется
для получения уксусной кислоты, уксусного ангидрида, альдоля, этилового спирта, этилацетата и других эфиров
Ацетон
Ацетон получаю кислотным разложением гипериза, окислением или дегидрированием изопропилбензола, ацетон-бутанольным брожением углеводов, из надсмольной воды при сухой перегонке древесины. Ацетон широко используется в качестве растворителя, для получения метилметакрилата
Слайд 89
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
1. Окисление и дегидрирование первичных
и вторичных спиртов
В качестве окислителей чаще всего используют K2Cr2O7.
Окисление вторичных спиртов не сопряжено с осложнениями. Окисление первичных спиртов требует осторожности, поскольку образующийся на первой стадии альдегид способен к быстрому окислению до карбоновой кислоты. В этом случае одновременно с окислением ведут отгонку легкокипящих альдегидов
Слайд 90
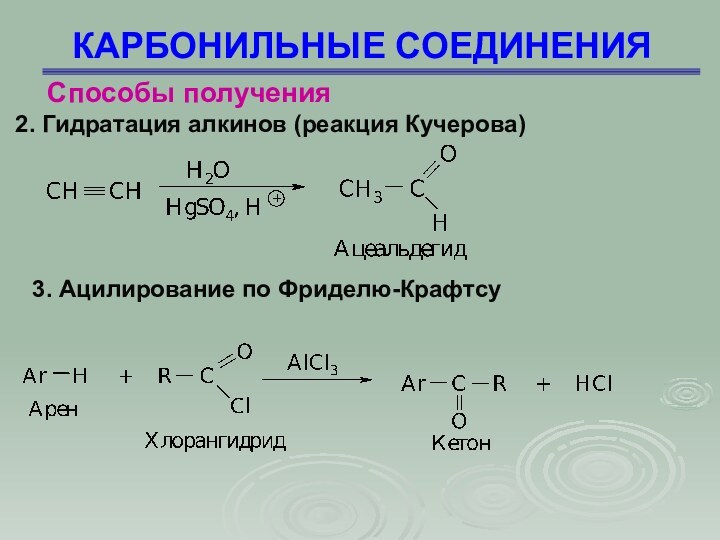
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
2. Гидратация алкинов (реакция Кучерова)
3.
Ацилирование по Фриделю-Крафтсу
Слайд 91
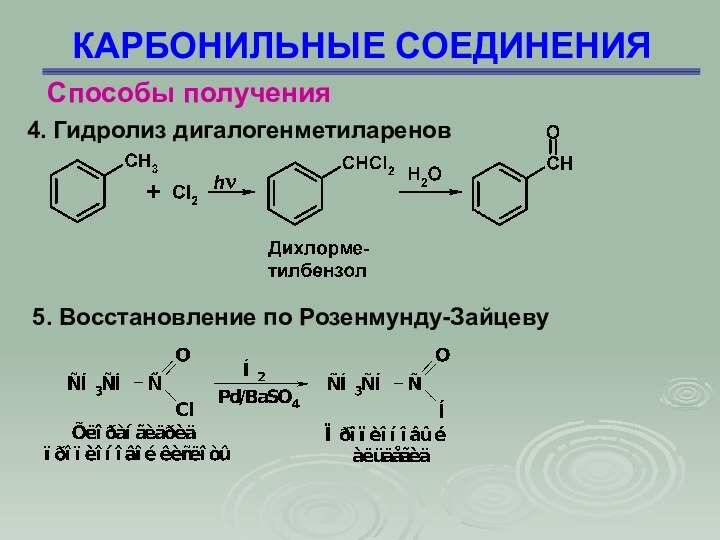
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
4. Гидролиз дигалогенметиларенов
5. Восстановление по
Розенмунду-Зайцеву
Слайд 92
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
6. Термическое декарбоксилирование солей
карбоновых
кислот
Слайд 93
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
6. Термическое декарбоксилирование солей
карбоновых
кислот
Для получения альдегидов и кетонов используют пиролиз кислот в
виде паров над окислами некоторых металлов (ThO2, MnO, CaO, ZnO) при температуре 400-450 oC
Слайд 94
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
7. Взаимодействие сложных эфиров с
реактивом
Гриньяра
Реакция эфиров муравьиной кислоты с алкил- или
арилмагнийгалогенидами дает альдегиды
Из эфиров других кислот получаются кетоны
Слайд 95
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
7. Взаимодействие сложных эфиров с
реактивом
Гриньяра
Синильная кислота или нитрилы при взаимодействии с
реактивом Гриньяра также дают альдегиды или соответственно – кетоны
Слайд 96
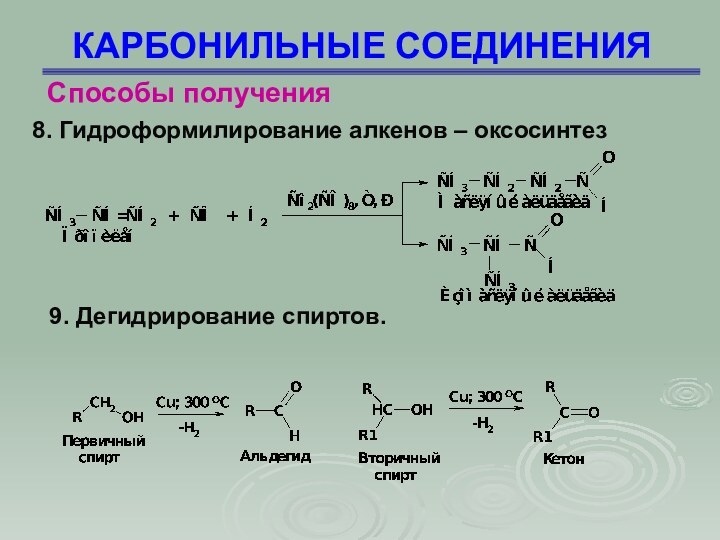
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
8. Гидроформилирование алкенов – оксосинтез
9.
Дегидрирование спиртов.
Слайд 97
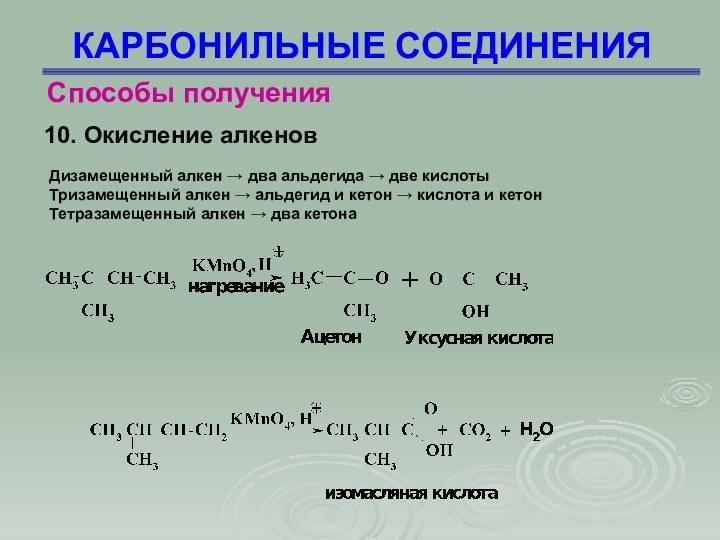
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
10. Окисление алкенов
Дизамещенный алкен →
два альдегида → две кислоты
Тризамещенный алкен → альдегид и
кетон → кислота и кетон
Тетразамещенный алкен → два кетона
Слайд 98
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
10. Окисление алкенов
Вакер-процесс: каталитическое окисление
этена в ацетальдегида.
Основной промышленный способ получения ацетальдегида.
Слайд 99
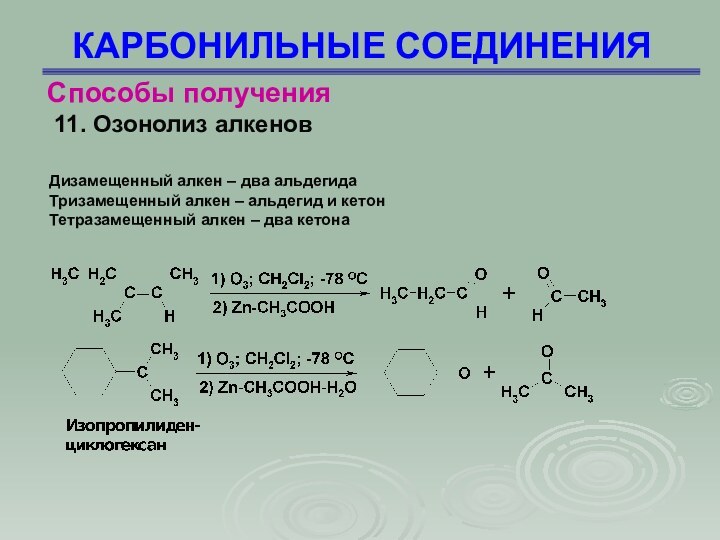
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения
11. Озонолиз алкенов
Дизамещенный алкен –
два альдегида
Тризамещенный алкен – альдегид и кетон
Тетразамещенный алкен –
два кетона