атомов водорода,
способных замещаться на атома металлов,
и кислотных
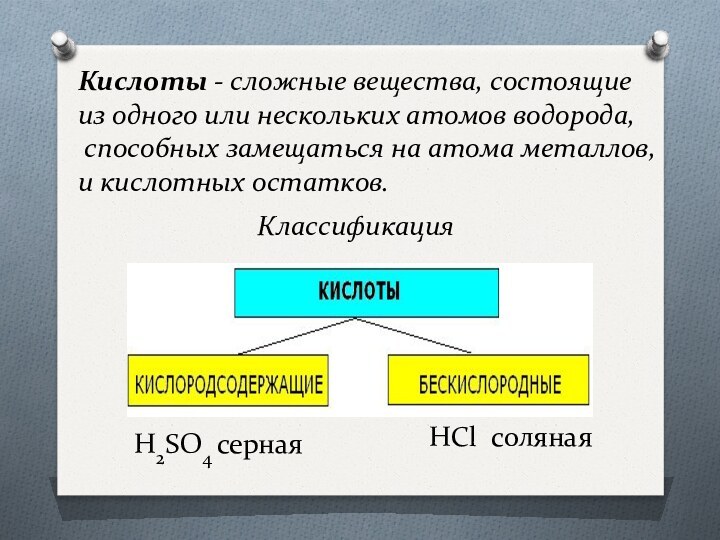
остатков.Классификация
H2SO4 серная
HCl соляная
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть






Классификация
H2SO4 серная
HCl соляная