- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Комплексные соединения
Содержание
- 2. Соединения, имеющие в своем составе комплексные ионы, относят к комплексным соединениям
- 3. Основные положения координационной теории (1893г. Альфред Вернер)
- 4. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙNHHHCl+-[[*****...NH4ClHКОМПЛЕКСООБРАЗОВАТЕЛЬЛИГАНДЫКООРДИНАЦИОННОЕ ЧИСЛО - 4ВНУТРЕННЯЯ СФЕРАВНЕШНЯЯ СФЕРАКОМПЛЕКСНЫЙ ИОН
- 5. [N-3H+14]Cl-1КОМПЛЕКСНЫЙ ИОН[NH4]+ВНУТРЕННЯЯ СФЕРА:КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3ЛИГАНДЫH+ВНЕШНЯЯ СФЕРААНИОНCl-
- 6. (OH)-4[Zn+xNa+(+1)+ x+ (-1)]2·2·4 = 0x = 0-2+4x = +2Na+[Zn+2(OH)-4]
- 7. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]Ответ: Na+3[Al+3F-6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Na3[Al(OH)6][Cu(NH3)4]Cl2Ответ: Na+[Al+3(OH)-4]Ответ: K+[Mg+2Cl-3]Ответ:Na+4[Fe+2(CN)-6]Ответ:Na+3[Al+3(OH)-6]Ответ:[Cu+2(NH3)04]Cl-2
- 8. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ2-4-3-5-6-ди-три-тетра-пента-гекса-ЧИСЛИТЕЛЬНЫЕ:НАЗВАНИЯ ЛИГАНДОВ:H2O - акваNH3 -
- 9. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙНАЗВАНИЯ АНИОНОВ:Fe - ферратCu -
- 10. тетрагидроксоцинкатНОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙNa+24](OH)-[Zn+2натрия[Cr+3(H2O)06]Cl-3хлоридаквагексаxрома (III)K+2[Hg+2I-4]тетрайодомеркурат (II)калия
- 11. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]Гексафтороалюминат натрияТетрагидроксоалюминат натрияГексационоферрат (II) калия
- 12. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)[Ag(NH3)2]ClХлорид диамминсеребраХлорид гексааквахрома (III)[Cr(H2O)6]Cl3
- 13. Ответ: K2[PtCl6]Гексахлороплатинат (IV) калияНитрат хлоронитротетраамминкобальта (III)Гексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВОтвет: [Co(NH3)4(NO3)Cl]NO3Ответ: Na3[Cr(OH)6]Нитрат гексаамминникеля (II)Ответ: [Ni(NH3)6](NO3)2
- 14. ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙПолучение тетрагидроксоалюмината натрияAlCl3+3NaOH = Al(OH)3↓+3NaClAl(OH)3
- 15. ХИМИЧЕСКИЕ СВОЙСТВА1. Диссоциация[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42-
- 16. Применение комплексных соединенийв качестве красителей (кобальтовые краски),
- 17. Интересные фактыИзучение комплексных соединений – одна из
- 18. РефлексияСоставьте формулы:1.Гесацианоферрат (3) калия,2. Тетрагидроксоцинкат калия,3. Гексафторалюминат
- 19. Скачать презентацию
- 20. Похожие презентации
Соединения, имеющие в своем составе комплексные ионы, относят к комплексным соединениям



![Комплексные соединения [N-3H+14]Cl-1КОМПЛЕКСНЫЙ ИОН[NH4]+ВНУТРЕННЯЯ СФЕРА:КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3ЛИГАНДЫH+ВНЕШНЯЯ СФЕРААНИОНCl-](/img/tmb/14/1376717/45b3cee2b174068c28405ea32e8684a2-720x.jpg)
![Комплексные соединения (OH)-4[Zn+xNa+(+1)+ x+ (-1)]2·2·4 = 0x = 0-2+4x = +2Na+[Zn+2(OH)-4]](/img/tmb/14/1376717/743cad4ab8a6c693f487159043bb247b-720x.jpg)
![Комплексные соединения РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]Ответ: Na+3[Al+3F-6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Na3[Al(OH)6][Cu(NH3)4]Cl2Ответ: Na+[Al+3(OH)-4]Ответ: K+[Mg+2Cl-3]Ответ:Na+4[Fe+2(CN)-6]Ответ:Na+3[Al+3(OH)-6]Ответ:[Cu+2(NH3)04]Cl-2](/img/tmb/14/1376717/dfc8f3b7c1c6c80f25010fd0ca77ddfe-720x.jpg)


-[Zn+2натрия[Cr+3(H2O)06]Cl-3хлоридаквагексаxрома (III)K+2[Hg+2I-4]тетрайодомеркурат (II)калия](/img/tmb/14/1376717/81f99f604a79e1a3e999f5d8fa02b470-720x.jpg)
![Комплексные соединения НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]Гексафтороалюминат натрияТетрагидроксоалюминат натрияГексационоферрат (II) калия](/img/tmb/14/1376717/4c7c55a9b08d3f4217c72a97bedf8d8e-720x.jpg)
![Комплексные соединения НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)[Ag(NH3)2]ClХлорид диамминсеребраХлорид гексааквахрома (III)[Cr(H2O)6]Cl3](/img/tmb/14/1376717/b9c0acde0f3eddc6845738d06eab5d31-720x.jpg)
![Комплексные соединения Ответ: K2[PtCl6]Гексахлороплатинат (IV) калияНитрат хлоронитротетраамминкобальта (III)Гексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВОтвет: [Co(NH3)4(NO3)Cl]NO3Ответ: Na3[Cr(OH)6]Нитрат гексаамминникеля (II)Ответ: [Ni(NH3)6](NO3)2](/img/tmb/14/1376717/146abaa40cf95b4e7db3adac200c9b7f-720x.jpg)
![Комплексные соединения ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙПолучение тетрагидроксоалюмината натрияAlCl3+3NaOH = Al(OH)3↓+3NaClAl(OH)3 + NaOH = Na[Al(OH)4]Получение гидроксида](/img/tmb/14/1376717/0df81f0acdf198f4cfa5c6c5bb3d78ab-720x.jpg)
![Комплексные соединения ХИМИЧЕСКИЕ СВОЙСТВА1. Диссоциация[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- 2. Реакции по внешней сфереFeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl[Cu(NH3)4]SO4+BaCl2→[Cu(NH3)4]Cl2+BaSO4↓](/img/tmb/14/1376717/0765cc3ef606019daedf2d37f4a268d9-720x.jpg)



![Комплексные соединения ОтветыK4[Fe(CN)6]K2[Zn(OH)4]Na3[AlF6][Cr(H2O)6]Cl3Ca[Hg(CN)4][Ag(NH3)2]OH](/img/tmb/14/1376717/88d66664fb8034db8c352df51e156a75-720x.jpg)
Слайд 3
Основные положения координационной теории (1893г. Альфред Вернер)
1.
В комплексном соединении один из ионов или атомов считается
центральным, его называют комплексообразователем.2. Вокруг центрального иона (атома) – комплексообразователя расположено (координировано) определенное число противоположно заряженных ионов или полярных молекул, называемых лигандами.
3. Центральный ион (атом) с лигандами образует внутреннюю координационную сферу соединения, которую при написании заключают в квадратные скобки.
4. В большинстве случаев число лигандов, непосредственно связанных с центральным ионом (атомом), называется координационным числом, которое чаще всего принимает значения 2,4,6,8.
5. Ионы, которые располагаются на более далеком расстоянии от центрального иона (атома), образуют внешнюю координационную сферу.
Слайд 4
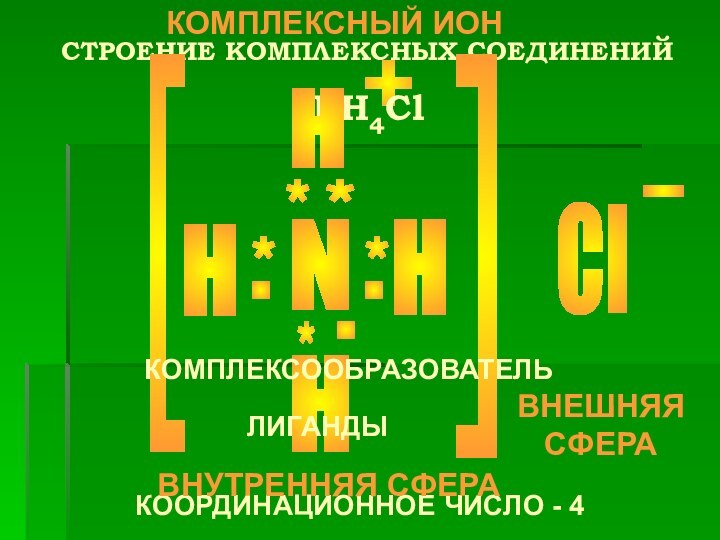
СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
N
H
H
H
Cl
+
-
[
[
*
*
*
*
*
.
.
.
NH4Cl
H
КОМПЛЕКСООБРАЗОВАТЕЛЬ
ЛИГАНДЫ
КООРДИНАЦИОННОЕ ЧИСЛО - 4
ВНУТРЕННЯЯ СФЕРА
ВНЕШНЯЯ СФЕРА
КОМПЛЕКСНЫЙ
ИОН
Слайд 5
[N-3H+14]Cl-1
КОМПЛЕКСНЫЙ ИОН
[NH4]+
ВНУТРЕННЯЯ СФЕРА:
КОМПЛЕКСООБРАЗОВАТЕЛЬ
N-3
ЛИГАНДЫ
H+
ВНЕШНЯЯ СФЕРА
АНИОН
Cl-
Слайд 7
РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:
Na3[AlF6]
Ответ: Na+3[Al+3F-6]
K[MgCl3]
Na[Al(OH)4]
Na4[Fe(CN)6]
Na3[Al(OH)6]
[Cu(NH3)4]Cl2
Ответ: Na+[Al+3(OH)-4]
Ответ: K+[Mg+2Cl-3]
Ответ:Na+4[Fe+2(CN)-6]
Ответ:Na+3[Al+3(OH)-6]
Ответ:[Cu+2(NH3)04]Cl-2
Слайд 8
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
2-
4-
3-
5-
6-
ди-
три-
тетра-
пента-
гекса-
ЧИСЛИТЕЛЬНЫЕ:
НАЗВАНИЯ ЛИГАНДОВ:
H2O - аква
NH3 - амин
СO
- карбонил
OН- - гидроксо-
(СN)- - циано
F-, Cl-, Br-, I-
- фторо-, хлоро-, бромо-, йодо-(NO3)- - нитро
Слайд 9
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
НАЗВАНИЯ АНИОНОВ:
Fe - феррат
Cu - купрат
Ag
- аргентат
Au - аурат
Hg - меркурат
Al - алюминат
Zn -
цинкат
Слайд 10
тетра
гидроксо
цинкат
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Na+2
4]
(OH)-
[Zn+2
натрия
[Cr+3
(H2O)0
6]
Cl-3
хлорид
аква
гекса
xрома (III)
K+2
[Hg+2
I-
4]
тетра
йодо
меркурат (II)
калия
Слайд 11
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Na3[AlF6]
Na[Al(OH)4]
K4[Fe(CN)6]
Гексафтороалюминат натрия
Тетрагидроксоалюминат натрия
Гексационоферрат (II) калия
Слайд 12
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
[Cu(NH3)4]SO4
Сульфат тетраамминмеди (II)
[Ag(NH3)2]Cl
Хлорид диамминсеребра
Хлорид гексааквахрома (III)
[Cr(H2O)6]Cl3
Слайд 13
Ответ: K2[PtCl6]
Гексахлороплатинат (IV) калия
Нитрат хлоронитротетраамминкобальта (III)
Гексагидроксохромат (III) натрия
СОСТАВЬТЕ
ФОРМУЛЫ ВЕЩЕСТВ
Ответ: [Co(NH3)4(NO3)Cl]NO3
Ответ: Na3[Cr(OH)6]
Нитрат гексаамминникеля (II)
Ответ: [Ni(NH3)6](NO3)2
Слайд 14
ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Получение тетрагидроксоалюмината натрия
AlCl3+3NaOH = Al(OH)3↓+3NaCl
Al(OH)3 +
NaOH = Na[Al(OH)4]
Получение гидроксида тетраамминмеди (II)
CuCl2+2NH3 +2H2O = Cu(OH)2↓+NH4Cl
Cu(OH)2
+ 4NH3 = [Cu(NH3)4](OH)2
Слайд 15
ХИМИЧЕСКИЕ СВОЙСТВА
1. Диссоциация
[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42-
2.
Реакции по внешней сфере
FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl
[Cu(NH3)4]SO4+BaCl2→[Cu(NH3)4]Cl2+BaSO4↓
3. Реакции с участием лигандов
[Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4
4.
Реакции по центральному ионуОбменные:[Ag(NH3)2Cl + KI → AgI↓ + KCl + 2NH3
Окислительно-восстановительные:
2[Ag(NH3)2OH+R-C=O →2Ag↓+RCOONH4+H2O+3NH3
H
Слайд 16
Применение комплексных соединений
в качестве красителей (кобальтовые краски), ядохимикаты,
удобрения;
для установления жесткости воды;
в качестве стимуляторов биохимических процессов;
для
разделения некоторых металлов (лантаноидов) и получения металлов высокой чистоты;в аналитической химии для определения ионов, например, Fe2+ и Fe3+.





























