Слайд 2
Кремний
в виде кристаллов входит в состав горных пород
образует бесцветные кристалла кварца и горного хрусталя
на его основе
создано промышленное производство керамики, стекла, цемента
полупроводник
* по распространению в земной коре занимает 2-е место после кислорода (26 %) В природе встречается в виде оксидов, силикатов и алюмосиликатов
* его оксиды являются основной частью песка и глины
Слайд 3
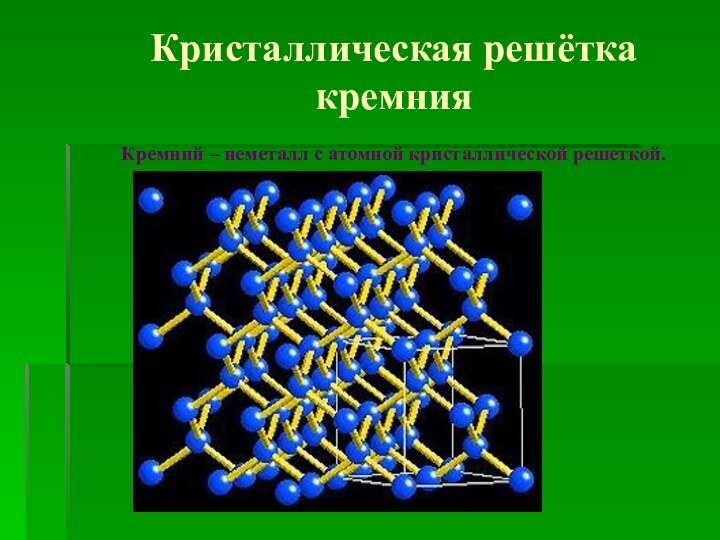
Кремний – кристаллическое вещество темно-серого цвета с металлическим
блеском. Кристаллическая решетка кремния напоминает структуру алмаза.
Слайд 4
Кристаллическая решётка кремния
Кремний – неметалл с атомной кристаллической
решеткой.
Слайд 5
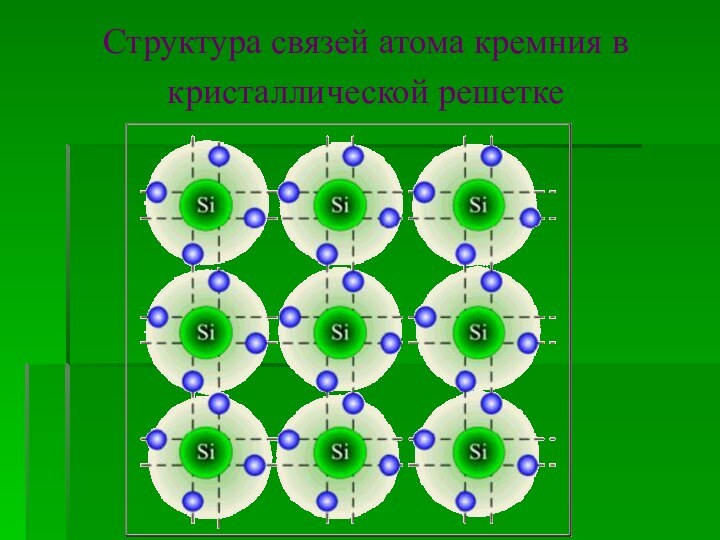
Структура
кремния аналогична структуре алмаза. В его кристалле
каждый атом окружен четырьмя другими и связан с ними
ковалентной связью, которая значительно слабее, чем между атомами углерода в алмазе.
В кристалле кремния даже при обычных условиях часть ковалентных связей разрушается.
Слайд 6
Структура связей атома кремния в кристаллической решетке
Слайд 7
Строение атома
Si 14 )2e)8e)4e
Слайд 8
Соединения кремния
0 +4 +2
Примеры: Si, SiO2, SiO.
Слайд 9
Физические свойства кремния
Темно-серые, блестящие, непрозрачные кристаллы
Хрупкий
Твердый
Тугоплавкий,
Плохой проводник тока
Слайд 10
Химические свойства кремния
а) восстановительные
1) Si + O2
=SiO2
2) Si + 2CL2 = SiCL4
3) Si + S
= SiS2
4)Si + 2H2O (пар) = SiO2 + H2
5)Si + C = SiC (карборунд)
6)Si +2NaOH(конц) + H2O = Na2SiO3 + H2
б) окислительные
Si + 2Ca = Ca2Si
Слайд 11
Методы получения кремния
В промышленности кремний получают восстановлением
кремнезема SiO2 коксом в электрических печах при 1500-17000С:
SiO2 +
2C ? Si + 2CO
В лаборатории:
SiO2 + 2Mg ? Si + 2MgO
3SiO2 + 4Al ? 3Si + 2Al2O3
Чистый кремний получают:
SiCl4 + 2Zn↑ ? Si + ZnCl2
Слайд 12
Применение кремния
материал для электроники
материал для сосудов;
компонент сплавов
с
железом;
- сверхчистый кремний –
полупроводник для
солнечных батарей
Слайд 13
Соединения кремния
1. Оксид кремния (IV)
Оксид кремния SiO2 (IV)
называют также кремнеземом.
Физические свойства:
бесцветное, твердое
тугоплавкое вещество (температура плавления 1700°С), твердый
Слайд 14
Модификации кремнезёма (кварца)
кристаллический кремнезем — в виде минерала
кварца и его разновидностей (горный хрусталь, халцедон, агат, яшма,
аметист, авантюрин, цитрин, кремень). Кварц составляет основу кварцевых песков, широко используемых в строительстве и в силикатной промышленности;
2) аморфный кремнезем (кварцевое стекло, диатомит, трепел)
Слайд 15
Кварц – SiO2
кристаллическая модификация
Кварцевое стекло - SiO2
Аморфная модификация
Слайд 16
SiO2 кристаллизуется в атомной решетке
Каждый атом кремния заключен
в тетраэдр из 4 атомов кислорода.
При этом атом
кремния находится в центре, а по вершинам тетраэдра
расположены атомы кислорода.
Слайд 17
Весь кусок кремнезема SiO2 можно
рассматривать как кристалл,
формула которого (SiO2)n. Такое
строение оксида кремния (IV)
обусловливает его высокую
твердость и тугоплавкость
Слайд 18
Химические свойства оксида кремния (IV)
Относится к кислотным оксидам:
1. При сплавлении его с твердыми щелочами, основными оксидами
и карбонатами образуются соли кремниевой кислоты: метасиликаты.
а) SiO2 + 2NaOH ? H2O+ Na2SiO3 б) SiO2 + CaO ? CaSiO3
в) SiO2 + Na2CO3 ? Na2SiO3 + CO2 ↑
Слайд 19
2. Реагирует со щелочами в растворе (образует ортосиликаты).
Кип.
SiO2 (ам.)+ 4NaOH?Na4SiO4+ 2H2O
3. Взаимодействует только с плавиковой кислотой:
SiO2 + 4HF? SiF4 + 2H2O
Слайд 20
4. Восстанавливается углеродом, магнием, железом (в доменном процессе).
Кип
а) SiO2 + 3C(кокс)?SiC+CO
б)SiO2 +
2Mg?Si+ 2MgO
5. В воде оксид кремния (IV) не растворяется и с ней химически не взаимодействует.
Слайд 21
Кремневые кислоты
H2SiO3 — кислота очень слабая, в воде
мало растворима.
Состав кремниевых кислот представляют в виде формул:
nSiO2*mH2O.
Кислоты с различным числом m легко переходят друг в друга и не могут быть выделены в чистом виде.
Слайд 22
Силикаты
Силикаты – химические соединения, содержащие кремнекислотные остатки различного
состава [SinOm].
Основа всех силикатов - кремнекислородный тетраэдр [SiO4],
в центре которого расположен атом кремния, а в вершинах – атомы кислорода.
Слайд 23
Применение силикатов
в качестве жидкого стекла - концентрированных
растворов силикатов калия и натрия; его используют:
а) при изготовлении
клея и водонепроницаемых тканей.
б) при изготовлении кислотоупорных бетонов,
в) изготовления замазок, конторского клея.
г) пропитка тканей, дерева и бумаги для придания им огнестойкости и водонепроницаемости.



















![Кремний и его соединения СиликатыСиликаты – химические соединения, содержащие кремнекислотные остатки различного состава [SinOm]. Основа всех](/img/tmb/11/1074616/c49f3108574dc5bd572f99e5293f5423-720x.jpg)