Слайд 2
Содержание
Загадочные творения природы
Что такое кристалл
Общее определение
Монокристаллы и кристаллические
агрегаты
Симметрия в кристаллах
Категории кристаллов
Исследования ученых
Закон постоянства двугранных углов. Отклонение
от закона
Дефекты в кристаллах
Выращивание кристаллов в домашних условиях
Слайд 3
Загадочные творения природы
Кристаллы одни из самых красивых и.
В настоящее время изучением многообразия кристаллов занимается
наука - кристаллография. Она выявляет признаки единства в этом многообразии, исследует свойства и строение, как одиночных кристаллов, так и кристаллических агрегатов.
В давние времена считалось, что кристаллы представляют собой редкость. Действительно, нахождение в природе крупных однородных кристаллов - явление нечастое. Но мелкокристаллические вещества встречаются весьма часто. Так, например, почти все горные породы: гранит, песчаники известняк - кристалличны.
В настоящее время известны способы искусственного выращивания кристаллов. Кристалл можно вырастить в обыкновенном стакане, для этого требуется лишь определенный раствор и аккуратность, с которой необходимо ухаживать за растущим кристаллом.
аметист
малахит
Слайд 4
Что такое кристалл.
В школьных учебниках кристаллами
обычно называют твердые тела, образующихся в природных или лабораторных
условиях и имеющие вид многогранников, которые напоминают самые непогрешимо строгие геометрические построения. Поверхность таких фигур ограничена более или менее совершенными плоскостями - гранями, пересекающимися по прямым линиям- ребрам. Точки пересечения ребер образуют вершины. Сразу же следует оговориться, что приведенное выше определение требует существенных поправок. Вспомним, например, всем известную горную породу границ, состоящую из зерен полевого шпата, слюды и кварца. Все эти зерна являются кристаллами, однако, их извилистые зерна не сохранили прежней прямолинейности и плоскогранности, а, следовательно, не подходят к вышеуказанному описанию..
природный лунный камень
Слайд 5
Кристаллов в природе существует великое множество и так
же много существует различных форм кристаллов. В реальности, практически
невозможно привести определение, которое подходило бы ко всем кристаллам. В результате рентгеновского анализа было установлено, что все кристаллы построены из элементарных частиц, расположенных в строгом порядке внутри кристаллического тела.
Во всех без исключения кристаллических постройках из атомов можно выделить множество одинаковых атомов, расположенных наподобие узлов пространственной решетки. Чтобы представить такую решетку, мысленно заполним пространство множеством равных параллелепипедов, параллельно ориентированных и соприкасающихся по целым граням. Простейший пример такой постройки представляет собой кладка из одинаковых кирпичиков. Если внутри кирпичиков выделить соответственные точки, например, их центры или вершины, то мы и получим модель пространственной решетки.
Слайд 6
Общее определение
Итак, кристаллами называются «все твердые тела, в
которых слагающие их частицы (атомы, ионы, молекулы) расположены строго
закономерно наподобие узлов пространственных решеток».
кристалл турмалина-рубеллита
Слайд 7
Монокристаллы и кристаллические агрегаты.
В отличие
от других агрегатных состояний, кристаллическое состояние многообразно.
Если взять,
например, обычную поваренную соль, то легко увидеть даже без микроскопа отдельные кристаллики. Каждый кристаллик есть вещество NaCl, но одновременно он имеет черты индивидуума. Он может быть большим или малым кубическим или прямоугольно-параллелепипедальным, по-разному ограненным и т.д.
Если мы хотим подчеркнуть, что имеем дело с одиночным, отдельным кристаллом, то называем его монокристаллом, чтобы подчеркнуть, что речь идет о скоплении многих кристаллов, используется термин кристаллический агрегат.
Слайд 9
Симметрия в кристаллах
Рассматривая различные кристаллы, мы

видим, что все они разные по форме, но любой
из них представляет симметричное тело. И действительно симметричность - это одно из основных свойств кристаллов. К понятию о симметрии мы привыкли с детства. Симметричными мы называем тела, которые состоят из равных одинаковых частей. Наиболее известными элементами симметрии для нас являются плоскость симметрии (зеркальное отображение), ось симметрии(поворот вокруг оси, перпендикулярной к плоскости). По углу поворота различают порядок оси симметрии, поворот на 180о – ось симметрии 2-огопорядка, 120о – 3-его порядка и так далее. Есть и еще один элемент симметрии - центр симметрии.
Все кристаллы симметричны. Это значит, что в каждом кристаллическом многограннике можно найти плоскости симметрии, оси симметрии, центры симметрии и другие элементы симметрии так, чтобы совместились друг с другом одинаковые части многогранника. Введем еще одно понятие относящееся к симметрии - полярность. Представим конус и цилиндр, у обоих объектов есть по одной оси симметрии бесконечного порядка, но они различаются полярностью, у конуса ось полярна (представим центральную ось в виде стрелочки, указывающей к вершине), а у цилиндра ось неполярна.
Слайд 10
Поговорим о видах симметрии в кристалле. Прежде
всего, в кристаллах могут быть оси симметрии только 1,
2, 3, 4 и 6 порядков. Представим плоскость, которую надо полностью покрыть семи -, восьми -,девятиугольниками и т.д., так чтобы между фигурами не оставалось пространства, это не получится, пятиугольниками покрыть плоскость так же нельзя. Очевидно, оси симметрии 5, 7-го и выше порядков не возможны, потому что при такой структуре атомные ряды и сетки не заполнят пространство непрерывно, возникнут пустоты, промежутки между положениями равновесия атомов. Атомы окажутся не в самых устойчивых положениях и кристаллическая структура разрушится.
Слайд 11
Категории кристаллов
По симметрии, прежде всего по осям симметрии,
кристаллы делятся на три категории. К высшей категории относятся
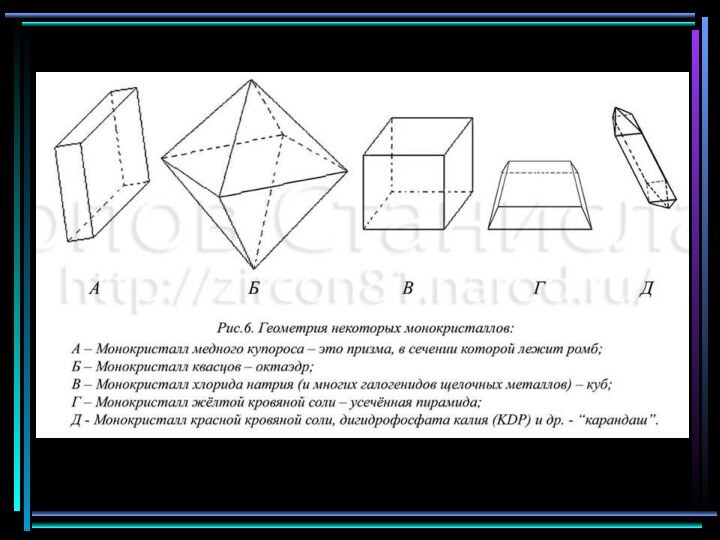
самые симметричные кристаллы, у них может быть несколько осей симметрии порядков 2, 3 и 4, нет осей 6-гопорядка, могут быть плоскости и центры симметрии. К таким формам относятся куб, октаэдр, тетраэдр и др. Им всем присуща общая черта: они примерно одинаковы во все стороны.
октаэдр
куб
Слайд 12
У кристаллов средней категории могут быть оси 3,
4 и 6 порядков, но только по одной. Осей
2 порядка может быть несколько, возможны плоскости симметрии и центры симметрии. Формы этих кристаллов: призмы, пирамиды и др.Общая черта: резкое различие вдоль и поперек главной оси симметрии
Усеченная пирамида
призма
У кристаллов низшей категории не может быть ни одной оси симметрии 3,4 и 6 порядков, могут быть только оси 2 порядка, плоскости или центр симметрии. Структура данных кристаллов самая сложная.
Слайд 13
Из кристаллов к высшей категории относятся: алмаз, квасцы,
гранаты, германий, кремний, медь, алюминий, золото, серебро, серое олово
вольфрам, железо;
к средней категории – графит, рубин, кварц, цинк, магний, белое олово, турмалин, берилл;
к низшей – гипс, слюда, медный купорос, сегнетовая соль и др.
кварц
Медный купорос
Слайд 14
Каждая грань кристалла представляет собой плоскость, на
которой располагаются атомы. Когда кристалл растет, все грани
передвигаются параллельно сами себе, так как на них откладываются все новые и новые слои атомов. По этой причине, параллельно каждой грани в структуре кристалла располагается огромное количество атомных плоскостей, которые когда-то в начальных стадиях роста тоже располагались на гранях кристалла, но в процессе роста оказались внутри него. Ребра кристалла представляют собой прямые, на которых атомы располагаются в ряд. Таких рядов в кристалле тоже огромное количество и они располагаются параллельно действительным ребрам кристалла.
Слайд 15
Исследования ученых в строении кристаллов
В течение долгих
лет геометрия кристаллов казалась таинственной и неразрешимой загадкой. В
1619 великий немецкий математик и астроном Йоган Кеплер обратил внимание на шестерную симметрию снежинок. Он попытался объяснить ее тем, что кристаллы построены из мельчайших одинаковых шариков, теснейшим образом присоединенных друг к другу (вокруг центрального шарика можно в плотную разложить только шесть таких же шариков). По пути, намеченному Кеплером, пошли в последствии Роберт Гук и М. В. Ломоносов. Они так же считали, что элементарные частицы кристаллов можно уподобить плотноупакованным шарикам. В наше время принцип плотнейших шаровых упаковок лежит в основе структурной кристаллографии, только сплошные шаровые частицы старинных авторов заменены сейчас атомами и ионами.
Слайд 16
Закон постоянства двухгранных углов. Отклонения от закона.
Симметричность кристаллов всегда привлекала внимание ученых. Уже в 79г.
нашего летоисчисления Плиний Старший упоминает о плоскогранности и прямобедренности кристаллов. Этот вывод и может считается первым обобщением геометрической кристаллографии. С тех пор на протяжении многих столетий весьма медленно и постепенно накапливался материал, позволивший в конце XVIII в. открыть важнейший закон геометрической кристаллографии - закон постоянства двугранных углов. Этот закон связывается обычно с именем французского ученого Роме де Лиля. Для каждого вещества (минерала), изученного им, оказалось справедливым положение, что углы между соответственными гранями во всех кристаллах одного и того же вещества являются постоянными.
Слайд 17
История открытия закона постоянства углов

прошла огромный, почти двухвековой путь, прежде чем этот закон
был отчетливо сформулирован и обобщен для всех кристаллических веществ.
Так, например, И.Кеплер уже в 1615г. указывал на сохранение углов в 60о между отдельными лучиками у снежинок. В 1669 г. Н. Стенон открыл закон постоянства углов в кристаллах кварца и гематита. Внимательно разглядывая реальные кристаллы кварца, Стенон также обратил внимание на их отклонение от идеальных геометрических многогранников с плоскими гранями и прямыми ребрами. Годом позже Стенона Э. Бартолин сделал тот же вывод применительно кристаллам кальцита, а в 1695 г. Левенгук - к кристаллам гипса. Он показал, что и у микроскопически малых и у больших кристаллов гипса углы между соответственными гранями одинаковы. В России закон постоянства углов был отрыт М. В. Ломоносовым для кристаллов селитры (1749г.) пирита, алмаза и некоторых других минералов.
Версии Лиля закон постоянства углов звучит следующим образом: "Грани кристалла могут изменяться по своей форме и относительным размерам, но их взаимные наклоны постоянны и неизменны для каждого рода кристаллов."
Слайд 18
Однако по мере совершенствования методики и повышения точности
измерения кристаллов выяснилось, что закон постоянства углов оправдывается лишь
приблизительно. В одном и том же кристалле углы между одинаковыми по типу гранями слегка отличаются друг от друга. У многих веществ отклонения двухгранных углов между соответственными гранями достигает 10 - 20', а в некоторых случаях и градуса.
Слайд 19
Грани реального кристалла никогда не представляют собой идеальных
плоских поверхностей. Нередко они бывают покрыты ямками или бугорками
роста, в некоторых случаях грани представляют собой кривые поверхности, например у кристаллов алмаза. Иногда замечаются на гранях плоские участки, положение которых слегка отклонено от плоскости самой грани, на которой они развиваются. Эти участки называются в кристаллографии вицинальными гранями, или просто вициналями.
Таким образом, можно говорить о скульптуре граней, являющейся причиной отклонения от равенства двугранных углов. Изучением различных наростов занимается раздел кристаллографии - Морфология внешней формы кристаллов.
Наблюдаются, конечно, и более закономерные изменения двугранных углов, например зависимость от температуры.
Слайд 20
Необходимо сказать о случаях резкого изменения углов кристаллов,
которое возникает при полиморфном превращении вещества
(образование данным веществом разные по симметрии и форме кристаллы). Например, переход ромбической серы в моноклинную, Еще резче меняет свои свойства кристаллический углерод при переходе алмаза в графит.
Учитывая все вышесказанное, можно так сформулировать закон постоянства углов: «Во всех кристаллах, принадлежащих к одной полиморфной модификации данного вещества, при одинаковых условиях углы между соответствующими гранями (и ребрами) постоянны».
Слайд 21
Дефекты в кристаллах
Кристалл заполнен дефектами. Как же влияют
дефекты на прочность кристаллов. Они понижают прочность, в сотни,
тысячи раз.
Но, по мере того, как растет деформация кристалла, растет и число дефектов в нем. А так как дефекты взаимодействуют друг с другом, то, чем их больше, тем труднее им двигаться в кристалле.
Получается парадокс: если есть дефект кристалл - кристалл деформируется и разрушается легче, чем, если дефекта нет. А если дефектов слишком много, то кристалл опять становится прочным, и чем больше дефектов, тем он более упорядочивается. Значит, если мы научимся управлять числом и расположением дефектов, мы сможем управлять прочностью материалов.
Слайд 22
Выращивание кристаллов в домашних условиях на примере CuSO4
Основой
выращивания кристаллов, как описано в любой литературе, является насыщенный
раствор соли. Однако здесь есть свои нюансы, которые следует оговорить.
Начинающему экспериментатору рекомендую начать опыт, используя в качестве исходного материала для получения кристаллов: медный купорос, гидрофталат калия, красную кровяную соль, бихромат или хромат калия, алюмокалиевые квасцы (ещё часто в литературе советуют хлорид натрия, но растить его крупные правильные кристаллы труднее
В каждой методике выращивания можно выделить несколько подпунктов:
- приготовление маточного раствора;
- получение кристалла-затравки;
- выращивание монокристалла.
Слайд 24
I.Приготовление маточного раствора (прямой и обратный способ):
Примечание:

Многие авторы в своих книгах для простоты указывают таблицы
веществ, и сколько их требуется в граммах на приготовление насыщенного раствора . Но у большинства начинающих химиков, экспериментирующих дома, лабораторные весы, как правило, отсутствуют; во-вторых, точность массы здесь не всегда обязательна, – вещества может требоваться очень много («комнатная температура» у всех разная), а определить насыщенность раствора ещё проще – по прекращению растворения вещества в сосуде. Когда вещество имеется в ограниченном количестве (до 500 грамм), с ним получают небольшие монокристаллы (длина ребра до 2 см), и расходуют его частями, имея запас.
Так иодид калия KI может вырасти из 50 мл концентрированного (но ненасыщенного) раствора, который находился в открытой аптекарской бутылочке, его рост – чистая случайность: вода испарялась, и кристалл рос. Как видите, для малых количеств методика сохраняется, но меняются объёмы посуды и растворителя.
Самое важное условие: для выращивания кристаллов используют только свежеприготовленные растворы!!!
Слайд 25
Прямой способ.
Для приготовления маточного раствора требуется чистый,

хорошо вымытый термостойкий стакан на 1 л. В него
наливают горячую (t=50оС, при высоких температурах вещество сильно гидролизуется) кипячёную воду или, что лучше, дистиллированную 700-800 мл. В стакан засыпают вещество небольшими порциями (1 порция = 1 столовая ложка без горки), каждый раз перемешивая и добиваясь полного растворения. Когда раствор «насытится» – т. е. вещество будет оставаться на дне, добавляют ещё две порции и оставляют раствор при комнатной температуре на сутки.
Чтобы в раствор не попала пыль, его накрывают листом фильтровальной бумаги и оставляют в той части помещения, где сохраняется постоянная температура, где в дальнейшем Вы будете продолжать опыт.
Помните: чтобы кристаллы росли как можно правильно, кристаллизация должна идти медленно, на бесцветных веществах, чьи кристаллы должны быть прозрачны как стекло, скорость роста проявляется заметнее – при быстром росте кристаллы мутнеют!!!
Возможен и обратный способ приготовления насыщенного раствора. Вы максимально растворяете вещество при комнатной температуре, и когда растворение достигнет предела (вещество будет оставаться на дне), добавляете ещё 1-2 порции и греете сосуд с раствором на плите до t=50-60оС. Условие этого способа – используемая посуда должна быть термостойкой, а конфорка плиты ровной, это может создать неудобство при нагревании объёмов, например, в 1 л.
Слайд 26
II. Получение кристалла-затравки:
На следующий день осматривают раствор, в

нём не должно быть примесей, и если они есть,
то нужно очистить раствор с помощью фильтра.
Готовый очищенный раствор аккуратно сливают с осадка кристаллов и в количестве 1л помещают в термостойкую круглодонную колбу. Туда же помещают 1 чайную ложку (с горкой) химически чистого вещества (это могут быть те же выпавшие кристаллы). Теперь колбу нагревают на водяной бане, добиваясь полного растворения. Полученный раствор греют ещё 5 мин на водяной бане при температуре не выше 60-70оС, после чего его переливают в чистый, подогретый до температуры раствора термостойкий стакан (можно ополоснуть кипятком). Стакан обворачивают плотно сухим полотенцем, накрывают фильтровальной бумагой и оставляют остывать. Сейчас раствор надо беречь от сквозняков, от резких перепадов температур.
Резкий перепад температур, как и резкое перемешивание остывшего раствора, могут вызвать преждевременную кристаллизацию, но кристаллы при этом получатся мелкие и бесформенные, они плотно осядут на стенках раствора и нагревание придётся повторять снова.
Спустя сутки, убирают полотенце, не стараясь колыхать стакан, чтобы не вызвать незапланированную кристаллизацию. Осматривают содержимое – на дне и на стенках должны образоваться небольшие плоские синие кристаллики-параллелограммы.
Помните: чем меньше выбранная вами затравка, чем она правильнее, тем легче раствору (системе) подстроиться под неё .
Слайд 27
Монокристалл выращивают из полученной затравки. Используя суровую нить,

плотно на 1-2 раза обвивают затравку, чтобы она не
соскользнула после намокания нити, желательно за самую длинную грань, либо выберите затравку с длинной гранью. Придётся помучиться, создавая петельку, в которую ляжет кристалл размером около 3-5 мм.
Второй конец нити можно примотать к крестовине из деревянных или пластиковых палочек, чья длина больше диаметра стакана.
Снова готовят насыщенный раствор на основе исходного маточного. Для этого готовый раствор ставят на водяную баню и добавляют 0,5 чайной ложки вещества (иногда меньше). Чем меньше Вы добавите его на этом этапе, тем лучше (можно также просто нагреть насыщенный раствор, без добавления вещества). Греют и перемешивают. Как только вещество растворилось, колбу вынимают, и раствор переливают в заранее приготовленный нагретый стакан. Стакан с раствором ставят на выбранное место, и дают 20-30 секунд постоять, чтобы жидкость немного успокоилась. Наш раствор непересыщенный, поэтому «лишние градусы» могут вызвать растворение затравки, что нам не нужно. Если раствор тёплый, ему дают остыть до 30оC или чуть меньше.
Затем затравку располагают в тёплом растворе (температура на 5-7оС выше комнатной) таким образом, чтобы кристаллик как бы висел в нём, на высоте1/2 или 3/5 от дна. Поместив затравку в раствор, понаблюдайте на просвет не оплывают ли грани у Вашей затравки, не создаются ли вокруг неё волнообразные завихрения. Если да – раствор ещё тёплый для затравки, такое бывает с хорошо растворимыми в воде веществами, надо затравку вынимать и подождать ещё.
Когда, наконец, разместили – всё, осталось только ждать, при этом стакан вертеть, наклонять, перемешивать раствор не рекомендуется.
Следует сказать, что можно вырастить кристалл и без нити. Для этого требуется широкий стакан с плоским дном, так как для этой цели затравку аккуратно укладывают на середину дна.
Теперь следует следить за ростом кристалла каждый день, ни в коем случае не поднимая, не поворачивая и не сотрясая стакан с раствором, иначе эта встряска породит в системе незапланированную, иногда мгновенную кристаллизацию
Слайд 28
Рис.15. Выращивание кристаллов меди.
1 – фильтровальная бумага;
2 –
водород;
3 – насыщенный при комнатной температуре раствор хлорида натрия;
4
– слой из железных предметов;
5 – слой хлорида натрия NaCl;
6 – пузырьки воздуха, которые следует удалить;
7 – слой медного купороса CuSO4∙5H2O;
Слайд 29
Рис. 17. Кристаллы меди.
Когда вы решите вынуть кристаллы,
то:
сначала магнитом удаляют оставшееся железо;
аккуратно сливают раствор;
пинцетом удаляют остатки
фильтра;
пинцетом и пластмассовой ложкой выгребают слой хлорида натрия и кристаллы меди в чистый, заранее приготовленный стакан;