Слайд 2
Основные термины занятия (часть 2)
Качественный и количественный состав
молекулы - Qualitative and quantitative composition of the molecule
относительная
молекулярная масса - relative molecular mass
Массовая доля элемента - Mass fraction of element
Молекулярное строение - molecular structure
Фтор - fluorine, хлор - chlorine, азот - nitrogen, кислород — oxygen
Железо- iron, медь - copper , натрий — sodium
Благородные газы - Noble gas
Ксенон, неон, аргон - Xenon, neon, argon
Аллотропия - allotropy
Аллотропные модификации - Allotropic modifications
Слайд 3
Основные термины занятия (часть 3)
Явление - effect
Образование нескольких
веществ - The formation of several substances
Разные — different
Свойства — properties
Способность атома присоединять определенное число атомов - The ability of an atom to add a certain number of atoms
Химическая связь - chemical bond
Постоянная валентность - Constant valence
Переменная валентность - Variable valency
Щелочные металлы - Alkali metal
Наименьшее общее кратное - lowest common multiple
Бинарные соединения - Binary compounds
Углерод - carbon
Слайд 4
Основные термины занятия (часть 4)
Число частиц - The
number of particles
Количество вещества - Amount of substance
Глюкоза
- glucose
Формула для расчета числа молекул - The formula to calculate the number of molecules
Слайд 5
План занятия:
Часть I
Молекулы. Химические формулы. Молекулярные массы.
Простые
и сложные вещества.
Валентность элементов.
Моль. Молярная масса.
Слайд 6
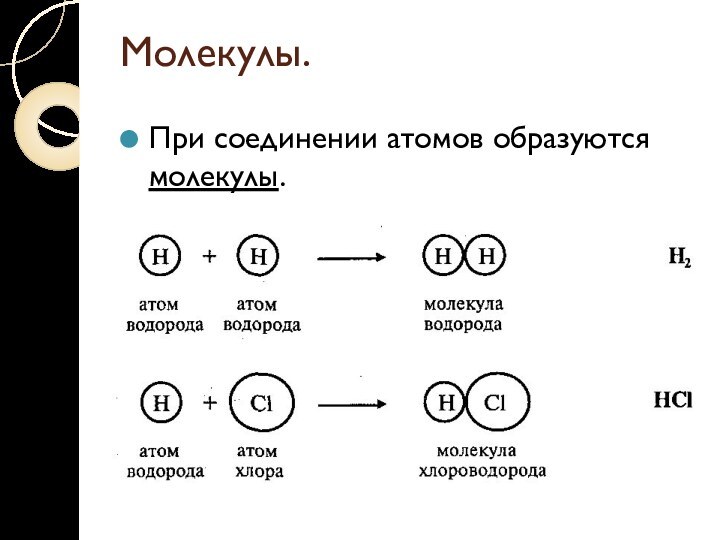
Молекулы.
При соединении атомов образуются молекулы.
Слайд 7
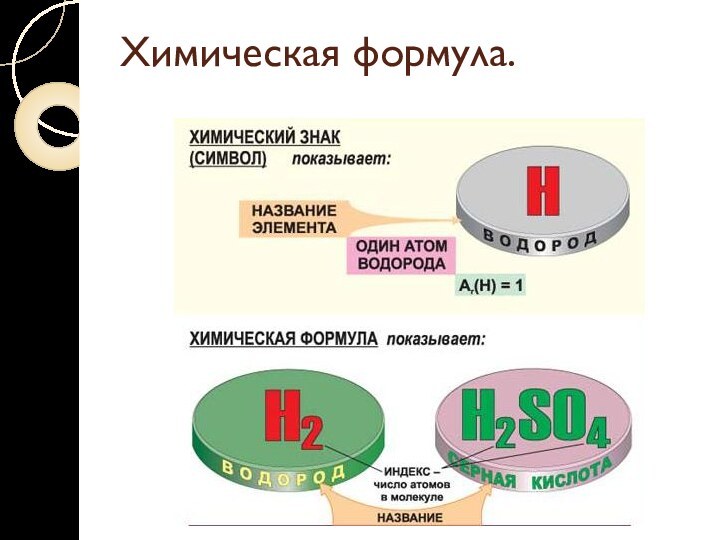
Химическая формула.
Химическая формула - условное обозначение химического
состава и структурыи структуры соединенийи структуры соединений с помощью символов химических элементови структуры соединений с помощью символов химических элементов, числовых и вспомогательных
знаков.
Слайд 10
Молекулярные массы.
Масса любой молекулы равна сумме образующих ее
атомов.
Mr – относительная молекулярная масса.
Рассчитайте Mr: азотной кислоты, серной
кислоты, гидроксида натрия, оксида кальцияоксида фосфора (V), судьфида алюминия.
Слайд 11
Молекулярные массы.
Mr величина безразмерная!
По формуле вещества можно рассчитать
массовую долю каждого химического элемента, который входит в состав
вещества.
Слайд 12
Массовая доля химического элемента в веществе.
Слайд 13
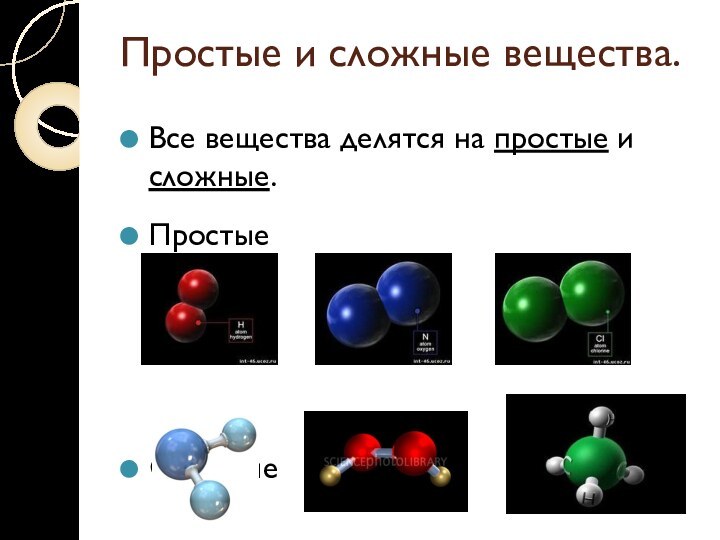
Простые и сложные вещества.
Все вещества делятся на простые
и сложные.
Простые
Сложные
Слайд 14
Простые и сложные вещества.
Простые вещества имеют:
Молекулярное строение: (фтор,
хлор, азот, кислород)
Атомное строение (железо, медь, натрий)
Или являются благородными
газами (ксенон, неон, аргон)
Название простых веществ совпадают с названием элементов!
Слайд 15
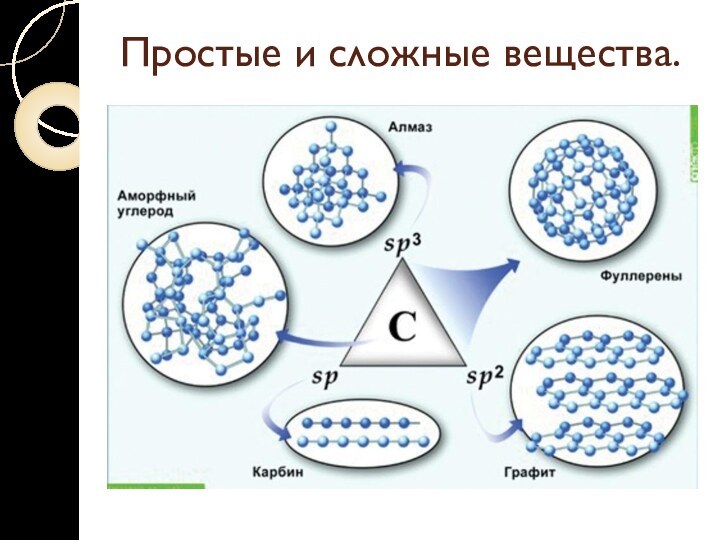
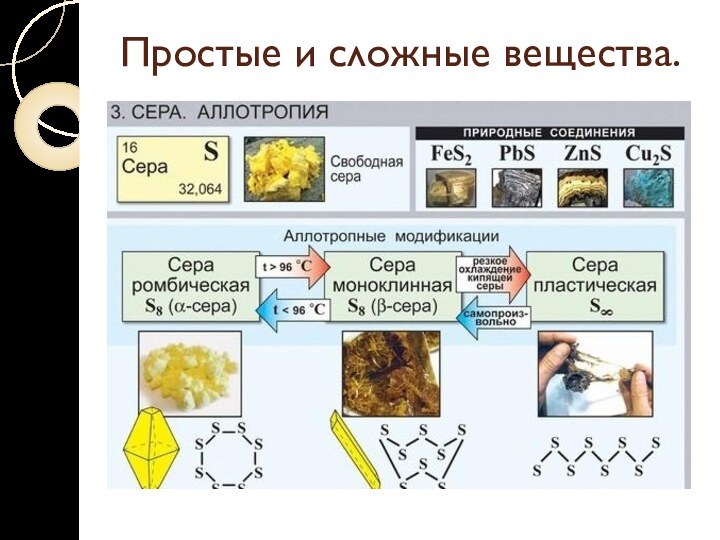
Простые и сложные вещества.
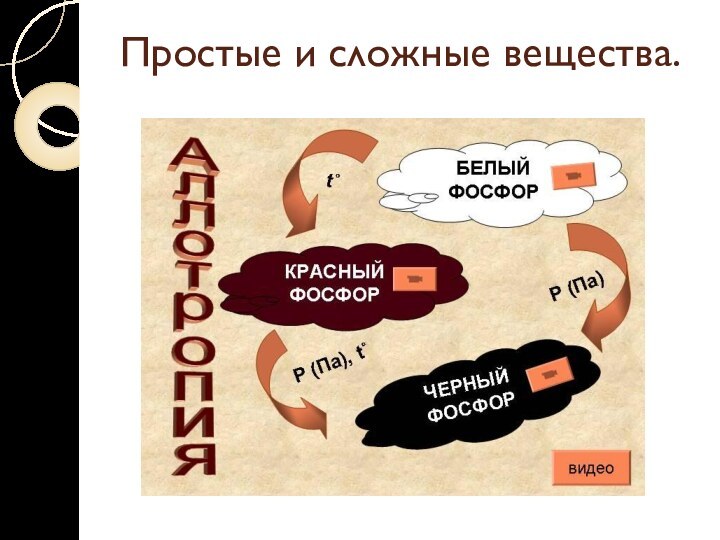
Аллотропия – явление образования нескольких
простых веществ одним элементом.
Разные простые вещества, которые образуются одним
и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).
Слайд 19
Простые и сложные вещества.
Сложные вещества.
Слайд 20
Валентность элементов.
Валентность обозначается римскими цифрами:
I, II, III,
IV, V, VI, VII, VIII
Слайд 21
Валентность элементов.
Элементы с постоянной валентностью I:
H, F, щелочные
металлы: Li, Na, K – образуют только одну химическую
связь.
Элементы с постоянной валентностью II:
O, Mg, Ca, Sr, Ba, Zn
Элемент с постоянной валентностью III:
Al
Слайд 22
Валентность элементов.
Атомы этих элементов в разных соединениях могут
образовывать разное число химических связей.
Слайд 24
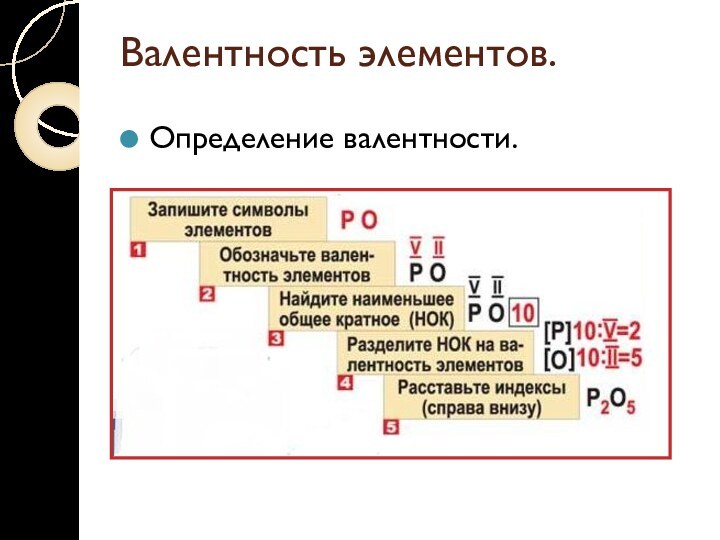
Валентность элементов.
Определение валентности.
Слайд 25
Наименьшее общее кратное (НОК)
Наименьшее общее кратное двух
целых чисел m и n есть наименьшее натуральное число,
которое делится на m и n без остатка
Слайд 26
Валентность элементов.
Правило валентности:
Определить валентность элементов в соединениях: PH3,
P2O5 ,H2S, SiH4
Слайд 27
Моль. Молярная масса.
Единицей количества вещества является моль.
Аа
Рассчитаем
сколько атомов С содержится в 12г углерода.
Слайд 28
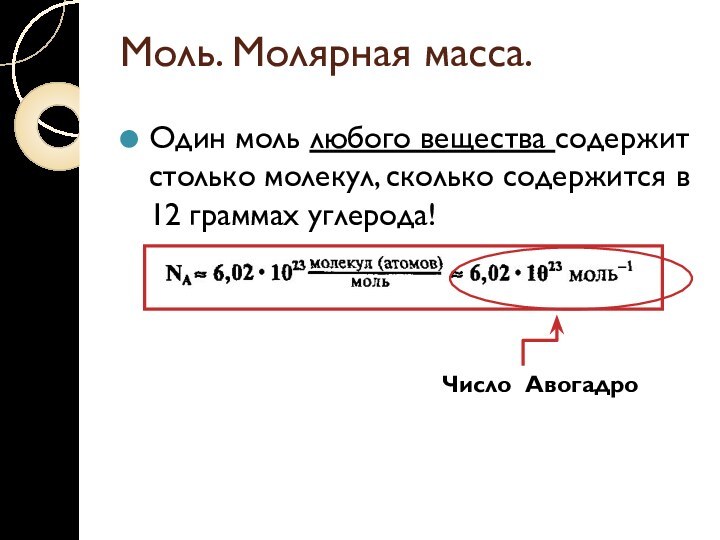
Моль. Молярная масса.
Один моль любого вещества содержит столько
молекул, сколько содержится в 12 граммах углерода!
Число Авогадро
Слайд 29
Моль. Молярная масса.
Если вещество состоит из молекул, то
1 моль это
молекул этого вещества.
Если вещество состоит из атомов, 1 моль это атомов этого вещества.
Следовательно:
Слайд 31
Моль. Молярная масса.
Задача:
Решение:
Слайд 32
Моль. Молярная масса.
Масса одного моля вещества называется молярной
массой.
Молярная масса выражается в г/моль.
Слайд 33
Моль. Молярная масса.
Определим молярные массы:
Водорода
Глюкозы
Железа
Зная молярную массу вещества
М, можно рассчитать количества вещества (число молей) в любой
данной массе вещества: