Слайд 2
Содержание:
Что такое мыло?
Как получают мыло?
Омыление.
Хозяйственное мыло.
Туалетное мыло.
Моющее действие
мыла.
Недостатки мыла.
Синтетические моющие средства.
Получение СМС.
Состав СМС.
ДЛЯ ЧЕГО НУЖНЫ СОСТАВНЫЕ
ЧАСТИ СМС.
Влияет ли температура на моющее действие СМС.
Вывод:
Используемая литература.
Слайд 3
Мыла – это натриевые или калиевые соли высших
карбоновых кислот: пальмитиновой, стеариновой, олеиновой, лауриновой.
Что такое мыло?
Слайд 4
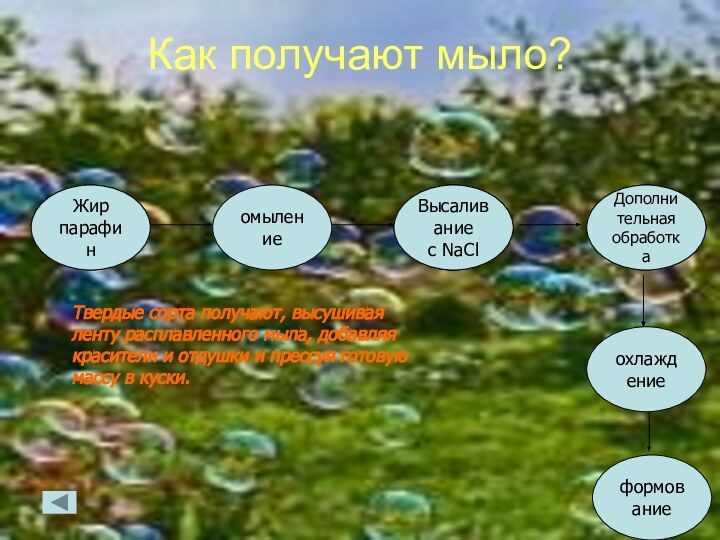
Как получают мыло?
Жир
парафин
омыление
Жир
парафин
Высаливание
с NaCl
Высаливание
с NaCl
Высаливание
с
NaCl
Дополнительная
обработка
Дополнительная
обработка
формование
охлаждение
Твердые сорта получают, высушивая ленту расплавленного мыла, добавляя красители
и отдушки и прессуя готовую массу в куски.
Слайд 5
Омыление.
В результате омыления образуется ядровое мыло из которого
изготавливают хозяйственное и туалетное мыло.
С3Н5(С13Н35СОО)3+3NaOH 3C17H35 COONa+C3H5(OH)3
2С15Н31СООН+Na2СО3
2С15Н31СООNa+Н2О+СО2
Слайд 6
Хозяйственное мыло.
Твердые хозяйственные мыла в зависимости
от сорта содержат 40-72% основного вещества, 0,1-0,2% свободной щелочи,
1-2% свободных карбонатов Na или К, 0,5-1,5% нерастворимого в воде остатка
Слайд 7
Туалетное мыло.
Получают путем дополнительной обработки ядрового
мыла с добавлением: красителей, антисептиков, талька, соды, каолина, душистых
веществ.
Слайд 8
Моющее действие мыла.
Молекулы мыла прикрепляются к мицоле(грязный жир)
и удаляет ее.
Слайд 9
Недостатки мыла.
Не отстирывает в жесткой воде.
Мало пенится.
Слайд 10
Синтетические моющие средства.
Синтетические моющие средства -
это натриевые соли кислых сложных эфиров высших спиртов и
серной кислоты.
Слайд 11
Получение СМС.
R-CH2-OH + H-O-SO2-OH=R-CH2-O-SO2-OH + H2O
R-CH2-O-SO2-OH + NaOH=R-CH2-O-SO2-ONa + H2O
Слайд 13
ДЛЯ ЧЕГО НУЖНЫ СОСТАВНЫЕ ЧАСТИ СМС.
Катионоактивные ПАВ-обладает, кромеиоющего,
еще и дезинфицирующим действием.
Неионогенные ПАВ образуют сравнительно мало пены, и на их основе готовят средства для машинной стирки.
2. Комплексообразователи(Триполифосфат натрия)-одно из немногих хорошее растворимых в воде соединений фосфорной кислоты)
Взаимодействуя с находящимися в воде ионами кальция и магния, фосфат-ион переводит их в осадок состава Са3(РО4)2 и Mg3(РО4)2
Слайд 14
3. Щелочное отбеливание(процесс гидролиза)-это реакция обменного разложения веществ
водой.
Рассмотрим подробнее гидролиз слабой кислоты-Na2CO3 –карбонат натрия.
NaОН
Na2CO3 Н2CO3
Сильное однокислотное основание слабая двухосновная кислота
Гидролиз соли происходит по аниону CO3 .
2Na + CO3 + Н2О НCO3 + 2Na + ОН
Продукт гидролиза - NaН CO3 и NaОН.
Среда водного раствора Na -Na2CO3CO3 –щелочная (рН >7),потому что в растворе увеличивается концентрация ионов ОН.
Гидролиз по аниону соли гидролизуется обратимо.
Химическое равновесие в таких реакциях сильно смещается влево;
При гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
Гидролиз зависит от температуры: при нагревании раствора усиливается гидролиз, усиливается эндотермическая диссоциация воды:
Н2О Н + ОН - 57 кДж, значит, увеличивается количество ионов Н и ОН .
Чтобы подавить гидролиз, нужно охладить раствор.
Слайд 15
4.отбеливатели-для удаления цветных загрязнений, оставщихся после стирки, и
отбеливания.
5.отдушки-впринципе не имеет отношение к стирке, а просто придает
белью приятный запах.
6. стабилизаторы(Карбоксиметилцелюллоза (КМЦ)) выполняет роль стабилизатора пены.
Слайд 16
Влияет ли температура на моющее действие СМС.
Сделав раствор

порошка , разделить раствор на 4 части.
В первую часть
раствора добавить несколько капель фенолфталеина. Он дает порошку малиновый цвет и показывает щелочную среду. При нагревании цвет раствора усиливается.
Во вторую часть добавить лакмус. Он дает раствору синий цвет и выявляет щелочную среду. При нагревание так же усиливается цвет.
В третью часть раствора порошка добавляем метил оранжевый. Он дает раствору оранжевый оттенок и выявляет щелочную среду.
В четвертую часть порошкового раствора при t=20Co опустить РН-полоску (полоска показала РН=10;это значит, что уже в холодной воде щелочная среда высокая). Далее подогреть раствор t=60CO и так же опустить РН-полоску (РН=12;это максимально высокая щелочная среда).
Отсюда , чем выше to , тем сильнее выражена щелочность раствора. Поэтому не желательно стирать вещи из деликатных и синтетических тканей в горячей воде, так как гидролиз с повышением температуры происходит сильнее и это может привести к разрушению волокон ткани.
Слайд 17
Вывод:
Вообще говоря, для стирки
можно использовать разные средства: в каких-то случаях подойдет и
мыло, и сода, и стиральный порошок (а в полном отрыве от цивилизации можно попробовать стирку с древесной золой, которая , как известно, подщелачивает воду). Главное, чтобы выбранное моющее средство более или менее успешно выполняло две функции:
* удаление частиц грязи с очищаемой поверхности и
* перенос их в раствор.