- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Окислительно – восстановительные реакции
Содержание
- 2. Окислительно – восстановительные реакции… – реакции, протекающие с изменением степени окисления элементов.
- 3. Два антипода парою ходят, Первый – теряет;
- 4. Основные положения теории ОВР.
- 5. Окислитель + электроны
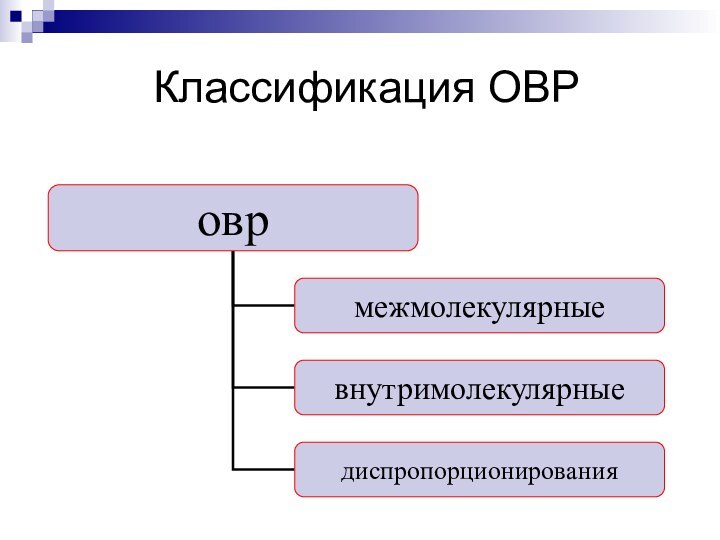
- 6. Классификация ОВР
- 7. Алгоритм составления ОВРОпределить степени окисления элементов
- 8. Число отданных и принятых электронов должно быть
- 9. Алгоритм определения степеней окисления
- 10. ВосстановительКалийГаллий
- 11. Э Э n+Атомы металлов (I и II гр.,
- 12. АзотФторОкислитель
- 13. Окислитель Э Э n-Атомы элементов VI–VII групп (О2, Сl2…).Ионы
- 14. Степень окисления – Условный заряд атомов химического
- 16. Сера (-2,0,+2,+4,+6)Железо ( +2, +3)
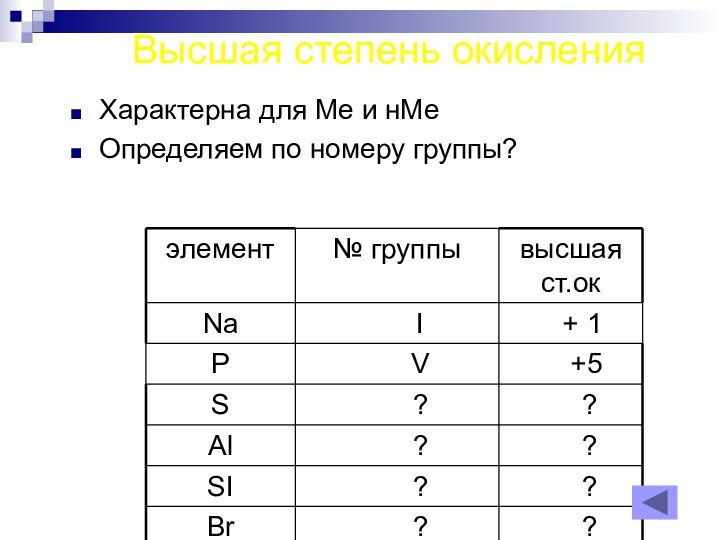
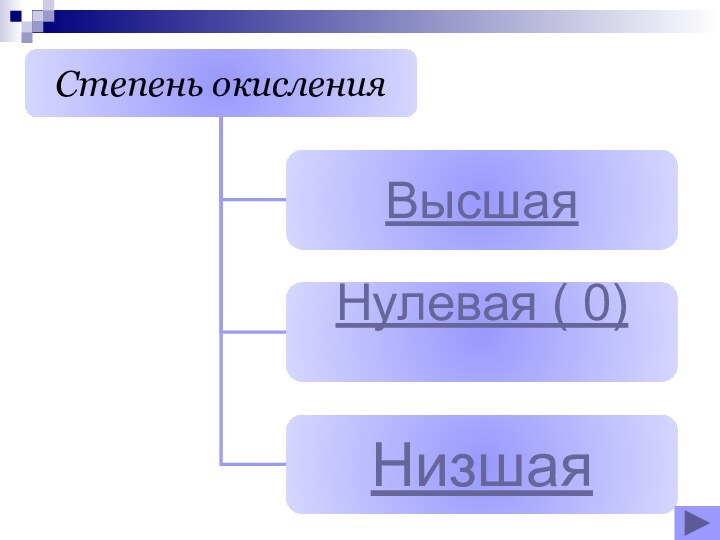
- 17. Высшая степень окисленияХарактерна для Ме и нМеОпределяем по номеру группы?
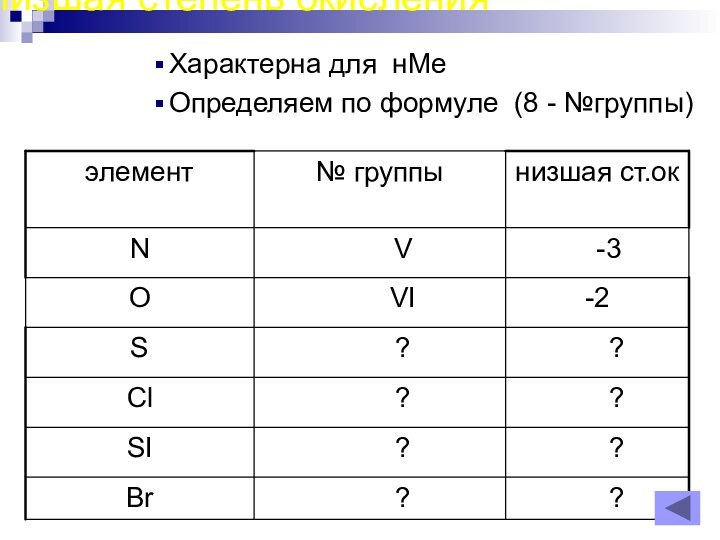
- 18. Низшая степень окисления Характерна для нМеОпределяем по формуле (8 - №группы)
- 19. Нулевая ( 0) Все простые веществаБромЛитийЙод
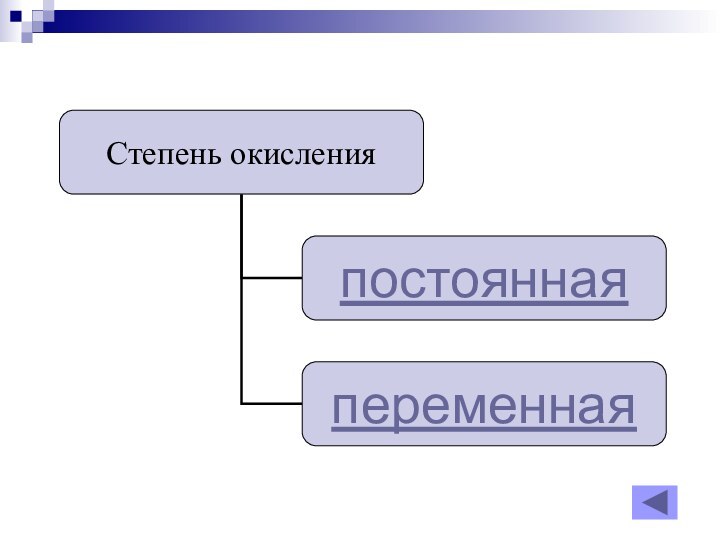
- 20. постоянная
- 21. Тест для 8 классаТема: «Окислительно – восстановительные реакции»
- 22. Инструкция по выполнению тестаВнимательно прочитайте задание и
- 23. Степень окисления серы K2SO3 в равна+3+2+6+4
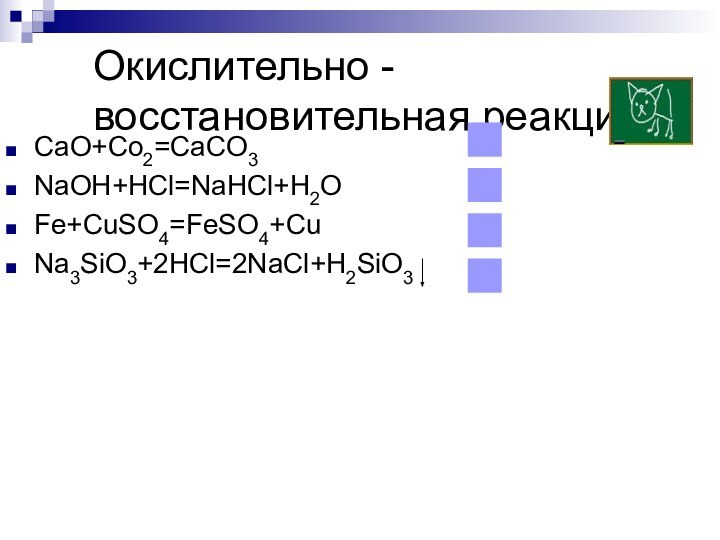
- 24. Окислительно - восстановительная реакцияCaO+Co2=CaCO3NaOH+HCl=NaHCl+H2OFe+CuSO4=FeSO4+CuNa3SiO3+2HCl=2NaCl+H2SiO3
- 25. ОкислительПринимает электроныОкисляетсяОтдаёт электроныНе изменяет степень окисления
- 26. Магний имеет минимальное значение степени окисления+2-20+1
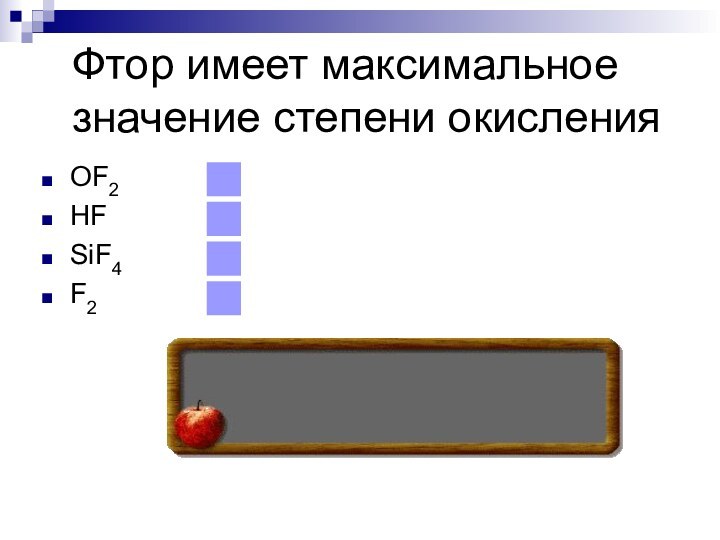
- 27. Фтор имеет максимальное значение степени окисленияOF2HFSiF4F2
- 28. Конец тестированияМолодец!Справились верно с 5 заданиямиОтличная работа!
- 29. Вы ответили неправильно!Прочитайте параграф 43 ещё раз.Выполните тестовое задание снова.Закончить тестирование!Вернуться на тестовое задание
- 30. Скачать презентацию
- 31. Похожие презентации
Окислительно – восстановительные реакции… – реакции, протекающие с изменением степени окисления элементов.



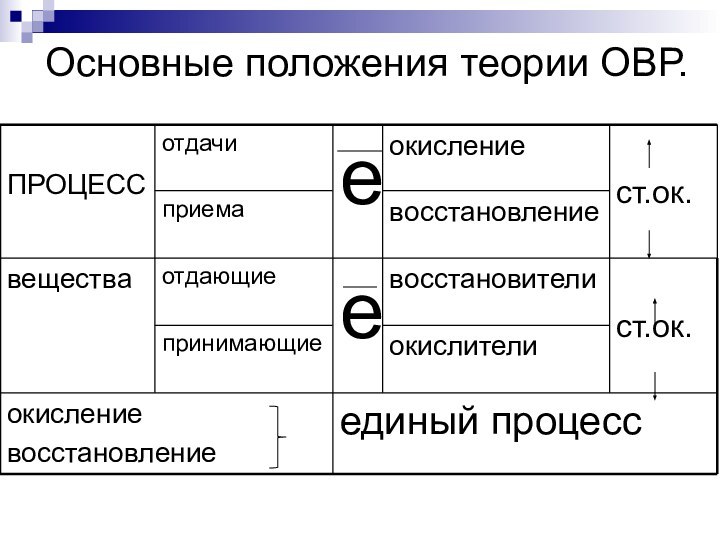


















Слайд 2
Окислительно – восстановительные реакции
… – реакции, протекающие с
изменением степени окисления элементов.
Слайд 3 Два антипода парою ходят, Первый – теряет; второй -
находит, Ролью меняясь при этом порой… Кто ж из них первый
и кто же второй?восстановитель
окислитель
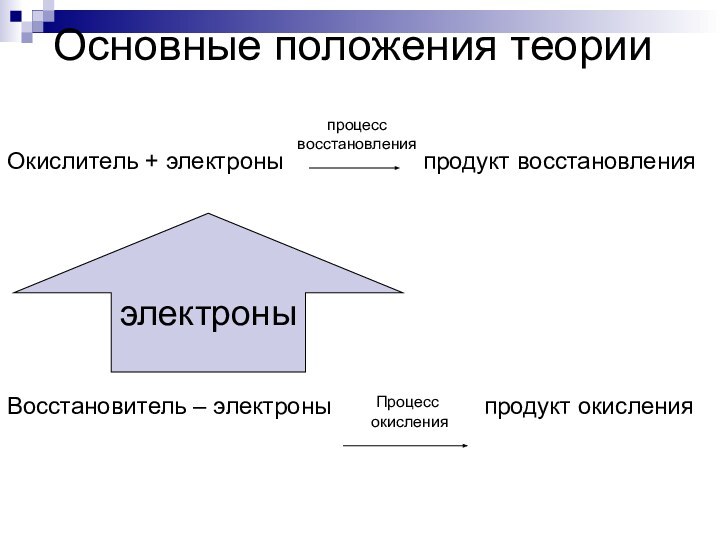
Слайд 5
Окислитель + электроны
продукт восстановления
Восстановитель – электроны
продукт окисленияпроцесс
восстановления
электроны
Процесс
окисления
Основные положения теории
Слайд 7
Алгоритм составления ОВР
Определить степени окисления элементов в
соединениях, участвующих в реакции.
Выявить элемент, степень окисления которого понизилась,
повысилась, окислитель и восстановитель.Выявить число отданных и принятых электронов.
Слайд 8
Число отданных и принятых электронов должно быть одинаковым.
Если это не так, то составить электронный баланс:
Найти НОК
числа отданных и принятых электронов;Делением НОК на число отданных и принятых получить коэффициент перед восстановлением;
Делением НОК на число принятых электронов получить коэффициент перед окислением;
Умножить полуреакции окисления и восстановления на соответствующие коэффициенты.
Перенести коэффициенты в общее уравнение.
Слайд 11
Э Э n+
Атомы металлов (I и II гр., Al,
Fe, Zn…).
Отрицательно заряженные ионы неметаллов (S2–, Cl –, Br
–… до свободных элементов).Ионы металлов в низких степенях окисления (Mn2+ Mn1+).
Ионы и молекулы, содержащие атомы в промежуточных степенях окисления (бисульфит).
Восстановитель
Слайд 13
Окислитель
Э Э n-
Атомы элементов VI–VII групп (О2, Сl2…).
Ионы металлов
в высоких степенях окисления (Cu2-
Cu+)Ионы молекул содержат атомы неметаллов в высоких степенях окисления (КМnО4 – Mn7+).
Ионы и молекулы, содержащие атомы неметаллов в высоких степенях окисления.
Слайд 14 Степень окисления – Условный заряд атомов химического элемента
в соединении, вычисленный на основе предположения, что все соединения
только ионные.