- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Оксид углерода II
Содержание
- 2. ОКСИД УГЛЕРОДА II
- 3. Ц,
- 4. СО-угарный газ
- 5. Получение СО:В газогенераторах:
- 6. Получение СОСжигание углерода в свободном виде или
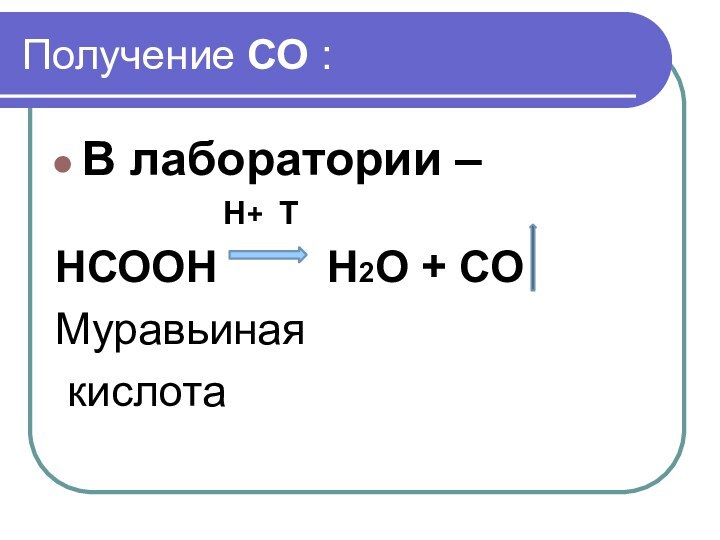
- 7. Получение СО :В лаборатории –
- 8. Химические свойства СО 1.При нагревании -
- 9. При нагревании -восстановительс оксидами металлов:С +2 О
- 10. ОКСИД УГЛЕРОДА (IV)и(IV)
- 11. ОКСИД УГЛЕРОДА (IV)Ц, З, Д
- 12. ОКСИД УГЛЕРОДА (IV)При комн. Т0 и Р=60
- 13. «Парниковый эффект»
- 14. Получение: 1)В промышленности- обжиг известняка:
- 15. : Получение со22) При сгорании углеродсодержащих
- 16. Получение:3)В лаборатории - действием сильных кислот на
- 17. Химические свойства:Кислотный оксид C021) С02 + Н20
- 18. Химические свойстваПри повышенной t° - окислительные свойства С02 (тв.) + 2Mg = 2MgO + С° «сухой лед»
- 19. Качественная реакция на со2- помутнение известковой воды
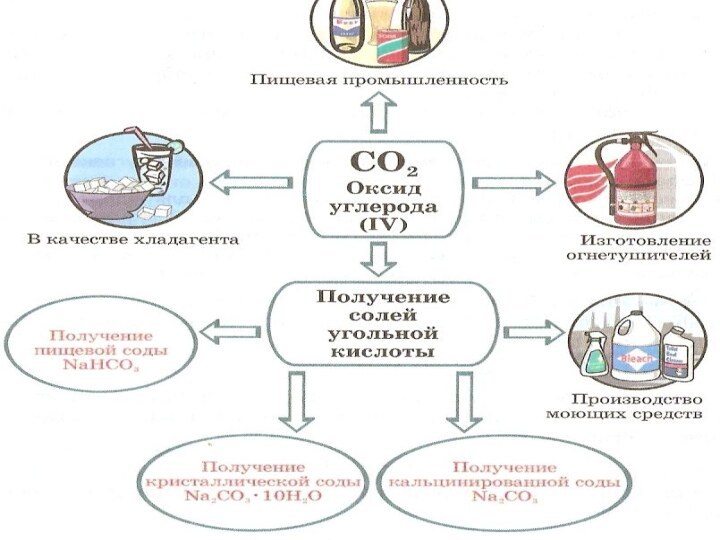
- 20. Применение СО
- 21. Применение СО2В теплицах:6С02 + 6Н20 —> С6Н1206 +602
- 23. ЗакреплениеКак получают СО в лаборатории и в
- 24. 1)Рассчитайте относительную плотность оксидов углерода
- 25. Скачать презентацию
- 26. Похожие презентации
ОКСИД УГЛЕРОДА II





















Слайд 5
Получение СО:
В газогенераторах:
С
+ 02 =СО2 +402кДж
СО2 +
С = 2СО - 175кДжС+Н2О=СО+Н2- Q
Водяной газ.
Слайд 6
Получение СО
Сжигание углерода в свободном виде или в
виде соединений(кокс,уголь,бензин)
1000`С 2С + 02 = 2 СО
Слайд 8
Химические свойства СО
1.При нагревании - восстановитель
с кислородом
t° = 700°С:
2С +2О+ 02=2С+4 02+577кДж
С водой,с растворами кислот
и щелочей не взаимодействует-несолеобразующий оксид.
Слайд 9
При нагревании -восстановитель
с оксидами металлов:
С +2 О +
Си +2 О = Си 0 + С +4
02с хлором (на свету) :
СО + Сl2 = СОСl2 -ОВ-Фосген
Химические свойства СО
Слайд 11
ОКСИД УГЛЕРОДА (IV)
Ц, З, Д возд
СО2=1,5
о = с = о
Р (в 1V Н20 -
1V С02 при t° 15°С р = 1атм),
Слайд 12
ОКСИД УГЛЕРОДА (IV)
При комн. Т0 и Р=60 атм.сжижается.
При
испарении поглощается много тепла, превращается
С02(тв.) - хладагент («сухой
лед»)При т = (-78С) и Р=1атм. кипит-С02
Слайд 16
Получение:
3)В лаборатории - действием сильных кислот на карбонаты:
СаС03
+ 2HCl = СаСl2 + С02 + Н20
4)При медленном
окислении в биохимических процессах.(дыхании,гниении,брожении.)
Слайд 17
Химические свойства:
Кислотный оксид C02
1) С02 + Н20
Н2С03
2)С02+2NaOH =Na2С03+ Н20
С02+NaOH
= NaHС03
Слайд 18
Химические свойства
При повышенной t° - окислительные свойства
С02 (тв.)
+ 2Mg = 2MgO + С°
«сухой лед»
Слайд 19
Качественная реакция на со2
- помутнение известковой воды :
С02+Са(ОН)2 —> СаС03 + Н20
СаС03+С02+ Н20 —>Са(НС03)
2
Слайд 23
Закрепление
Как получают СО в лаборатории и в промышленности?
При
каких условиях может образоваться угарный газ.
Горящая лучинка гаснет в
азоте и в углекислом газе. Как эти газы можно отличить друг от друга?Слайд 24 1)Рассчитайте относительную плотность оксидов углерода (II)
и (IV)
воздуху. Какой газ легче или тяжелее воздуха?
2)
Напишите уравнения двух реакций, доказывающих, что диоксид углеродаотносится к кислотным оксидам





























