определение, состав, номенклатуру, классификацию оксидов.
3. Знать классификацию оксидов по
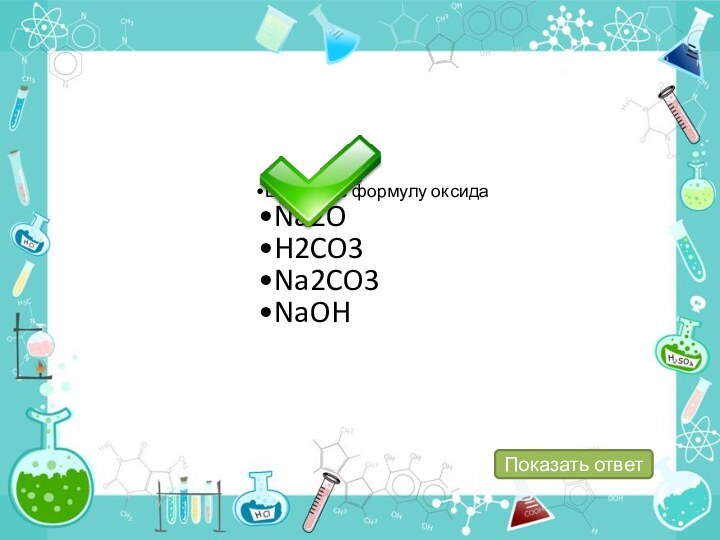
химическим свойствам: несолеобразующие и солеобразующие (основные, кислотные и амфотерные).4. Уметь составлять молекулярные и структурные формулы оксидов.
5. Изучить способы получения оксидов.
6. Уметь составлять уравнения химических реакций.
Тема: "Оксиды:
состав, номенклатура, свойства"
Оксиды: состав, номенклатура, свойства