- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Оксиды углерода
Содержание
- 2. Оксиды углерода (II) и (IV) Тема: Содержание Входной тестСтроение молекул Физические свойстваФизиологическое воздействиеПолучениеХимические свойстваПрименениеЗакрепление знаний
- 3. Оксиды углерода (II) и (IV) Тема:
- 4. Оксиды углерода (II) и (IV) Тема: Строение молекул Оксид углерода (II)Оксид углерода (IV)
- 5. Оксиды углерода (II) и (IV) Тема:
- 6. Оксиды углерода (II) и (IV) Тема:
- 7. Оксиды углерода (II) и (IV) Тема:
- 8. Оксиды углерода (II) и (IV) Тема:
- 9. Оксиды углерода (II) и (IV) Тема:
- 10. Скачать презентацию
- 11. Похожие презентации









Слайд 3
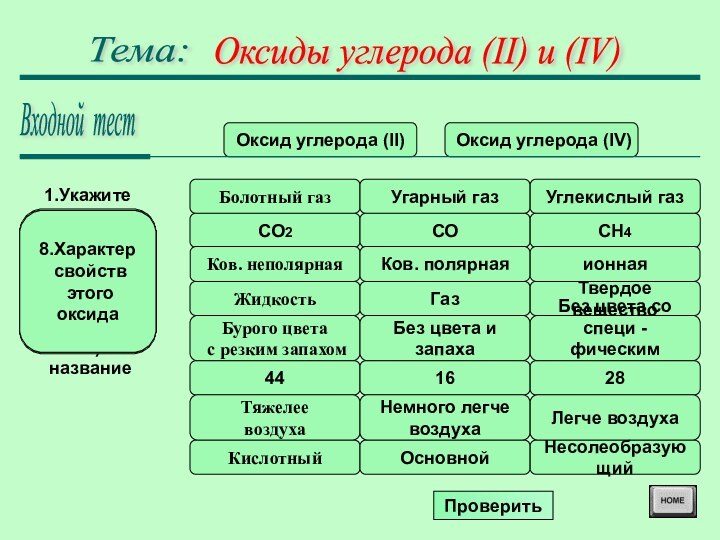
Оксиды углерода (II) и (IV)
Тема:
Оксид
углерода (II)
Оксид углерода (IV)
Болотный газ
1.Укажите
тривиальное
(исторически
сложившееся)
название
Угарный
газУглекислый газ
CO2
2.
Молекулярная
формула
CO
CH4
Ков. неполярная
3.Химическая
связь
в молекуле
Ков. полярная
ионная
Жидкость
4.Агрегатное
состояние
при обычных
условиязх
Газ
Твердое вещество
Бурого цвета
с резким запахом
5.Цвет, запах
Без цвета и запаха
Без цвета со специ -
фическим запахом
44
6.
Относительная
молекулярная
масса
16
28
Тяжелее
воздуха
7.
Относительная
плотность
по воздуху
Немного легче
воздуха
Легче воздуха
Кислотный
8.Характер
свойств
этого
оксида
Основной
Несолеобразующий
Проверить
Входной тест
Слайд 5
Оксиды углерода (II) и (IV)
Тема:
Физические
свойства
Оксид углерода (II)
Оксид углерода (IV)
Г, Ц,
З, ЯД!Г, со слегка кисловатым
запахом и вкусом
100v H2O - 2,3 V CO
100v H2O - 88 V CO2
Хранят СО в баллонах красного цвета
Слайд 6
Оксиды углерода (II) и (IV)
Тема:
Физиологическое
воздействие
Оксид углерода (II)
Оксид углерода (IV)
ЯД!
Он соединяется с гемоглобином, нарушая тканевое дыхание и вызывая кислородное голодание тканей. Физиологическое воздействие на человека: 0,01 - до 480 мин. - слабая . головная боль; 0,05 - до 60 мин. - тошнота, . . . . . усиленное сердцебиение; 0,1 - до 60 мин. - рвота, потеря . . сознания; 0,5 - до 20-30 мин. - смертельное . . . отравление.
Не токсичен, но не поддерживает дыхание.
Физиологическое воздействие на человека:
до 2% - до 480 мин. - учащается . дыхание;
2 - 5% - до 30 мин. -появляется шум . . в ушах, учащается пульс;
5 - 8 % - 5 - 10 мин. - сильные . . . головные боли, недомогание;
Свыше 10% - 1-2 мин. - потеря
.. . сознания, смерть.
Слайд 7
Оксиды углерода (II) и (IV)
Тема:
Получение
Оксид углерода (II)
Оксид углерода (IV)
1) С + О2 =
2СО +Q( недостаток О2)
2) В промышленности:
С + СО2 → 2СО - 175 kДж
3) В лаборатории:
t, Н2SО4
НСООН Н2О + СО
Муравьиная кислота
Н2С2О4 → СО + СО2 +Н2О
Щавелевая кислота
1) С + О2 = СО2 +Q
(избыток О2)
2) В промышленности:
t
СаСО3 → СаО + СО2
3) В лаборатории:
СаСО3 +2НСl → СаСl2 +Н2О + СО2 ۟
Слайд 8
Оксиды углерода (II) и (IV)
Тема:
Химические
свойства
Оксид углерода (II)
Оксид углерода (IV)
СО
– несолеобразующий оксид1) Горит синим пламенем
СО + О2 → 2СО2 +572кДж
2) С галогенами
СО + Сl2 → СОCl2 (фосген –ЯД! )
3) Сильный окислитель
СО +СuO →Cu + CO2
СО2 – кислотный оксид
1 )Взаимодействует с водой
СО2 + Н2О Н2СО3
2) Взаимодействие со щелочами
СО2 +2 NaОН→ Na2СО3 + Н2О
СО2 + NaОН→ NaНСО3 (изб. СО2)
Качественная реакция:
СО2 +Сa(ОН)2→ СаСО3 ↓ + Н2О
3) Взаимодействие с оксидами
СО2 + ВaО→ ВaСО3
4) СО2 –окислитель
2Мg + CO2 →2 MgO + C
Слайд 9
Оксиды углерода (II) и (IV)
Тема:
Применение
Оксид углерода (II)
Оксид углерода (IV)
В пищевой промышленности используется
как консервант; В качестве разрыхлителя теста;
Сухой лёд используется в качестве хладагента в ледниках и морозильных установках;
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей;
Для производства газированной воды и лимонада;
В качестве инертной среды при сварке проволокой.
В смеси с H2 и другими горючими газами в качестве топлива;
При получении спиртов, альде-гидов, карбоновых кислот и др.;
Восстановитель в металлургии (напр., при выплавке чугуна и стали);
Для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкуса.