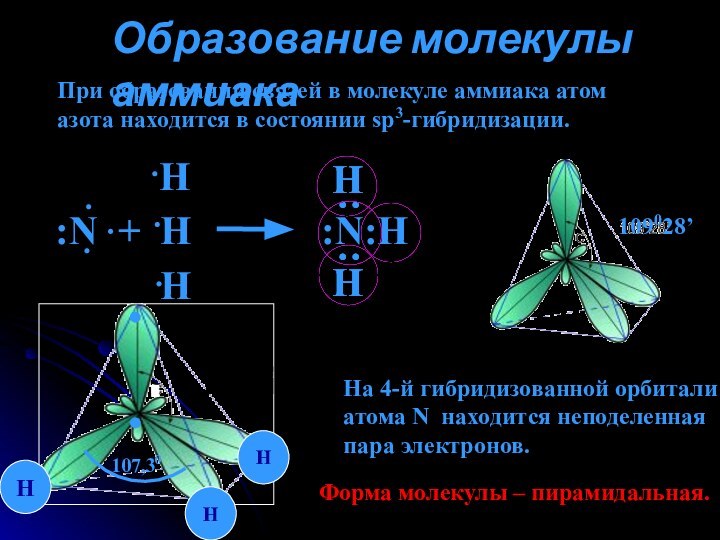
аммиака.
Физические свойства.
Способы получения аммиака.
Химические свойства аммиака.
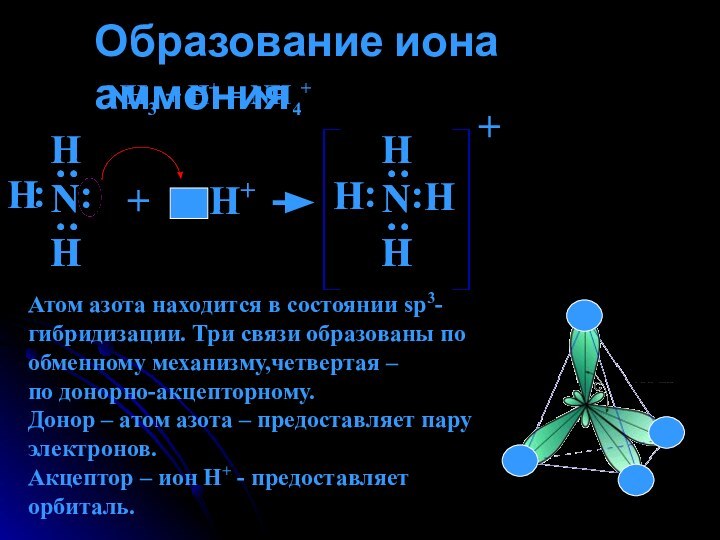
Образование иона аммония.Свойства солей аммония.
Разложение солей аммония при нагревании.
Применение аммиака и солей аммония.