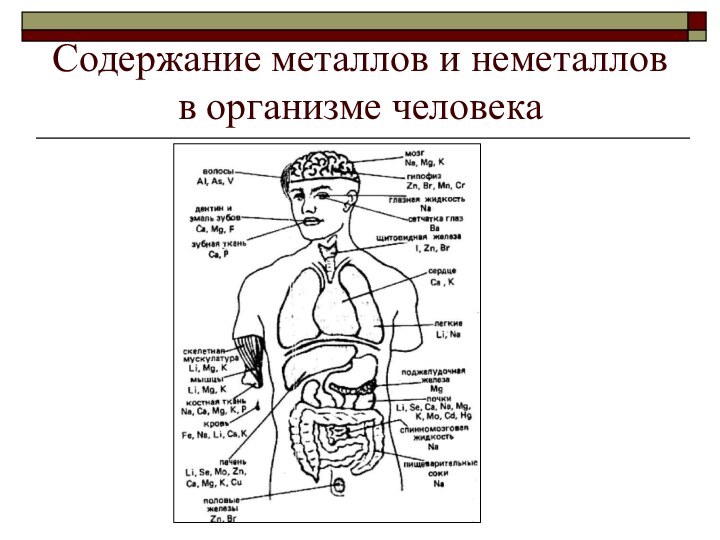
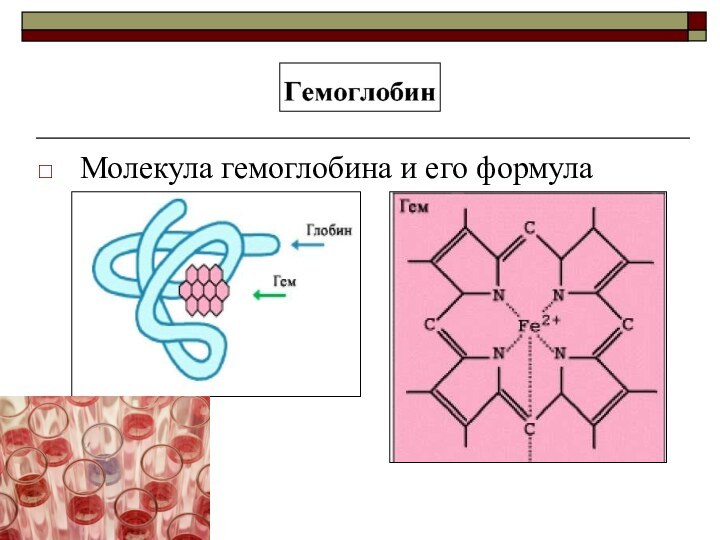
атомы,
В менделеевский взятые круг,
Сделали химию самой богатой
И самой творческой из наук.
Г. Санников
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть












![Органические соединения железа Качественная реакция на ион Fе3+Реактив – желтая кровяная соль К4[Fе(СN)6]Результат – синий](/img/tmb/14/1302289/e3ef2469b2a4634a810e1a940dc9453c-720x.jpg)