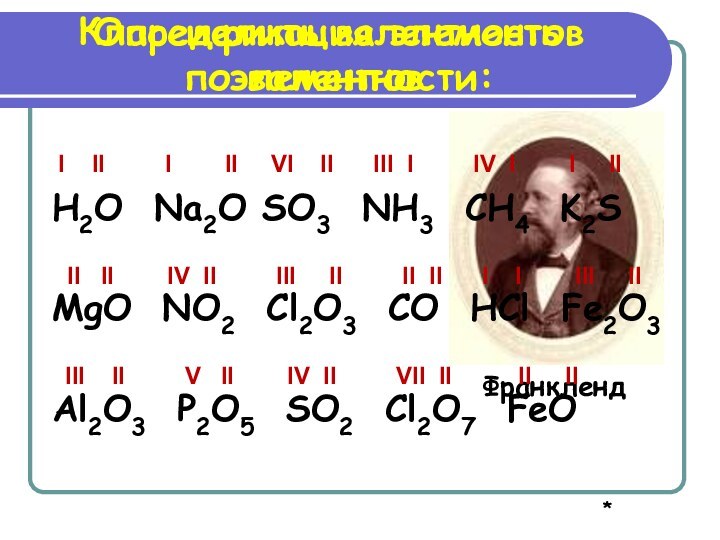
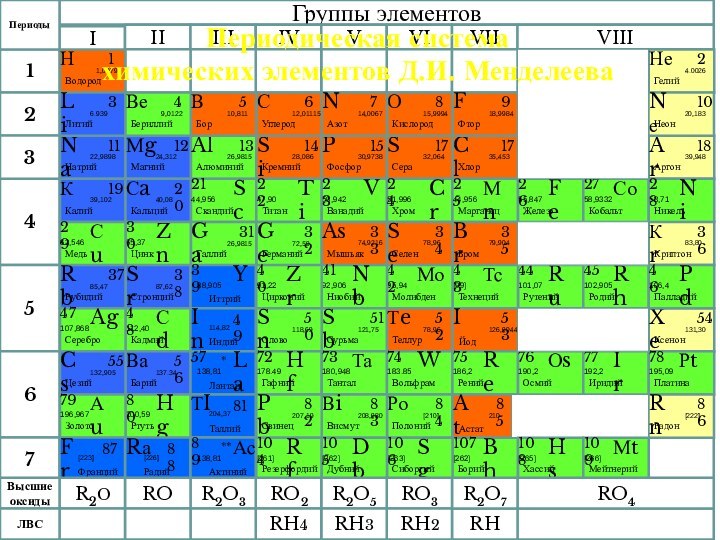
XIX века было известно уже 63 химических элемента.
Учёных –
химиков того времени волновал вопрос:«Как классифицировать известные химические элементы?»
*
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть









*
*
неметаллы
*
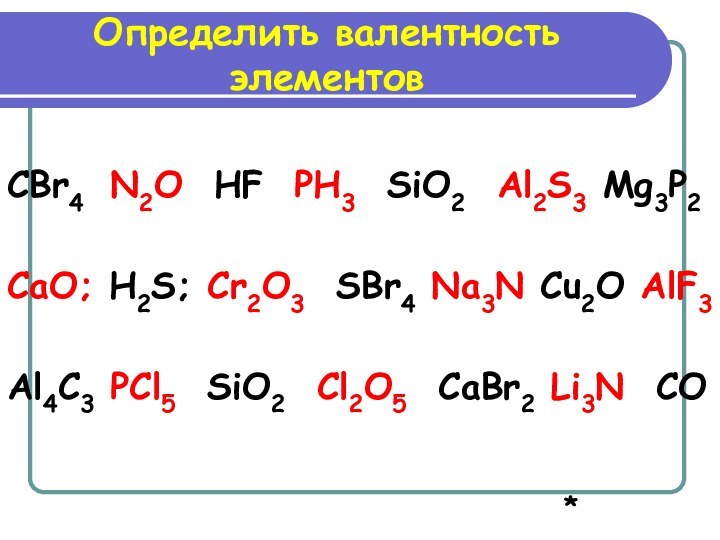
Определить валентность элементов
*
I
H
Na
K
Cl
II
O
C
S
Mg
Fe
III
Cl
Fe
Al
N
IV
C
S
N
V
P
VI
S
VII
Cl
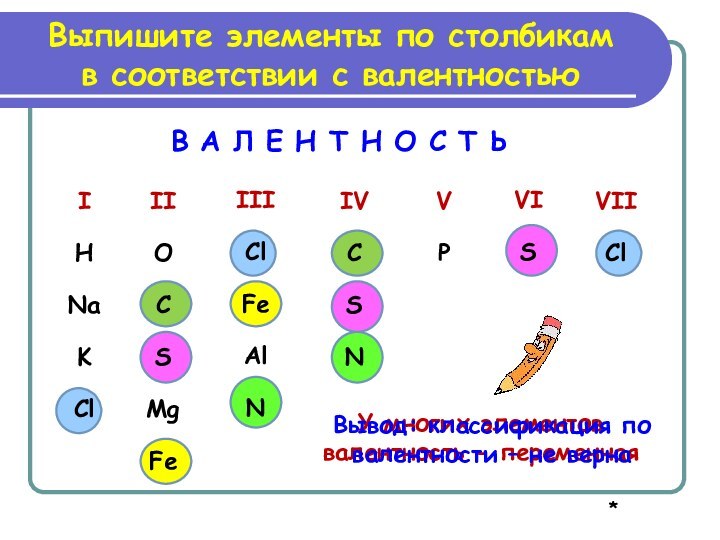
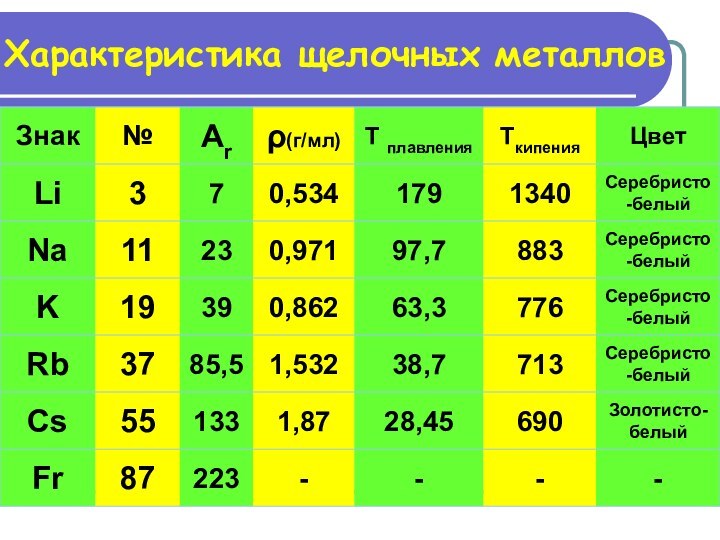
У многих элементов валентность - переменная
Вывод: классификация по
валентности – не верна
*
Определить валентность элементов
*
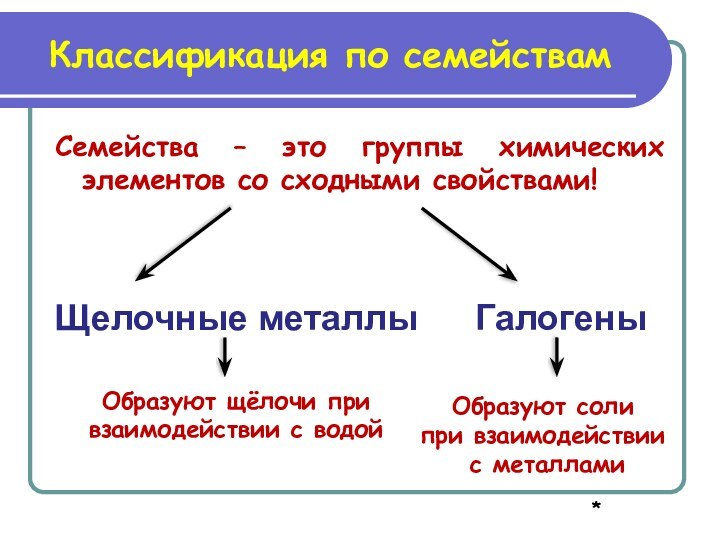
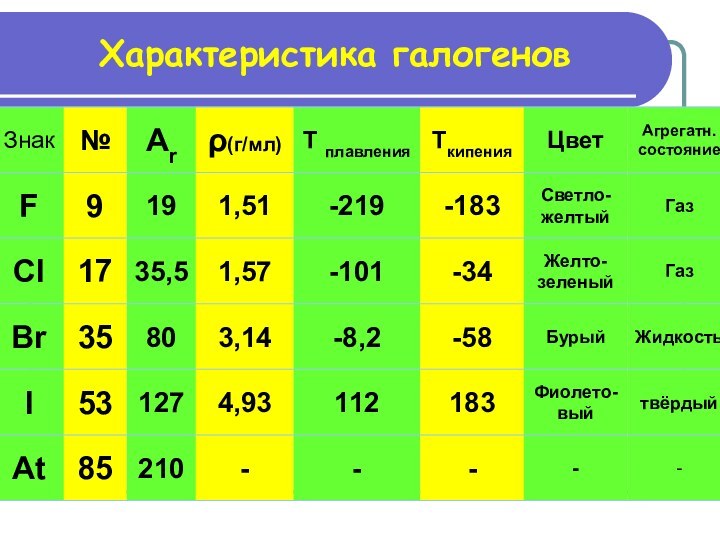
Образуют соли
при взаимодействии
с металлами
*
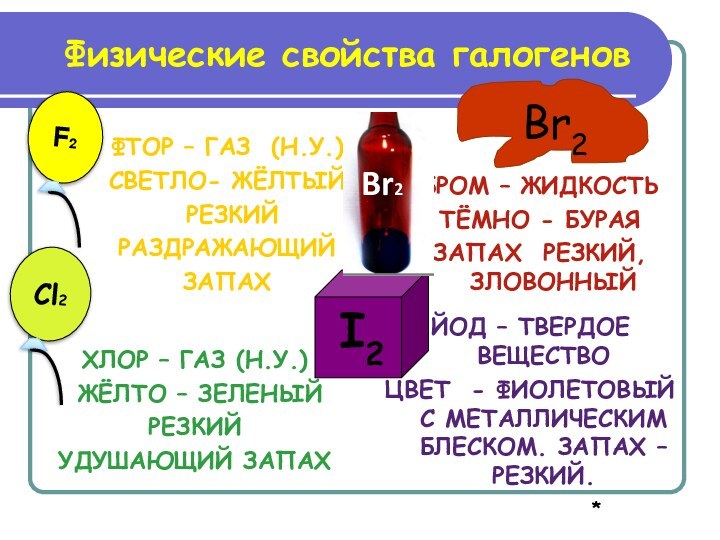
ЙОД – ТВЕРДОЕ ВЕЩЕСТВО
ЦВЕТ - ФИОЛЕТОВЫЙ С МЕТАЛЛИЧЕСКИМ БЛЕСКОМ. ЗАПАХ – РЕЗКИЙ.
Физические свойства галогенов
F2
Cl2
Br2
*
о
р
с
о
р
о
2
2
2
2
3
2
3
6
*