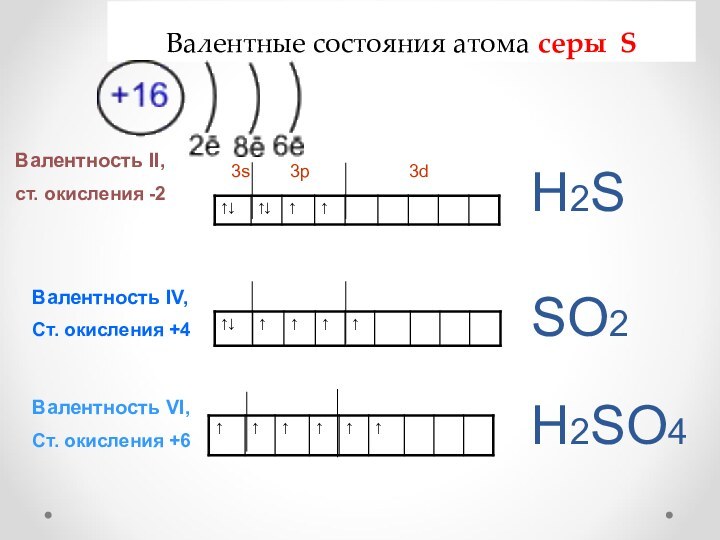
серы S
Валентность II,
ст. окисления -2
3s
3p 3dВалентность IV,
Ст. окисления +4
Валентность VI,
Ст. окисления +6
Н2S
SО2
Н2SО4
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть





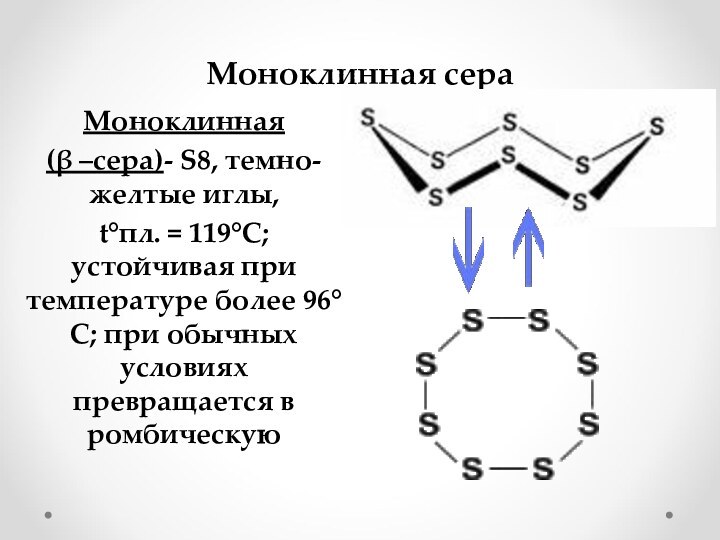











Валентность IV,
Ст. окисления +4
Валентность VI,
Ст. окисления +6
Н2S
SО2
Н2SО4