- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Валентность и степень окисления 8 класс
Содержание
- 3. Формы существования химического элемента
- 4. Из атомов мир создавала Природа. Два атома
- 5. Н2ОПочему такой состав имеет молекула воды?
- 6. Задачи урока:1. выяснить, от чего зависит состав сложных веществ;2.что необходимо знать, чтобы составить формулы веществ.
- 7. Самостоятельная работа1. Составьте:А) схемы строения атомов водорода
- 8. 1.Как называется способность атомов образовывать связи с
- 9. ВыводыЧисло связей, в которых атом может принимать
- 10. Определите валентность элементов по структурной формуле.Внесите значение
- 11. Степень окисленияСтепень окисления (с.о.)- это условный заряд,
- 12. Сравнение понятий валентность и степень окисленияВалентность
- 13. Правила определения степеней окисления У свободных атомов
- 14. Проверка задания 3 стр.55 1. Н20, Ва0,
- 15. Определение степени окисления элементов в соединениях+3 х
- 16. Задачи урока:1. выяснить, от чего зависит состав сложных веществ;2.что необходимо знать, чтобы составить формулы веществ.
- 17. Выводы:1. Состав сложных веществ зависит от строения
- 18. Скачать презентацию
- 19. Похожие презентации
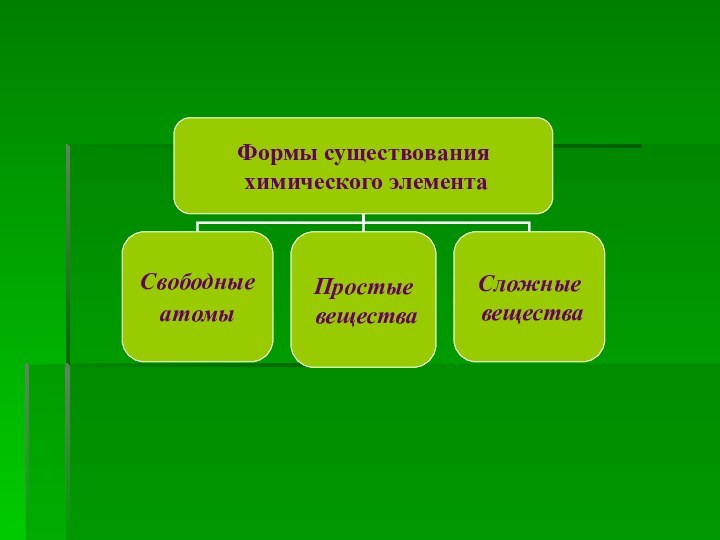
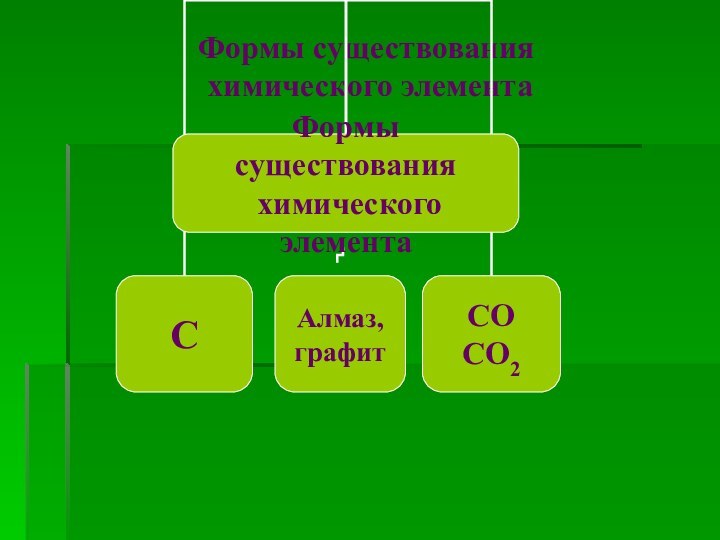
Формы существования химического элемента















Слайд 6
Задачи урока:
1. выяснить, от чего зависит состав сложных
веществ;
2.что необходимо знать, чтобы составить формулы веществ.
Слайд 7
Самостоятельная работа
1. Составьте:
А) схемы строения атомов водорода и
кислорода;
Б) схему образования химической связи в молекуле воды;
В) структурную
формулу молекулы воды.
Слайд 8
1.Как называется способность атомов образовывать связи с другими
атомами?
2.Какие электроны называются валентными?
3. От чего зависит образование связей
в молекулах веществ?
Слайд 9
Выводы
Число связей, в которых атом может принимать участие
в молекуле называется валентностью.
Валентные электроны расположены на внешнем энергетическом
уровне.В образовании связей участвуют электроны внешнего слоя и неспаренные электроны.
Слайд 10
Определите валентность элементов по структурной формуле.
Внесите значение валентности
элементов в таблицу.
Валентность
Степень окисленияН
О
Са
Аl
С
Слайд 11
Степень окисления
Степень окисления (с.о.)- это условный заряд, который
мог бы возникнуть на атоме при условии, что все
общие электронные пары смещены к более электроотрицательному элементу.
Слайд 12
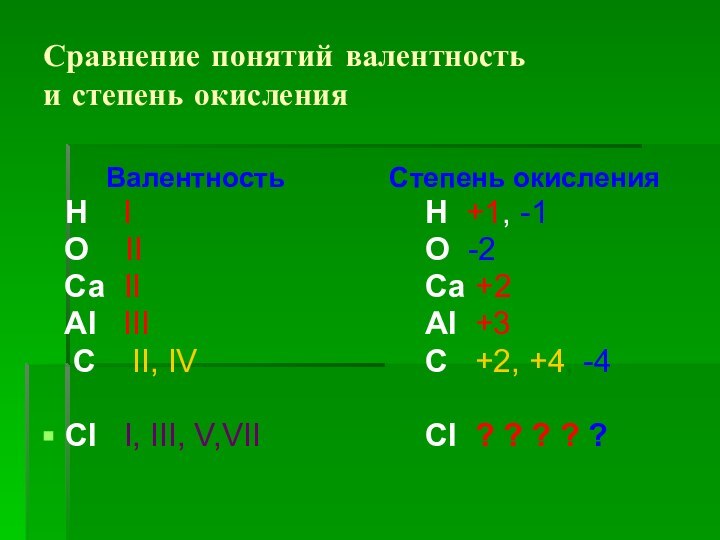
Сравнение понятий валентность
и степень окисления
Валентность
Н I
О II
Са II
Аl III
С II, IV
CI I, III, V,VII
Степень окисления
Н +1, -1
О -2
Са +2
Аl +3
С +2, +4, -4
CI ? ? ? ? ?
Слайд 13
Правила определения степеней окисления
У свободных атомов и
у простых веществ СТЕПЕНЬ ОКИСЛЕНИЯ равна 0
Металлы во всех
соединениях имеют ПОЛОЖИТЕЛЬНУЮ С.О.В соединениях кислород имеет С.О.-2
(кроме Н2О2 , К2О2, ОF2 )
В соединениях с неметаллами у водорода С.О.+1, а с металлами -1
В соединениях сумма всех С.О. равна 0
Слайд 14
Проверка задания 3 стр.55
1. Н20, Ва0, N20,
S0, AI0, Cu0, F0
2. К2+1О, Ca+2CO3 , Al+3Cl3
,Li3+1N, Ba+2SO4 , Mg+2(SO4 )
3. Н2CO-23 , К 2О-2, CuSO4-2,
NaO-2H, SO-23
4. H+1Cl, КН-1 , КОН+1, BaН 2-1,
Н2+1SO4 , NН3+1
Слайд 15
Определение степени окисления элементов в соединениях
+3 х
АlСl 3
(+3)*1 + х *3 = 0;
+3 = - 3х
Х = -1
+3 -1
АlСl 3





























