является очень слабым электролитом.
При её электролитической диссоциации образуются
катионы водорода и гидроксид-ионы (анионы):Н2О Н+ + ОН¯
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


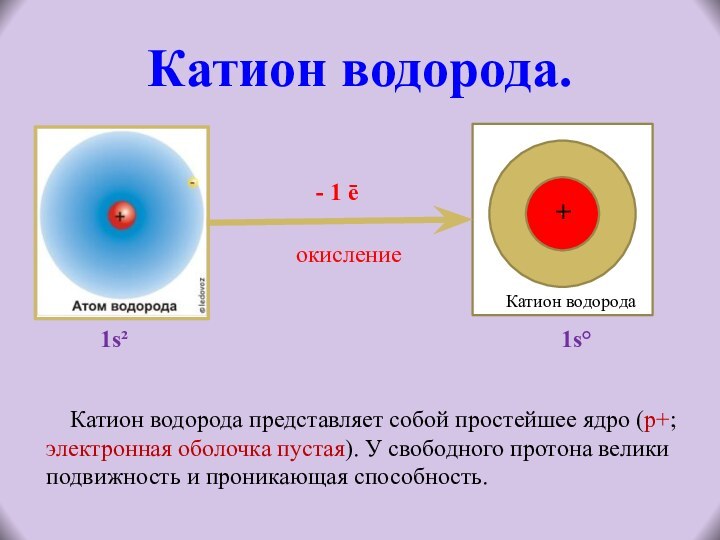











1s² 1s°
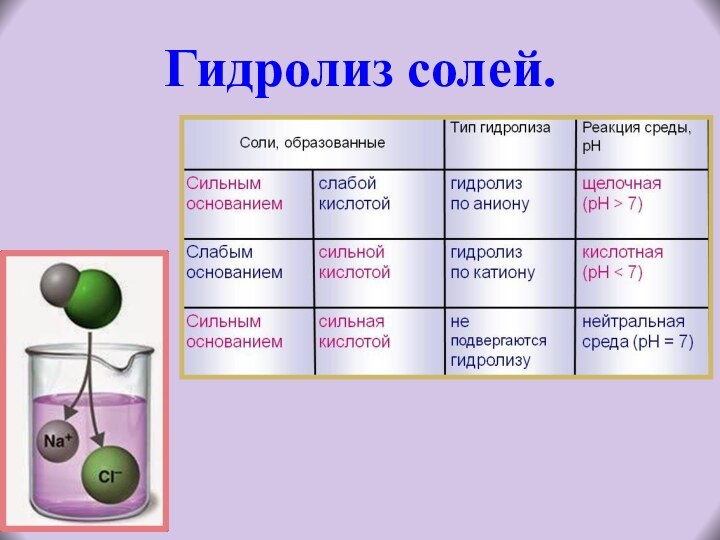
Если среди образовавшихся ионов присутствуют анионы слабой кислоты, то гидролиз протекает по аниону.
Если среди образовавшихся ионов присутствуют катионы слабого основания, то гидролиз протекает по катиону.
Список гидролизующихся анионов:
CO3²¯ SiO3²¯ SO3²¯ S²¯ ClO¯
CH3COO¯ NO2¯ SeO3²¯ Se²¯ BrO¯
CN¯ PO4³¯ TeO3²¯ Te²¯ F¯
ЗАПОМНИ! Степень гидролиза соли по аниону зависит от степени диссоциации продукта гидролиза:
чем слабее кислота, тем выше степень гидролиза
Проверь себя!
Имеет ли (да, нет) смысл обсуждать гидролиз соли, если она практически нерастворима в воде?
Из солей NaF, KJ, BaF2, KNO3 , KNO2 ,Na2SO3 , BaSO4,Na3PO4, K2S , FeS, NaClO, K2CO3 выберите те, которые подвергаются гидролизу по аниону.
Составьте уравнения гидролиза солей K2CO3, Na3PO4, Na2S, Укажите среду раствора.
Клик!
Список гидролизующихся катионов:
Al³+ Co²+ Fe²+ Mn²+ Pb²+
Be²+ Cr³+ Fe³+ NH4+ Zn²+
Cd²+ Cu²+ Hg²+ Ni²+
Проверь себя!
Из солей AgBr FeBr3 CuSO4 AlCl3 AlF3 KClO3 AgCl NH4Cl
K2CO3, Na3PO4, Na2S выберите те, которые подвергаются гидролизу по катиону.
Составьте уравнения гидролиза солей:
сульфат марганца (II) бромид аммония
нитрат железа (III) карбонат цезия
нитрат калия ортофосфат рубидия
Клик!