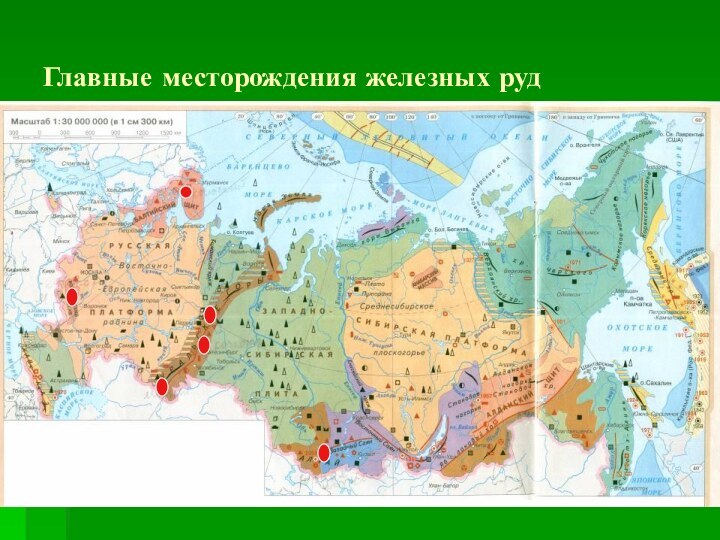
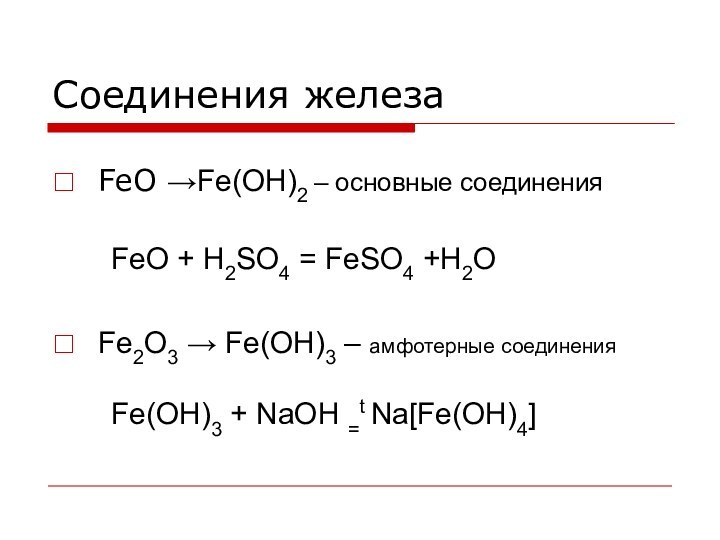
мира, самый главный элемент
окружающей нас природы. Оно основа
культуры и промышленности. Оно орудие войны и мирного труда, и во всей таблице Менделеева
невозможно найти другой такой элемент , который был бы так связан с
прошлыми, настоящими и будущими судьбами человечества.
академик Ферсман А.Е.