- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Жидкие системы
Содержание
- 2. КристаллЖидкостьГазВ температурной последовательности жидкое состояние - промежуточное между кристалли-ческим и газообразным
- 3. Диаграмма состояния воды1 - Кривая насыщенного пара
- 4. 8.2. Общие представления о растворахРастворы – это
- 5. Классификация растворов (по агрегатному состоянию) РастворыГазообразныеВоздух, природный
- 6. Способы выражения состава растворовМассовая доля – масса
- 7. 8.3. Растворение. Термодинамические факторы процессаПроцесс растворения связан
- 8. Растворение – самопроизвольный процесс: ΔG0 независимо от
- 9. Тепловой эффект процесса растворения определяется соотношением |
- 10. Изменение энтропии: ΔSр. = ΔSсольв.+ ΔSф.п.+ ΔSдифΔSсольв0
- 11. Процесс растворения определяется: - природой растворителя и растворенного вещества; - агрегатным состоянием растворяемого вещества; - температурой.LiClO3HgS
- 12. 8.4. РастворимостьРастворенное вещество + растворитель = раствор,
- 13. 8.5. Общие свойства растворовИдеальным называется гипотетический раствор,
- 14. Закон Рауля (1888 г) Сs,ps0,5Сs, 0,5psОтносительное
- 15. Следствия из закона РауляПовышение температуры кипения ипонижение
- 16. Осмос. IIIΔhIIIРастворенное веществоЯвление, связанное со способностью
- 17. Скачать презентацию
- 18. Похожие презентации
КристаллЖидкостьГазВ температурной последовательности жидкое состояние - промежуточное между кристалли-ческим и газообразным














Слайд 2
Кристалл
Жидкость
Газ
В температурной последовательности жидкое состояние - промежуточное между
кристалли-ческим и газообразным
Слайд 3
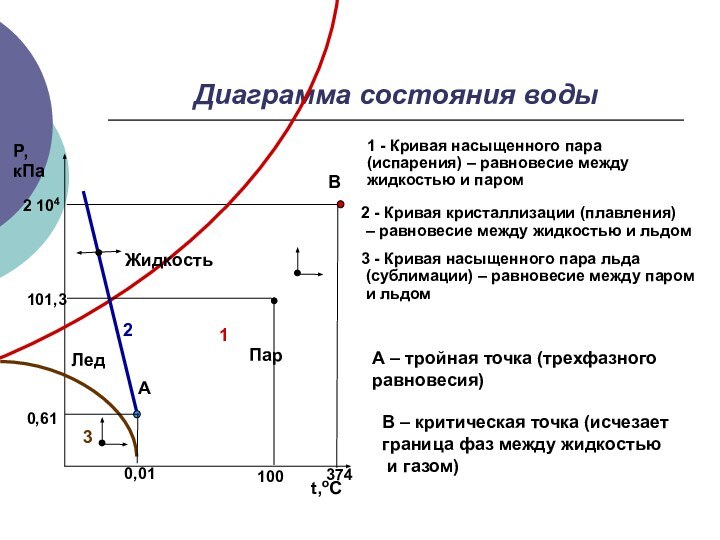
Диаграмма состояния воды
1 - Кривая насыщенного пара (испарения)
– равновесие между жидкостью и паром
0,01
100
374
0,61
101,3
2 104
1
2
3
А –
тройная точка (трехфазного равновесия)2 - Кривая кристаллизации (плавления)
– равновесие между жидкостью и льдом
3 - Кривая насыщенного пара льда
(сублимации) – равновесие между паром
и льдом
В – критическая точка (исчезает
граница фаз между жидкостью
и газом)
Слайд 4
8.2. Общие представления о растворах
Растворы – это гомогенные
(однофазные) системы, состоящие из
двух и более компонентов, состав
которых можно изменять в опре-деленных пределах, не нарушая их однородности.
Классификация дисперсных систем
Слайд 5
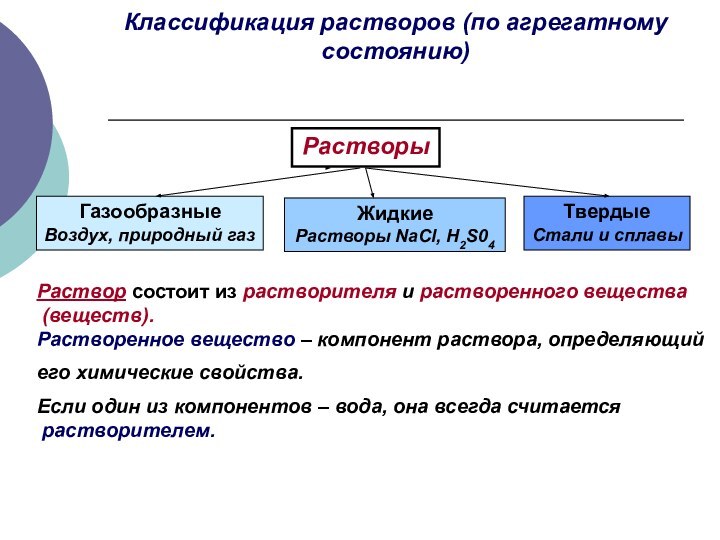
Классификация растворов (по агрегатному состоянию)
Растворы
Газообразные
Воздух, природный газ
Жидкие
Растворы
NaCl, H2S04
Твердые
Стали и сплавы
Раствор состоит из растворителя и
растворенного вещества(веществ).
Растворенное вещество – компонент раствора, определяющий
его химические свойства.
Если один из компонентов – вода, она всегда считается
растворителем.
Слайд 6
Способы выражения состава растворов
Массовая доля – масса растворенного
вещества, отнесенная к массе всего раствора, выражается в долях
единицы (1) или в процентах (2)1) 2)
Моляльность – количес-тво растворенного ве-щества в 1000 г (1 кг) рас-творителя, моль/1000г H2O
Молярность – количество растворенного вещества в 1 литре раствора, моль/л
Нормальность – количес-тво эквивалентов рас-творенного вещества в 1 литре раствора,
моль экв/л
Слайд 7
8.3. Растворение. Термодинамические факторы процесса
Процесс растворения связан с
самопроизвольным распределением частиц одного вещества между частицами другого. Он
происходит благодаря действию сил межмолекулярного взаимодействия.Основные стадии: 1) сольватация, 2) фазовый переход, 3) диффузия сольватированных частиц
NaCl
H20
NaCl
раствор
Слайд 8 Растворение – самопроизвольный процесс: ΔG
ΔHф.п.+ ΔHдиф
ΔHсольв
с нейтрализацией зарядов →с понижением энергетического уровня системы;ΔHф.п>0 при растворении твердого вещества. Для разрушения кристаллической решетки необходимо затратить энергию.
ΔHдиф>0 независимо от фазового состояния растворяемого вещества . Диффундируя, сольватированные частицы должны преодолевать силы межмолекулярного взаимодействия растворителя.
Если | ΔHф.п+ ΔHдиф| > | ΔHсольв|, процесс растворения – эндотермический.
Если | ΔHф.п+ ΔHдиф| < | ΔHсольв|, процесс растворения – экзотермический.
Слайд 9 Тепловой эффект процесса растворения определяется соотношением | ΔHф.п|,
|ΔHдиф| и | ΔHсольв|
С повышением температуры
- растворимость
твердых веществ в жидкостях повышается, т.к. | ΔHф.п+ ΔHдиф| >| ΔHсольв| поскольку величина ΔHф.п – велика (высокая энергия связи в кристаллической решетке.- растворимость жидкостей в жидкостях как правило понижается, т.к. | ΔHф.п+ ΔHдиф| <| ΔHсольв|, поскольку, например, у серной кислоты высокая энергия сольватации
- растворимость газов в жидкостях понижается: с повышением температуры кинетическая энергия газа в газовой фазе увеличивается значительно сильнее, чем кинетическая энергия газа в жидкости. Поэтому молекулам газа с повышением температуры гораздо легче покинуть жидкость, чем перейти из газового состояние в жидкое.
Слайд 10
Изменение энтропии:
ΔSр. = ΔSсольв.+ ΔSф.п.+ ΔSдиф
ΔSсольв
связана с упорядочиванием зарядов
ΔSф.п
ΔSф.п>0 для жидкостей,ΔSф.п>0 для твердых веществ
ΔSдиф >0
Слайд 11
Процесс растворения определяется:
- природой растворителя и растворенного вещества;
-
агрегатным состоянием растворяемого вещества;
- температурой.
LiClO3
HgS
Слайд 12
8.4. Растворимость
Растворенное вещество + растворитель = раствор, ΔG
раствор ненасыщенный
Растворенное вещество + растворитель = раствор, ΔG=0 раствор
ненасыщенныйРастворенное вещество + растворитель = раствор, ΔG>0 раствор пересыщенный
Концентрация растворенного вещества в насыщенном растворе называется его растворимостью.
Слайд 13
8.5. Общие свойства растворов
Идеальным называется гипотетический раствор, образованный
веществами, имеющими строго одинаковые размеры частиц и строго одинаковую
энергию межмолекулярного взаимодействия.
Слайд 14
Закон Рауля
(1888 г)
Сs,ps
0,5Сs, 0,5ps
Относительное понижение давления
насыщенного
пара растворителя над
раствором равно мольной доле рас-
творенного вещества
р0
– давление насыщенного пара над чистым растворителем;р0 – давление насыщенного пара над раствором
ν1 – количество молей растворенного вещества
ν1 – количество молей растворителя
Сμ –мольная доля раствора
Слайд 15
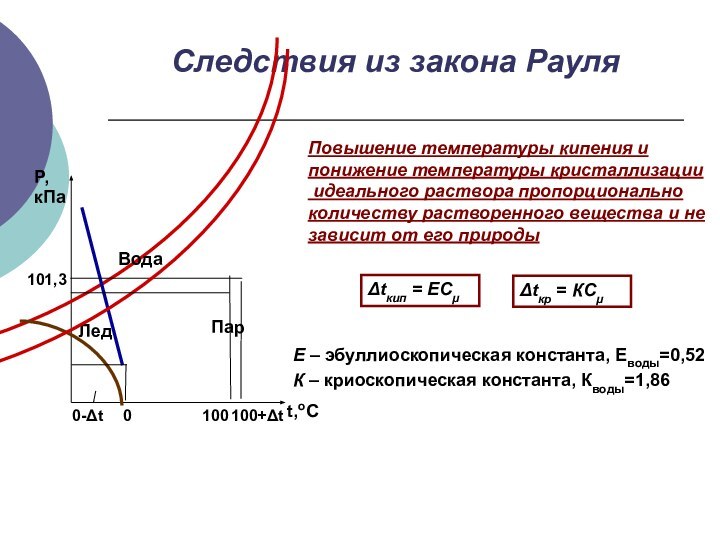
Следствия из закона Рауля
Повышение температуры кипения и
понижение температуры
кристаллизации
идеального раствора пропорционально
количеству растворенного вещества и не
зависит
от его природыΔtкип = ECμ
Δtкр = КCμ
Е – эбуллиоскопическая константа, Еводы=0,52
К – криоскопическая константа, Кводы=1,86