Слайд 2
Что такое API?
Активный фармацевтический ингредиент (AФИ)
Вещество или соединение,
предназначенное для использования при производстве лекарственного средства в качестве
терапевтически активного соединения (ингредиента).
«Выдача разрешений на маркетинг лекарственных препаратов с акцентом на многоисточниковые (генерические) препараты» — Руководствe ВОЗ для органов по регулированию оборота лекарственных средств (WHO Blue Book — Синяя книга ВОЗ)
Слайд 3
Основные направления презентации
Сбор и интерпретация доступной информации относительно
AФИ (исследования перед составлением досье), например:
Возможный производитель(ли)
Литература, все аспекты
(химические/физические)
Фармакопейные монографии (например, АРВ-препараты)
Требования к досье для AФИ
Руководство, стр. 4 - 9
Слайд 4
Часть 1. Доступная информация об API
(для производителей API
и/или FPP)
Почему так важно осуществлять сбор и анализ доступной
информации об AФИ на систематической основе?
Некоторые результаты:
Глубокое научное понимание AФИ , в разрезе их свойств, стабильности, спецификаций, etc.
Содействие производству AФИ и составлению мастер-файла (Drug Master File — DMF) препарата
Возможность полноценного выбора производителя API (источника)
Помощь при составлении досье
Значение для фармацевтической разработки ГЛС
Экономия времени / денег
Слайд 5
Информация о потенциальных производителях AФИ
Решение по поводу выбора
производителя AФИ должно быть сформировано перед началом или на
самых ранних стадиях исследоавний по разработке ГЛС
Необходимость в последующих изменениях может быть вполне оправдана
Заслуживает ли производитель доверия? Его репутация
Лицензия на производство и соответствие GMP?
Доступна ли для ознакомления открытая часть DMF и соответствует ли она всем требованиям?
Имеется ли валидный CEP?
Соответствует ли AФИ требуемым стандартам качества?
Слайд 6
Литературные источники
Узнайте о своем AФИ,используя:
Руководства / серии /
книги – в том числе:
(Аналитические) Параметры лекарственных субстанций и
вспомогательных веществ — [eds: Florey / Brittain – 31 том]
The Merck Index (по структуре, свойствам)
Pharmaceutical Codex (12е издание) (“старые” AФИ)
Журналы через поисковые системы, в том числе Международные фармацевтические, химические, аналитические «абстракты» и интернет
Фармакопейные монографии (действующие)
Структурный анализ и стереохимия
Слайд 7
Примеры информации об AФИ, представленной в фармакопеях и
некоторых руководствах
Таблицы на следующих страницах демонстрируют, какие фармакопеи и
какие руководства содержат информацию об AФИ для лечения:
TB (6th EOI), ВИЧ/СПИД (6th EOI) and Малярия (4th EOI)
Аббревиатуры:
BP British Pharmacopoeia: 2004, addendum 2005
EP European Pharmacopoeia: 5.12 (July 2005)
US USP 28, second supplement (August 2005)
Int International Pharmacopoeia: 3rd edition (4th due)
MI Merck Index (13th ed, 2001)
JP Japanese Pharmacopoeia (web; December 2001)
Apr Analytical Profiles of Drug Substances and
Excipients to vol. 31 (name of series changed twice)
Cod Pharmaceutical Codex (12th ed, 1994) (“old APIs)
Слайд 8
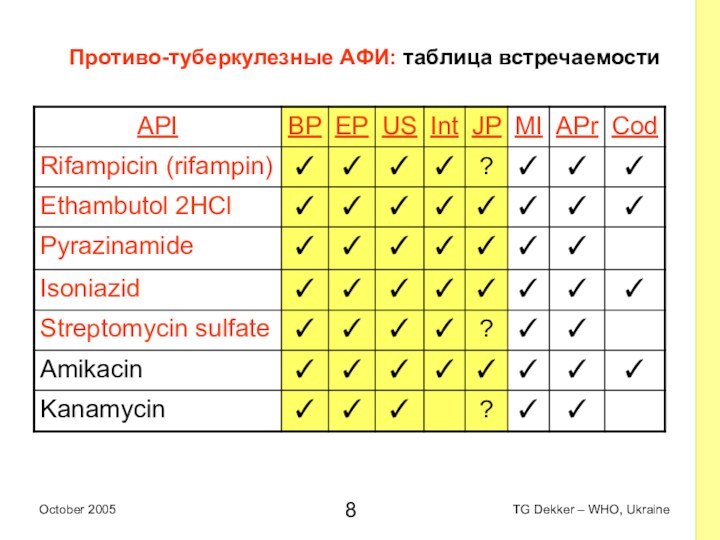
Противо-туберкулезные AФИ: таблица встречаемости
Слайд 9
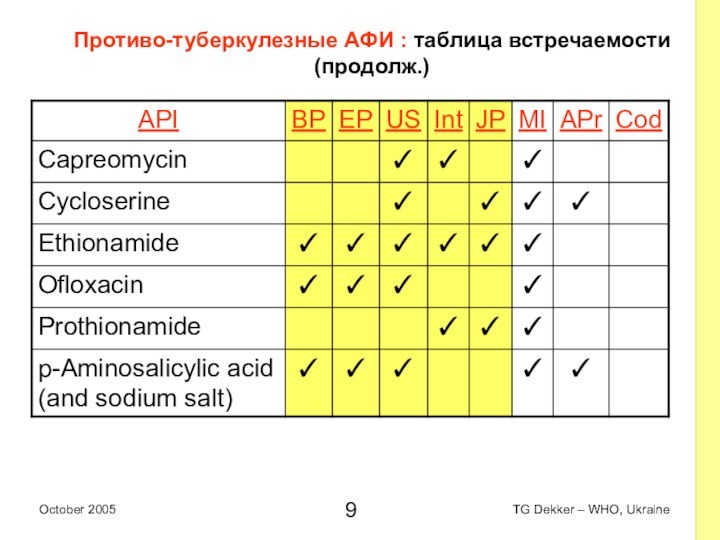
Противо-туберкулезные AФИ : таблица встречаемости (продолж.)
Слайд 10
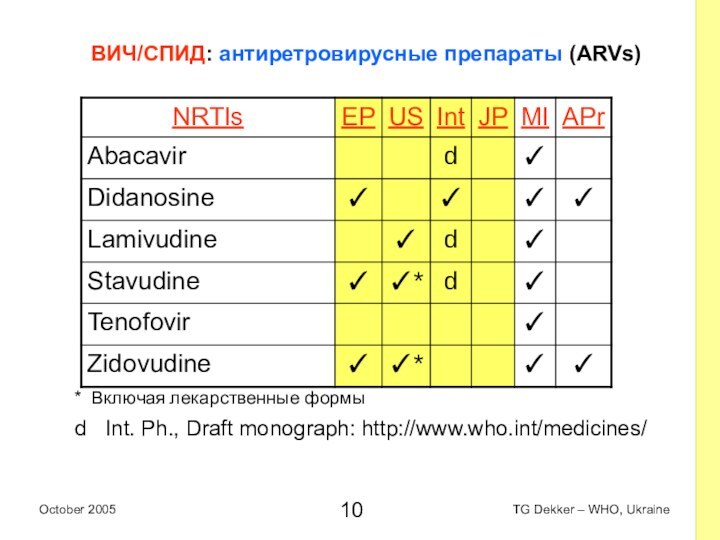
ВИЧ/СПИД: антиретровирусные препараты (ARVs)
* Включая лекарственные формы
d
Int. Ph., Draft monograph: http://www.who.int/medicines/
Слайд 11
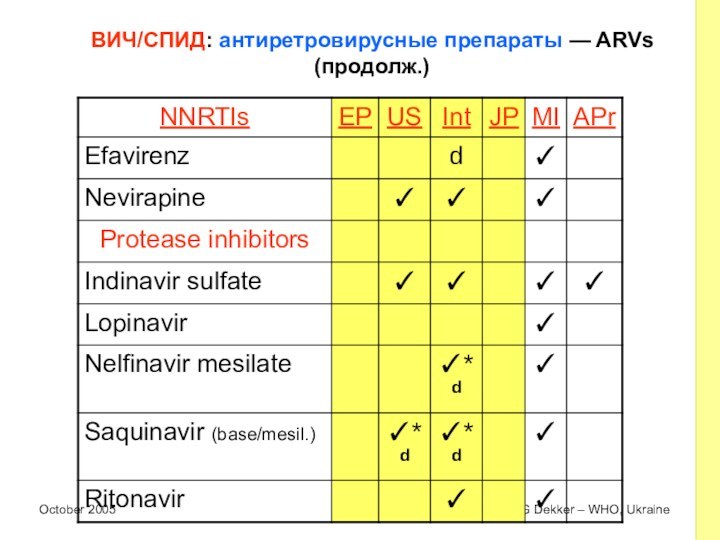
ВИЧ/СПИД: антиретровирусные препараты — ARVs (продолж.)
Слайд 12
ВИЧ/СПИД : противомикробные AФИ
Для большинства AФИ перечисленных ниже
фармакотерапевтических направлений существуют монографии:
Антибактериальные и противотуберкулезные средства (кроме MTB)
(8)
Антипротозойные и противогрибковые средства (9)
Противовирусные средства (2)
Противоопухолевые средства (4)
Лекарственные средства, применяемые для паллиативного лечения онкологических заболеваний (6)
Итого 29 AФИ
Слайд 13
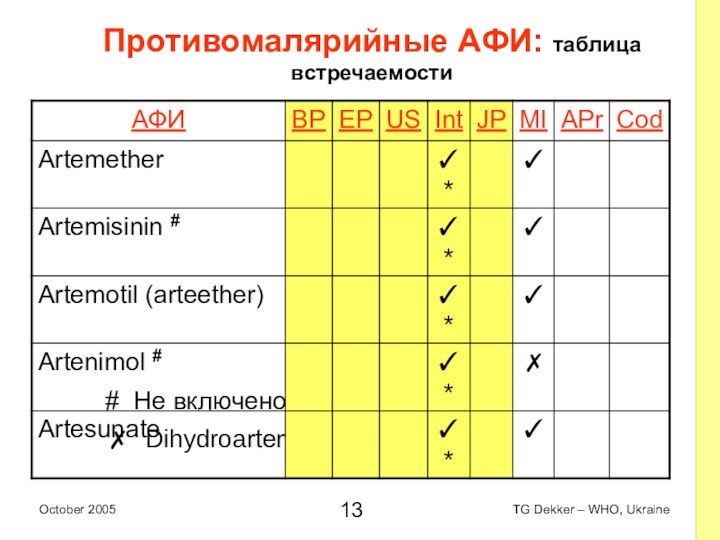
Противомалярийные AФИ: таблица встречаемости
# Не включено в 4ую
EOI
✗ Dihydroartemisinin (Artemisinin)
Слайд 14
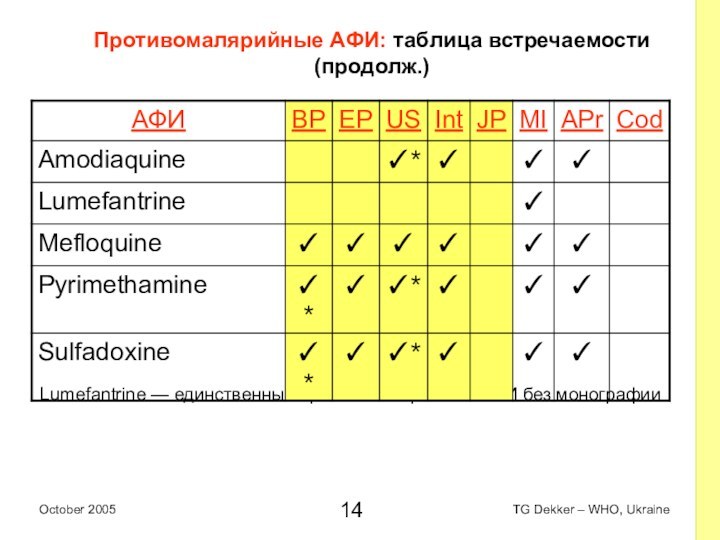
Противомалярийные AФИ: таблица встречаемости (продолж.)
Lumefantrine — единственный противомалярийный
AФИ без монографии
Слайд 15
Монографии AФИ : резюме
Противо-туберкулезные AФИ
Монографии для всех APIs
ВИЧ/СПИД:
AРВ AФИ:
Монографии для 9 из 13 внесенных в перечень
EOI
Разрабатываются быстрыми темпами, недостающие ожидаются в ближайшее время
Противомалярийные AФИ
Монографии для всех AФИ группы artemisinin
Монографии для всех остальных, включенных в перечень EOI
кроме lumefantrine
Слайд 16
Данные научной литературы и структура
AФИ органического происхождения имеют
уникальную химическую структуру и стереохимическое строение
От этой структуры, находящейся
в твердом/жидком агрегатном состоянии, главным образом зависят химические и физические свойства AФИ
Слайд 17
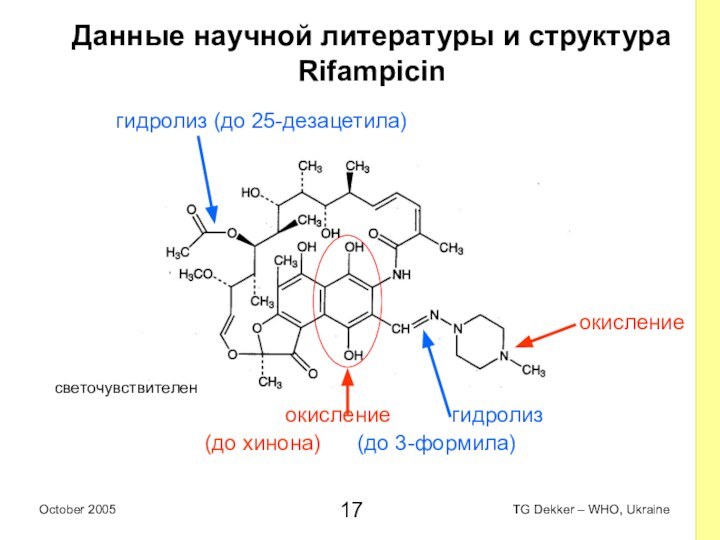
Данные научной литературы и структура
Rifampicin
гидролиз (дo 25-дезацетила)
(до N-оксида)
окисление гидролиз
(до хинона) (до 3-формила)
окисление
светочувствителен
Слайд 18
Данные научной литературы и структура
Rifampicin (дискуссия -
1)
Окисление
Группа гидрохинона
Полный распад AФИ (до рифампицина хинона)
Усиление растворимости в
щелочной среде
Третичные амины
Подвергаются постепенному окислению (до оксида азота)
Усиление растворимости в кислой среде
Окисление активизируется в присутствии
Ионов металлов
При низком pH
Слайд 19
Данные научной литературы и структура
Rifampicin (дискуссия -
2)
Гидролиз
Группа гидрохинона (имина)
Гидролиз до 3-formyl rifampycin
Группа 25-acetyl (эфир)
Гидролиз до
25-desacetyl rifampicin (в меньшей степени)
Светочувствительность
По причине конъюгации внутри молекул (ненасыщенность)
Хранение исходных материалов и продукции in bulk (BP/Ph.Eur.):
Хранить в герметичных контейнерах, в защищенном от света месте при температуре ≤ 25ºC
Слайд 20
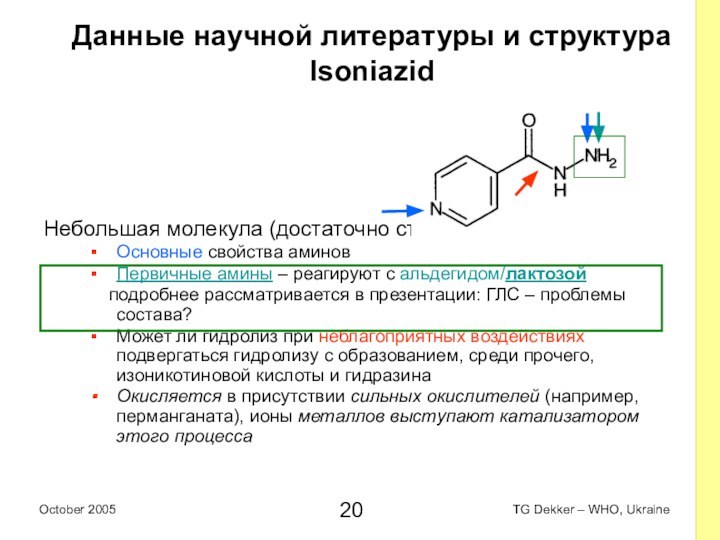
Данные научной литературы и структура
Isoniazid
Небольшая молекула (достаточно
стабильная)
Основные свойства аминов
Первичные амины – реагируют с альдегидом/лактозой
подробнее рассматривается
в презентации: ГЛС – проблемы состава?
Может ли гидролиз при неблагоприятных воздействиях подвергаться гидролизу с образованием, среди прочего, изоникотиновой кислоты и гидразина
Окисляется в присутствии сильных окислителей (например, перманганата), ионы металлов выступают катализатором этого процесса
Слайд 21
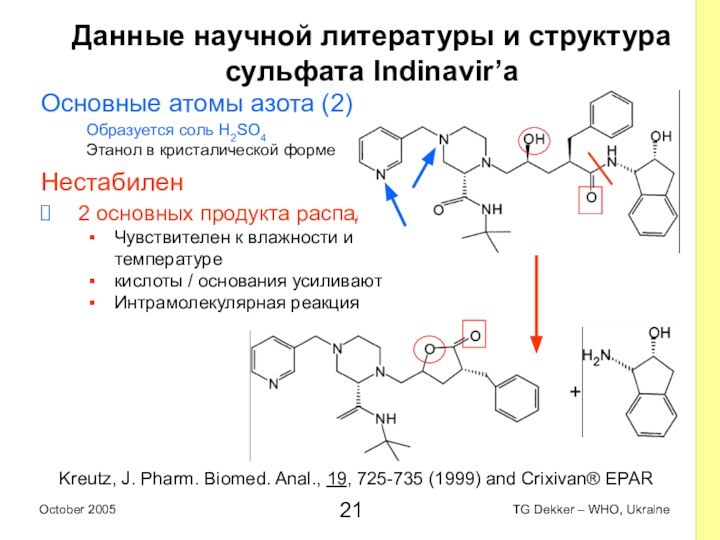
Данные научной литературы и структура
сульфата Indinavir’a
Основные
атомы азота (2)
Образуется соль H2SO4
Этанол в кристалической форме
Нестабилен
2 основных
продукта распада
Чувствителен к влажности и температуре
кислоты / основания усиливают
Интрамолекулярная реакция
+
Kreutz, J. Pharm. Biomed. Anal., 19, 725-735 (1999) and Crixivan® EPAR
Слайд 22
Оформление ссылок на библиографию
Приводимые в досье литературные данные
всегда следует снабжать:
Четко приведенными ссылками на цитируемые источники, например:
Devani, M.B., Shishoo, C.J., Doshi, K.J. & Patel, H.B. Kinetic studies of the interaction between isoniazid and reducing sugars. Journal of Pharmaceutical Sciences, 74, 427-432 (1985)
Hassan, M.M.A., Jado, A.I., & Zubair, M.U. Aminosalicylic acid. In Florey, K., ed. Analytical Profiles of Drug Substances, vol. 10. New York: Academic Press, p. 1-27 (1981)
Фотокопиями публикаций или отдельных страниц
Слайд 23
Раздел 2. Требования к досье для активного фармацевтического
ингредиента (AФИ)
Опирается на раздел 2 руководства:
«Пособие по предоставлению документации
для преквалификации готовых многоисточниковых лекарственных препаратов (ГЛС), используемых для лечения пациентов с ВИЧ/СПИДом, малярией и туберкулезом»
(Основное руководство, настольная книга)
Со стр. 4/50
Слайд 24
AФИ: содержание досье 4/50
2.1 Номенклатура (INN, систематизация etc.)
4/50 ■
2.2 Свойства (структура, стереохимия etc.) 4/50 **
2.3 Линия
производства 5/50 ■
2.4 Метод синтеза (примеси etc.) 5/50 **
2.5 Спецификации 6/50 **
2.6 Система герметизации контейнеров (упаковка) 7/50 ■
2.7 Испытания стабильности 8/50
■ См. руководства – не дискутабельно
** Требования могут отличаться в зависимости от того, когда AФИ был описан в официально принятой фармакопее
Слайд 25
Раздел 2. Формат информации об AФИ 4/50
Один из
следующих вариантов (по предпочтительности)
Валидный CEP (Европейский сертификат стабильности)
Со всеми
приложениями
Предоставить информацию, которую не охватывает CEP, в отношении пунктов 2.2.2, 2.5.2, 2.6 и 2.7
Открытая часть DMF (Мастер файл лекарств)
Составляет производитель AФИ
DMF должен содержать все виды информации, перечисленные в разделе 2
Заполнение раздела 2 (заявителем)
Подача подписанного производителем AФИ подтверждения того, что синтез и надлежащая очистка проведены в соответствии с описанием в досье
Слайд 26
2.2 Свойства AФИ 4/50
Три сценария:
2.2.1 AФИ, не
описанные в BP, Ph., JP,
Ph.Eur., или
USP (non-compendial — «нефармакопейные»))
2.2.2 API, описанные в BP, Int.Ph., JP, Ph.Eur.,
или USP («фармакопейные»)
2.2.3 Литературные данные (важно)
См. примеры, приводимые в остальных презентациях
В ходе 6го Обновления EOI все противо-TБ AФИ были отнесены к категории 2.2.2
В ходе 6го Обновления EOI некоторые AРВ AФИ были отнесены к категории 2.2.2
Слайд 27
2.2.1 Свойства некомпендиальных AФИ 4/50
Доказательства структурного/стереохимического соответствия
Рентгенструктурное исследование
монокристаллов (достаточно) или
Спектрометрические данные (IR, 1H & 13C NMR,
MS, etc.): обеспечение качества удостоверяют копии спектральных и табличных данных с:
Распределением по структуре
или
Сопоставлением полученных спектрометрических данных об AФИ с данными научной литературы, предпочтительно касающимися инновационного препарата (в таблетированной форме!!). Очень рекомендуется!
Физико-химические свойства, как рассмотрено в параграфе 2.2.2 (следующий слайд)
Слайд 28
2.2.2 Свойства КОМПЕНДИАЛЬНЫХ AФИ 4/50
Физико-химические и другие соответствующие
свойства, в частности
Растворимость в воде (зависит от pH), других
растворителях: эфире, этаноле, ацетоне дихлорметане
pKa, коэффициент диффузного разделения
Существование/отсутствие полиморфизма и псевдополиморфизма, например, сольватов (при помощи XRPD, DSC, инфракрасный спектр)
Рассматривается в презентации по ГЛС (rifampicin)
Рассматривается ниже (nevirapine)
Гигроскопичность: см. презентацию ГЛС
Ethambutol hydrochloride в таблетках 4 сочетаний фиксированной дозы FDC
Размер частиц
Слайд 29
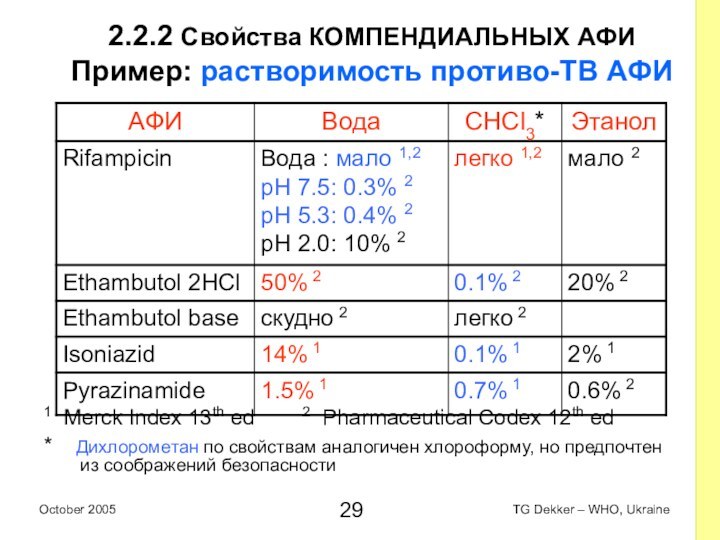
2.2.2 Свойства КОМПЕНДИАЛЬНЫХ AФИ
Пример: растворимость противо-ТВ AФИ
1
Merck Index 13th ed 2 Pharmaceutical Codex
12th ed
* Дихлорометан по свойствам аналогичен хлороформу, но предпочтен из соображений безопасности
Слайд 30
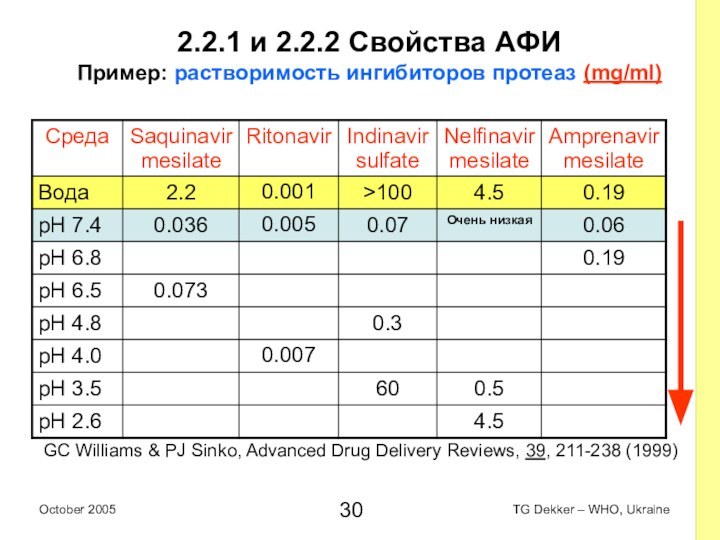
2.2.1 и 2.2.2 Свойства AФИ
Пример: растворимость ингибиторов протеаз
(mg/ml)
GC Williams & PJ Sinko, Advanced Drug Delivery Reviews,
39, 211-238 (1999)
Слайд 31
2.2.2 Свойства ФАРМАКОПЕЙНЫХ AФИ
Псевдополиморфизм невирапина (1)
Монография невирапина
(безводный гемигидрат) в Int. Ph. (цитата)
Проводите исследования, как описано
в: «Спектрофотометрия в инфракрасном поле».
Для безводных веществ инфракрасный (IR) спектр поглощения соответствует спектру, полученному у безводного невирапина RS или референтному спектру безводного невирапина
Для гемигидрата, IR спектр поглощения демонстрирует параметры острой поглощательности около 3503 cm−1; после нагревания исследуемого вещества на протяжении часа до темепературы 140°C и последующего охлаждения, IR спектр поглощения соответствует спектру, полученному у безводного невирапина RS или референтному спектру безводного невирапина
Слайд 32
2.2.2 Свойства КОМПЕНДИАЛЬНЫХ AФИ
Псевдополиморфизм невирапина (2)
Интерпретация результатов
этого IR-идентифицируемого исследования:
Невирапина ангидрид (один анализ)
IR спектр невирапина ангидрида
RS
Невирапина гемигидрат (два теста, соответствует обоим)
IR спектр генерирует сигнал на уровне 3503 cm-1 (вода) и
Под влиянием высокой температуры гемигидрат преобразуется в форму ангидрида
IR спектр невирапина ангидрида RS
- ½H20
Nevirapine, ½H20 ————> Nevirapine
жар
При комнатной температуре реакция необратима
Слайд 33
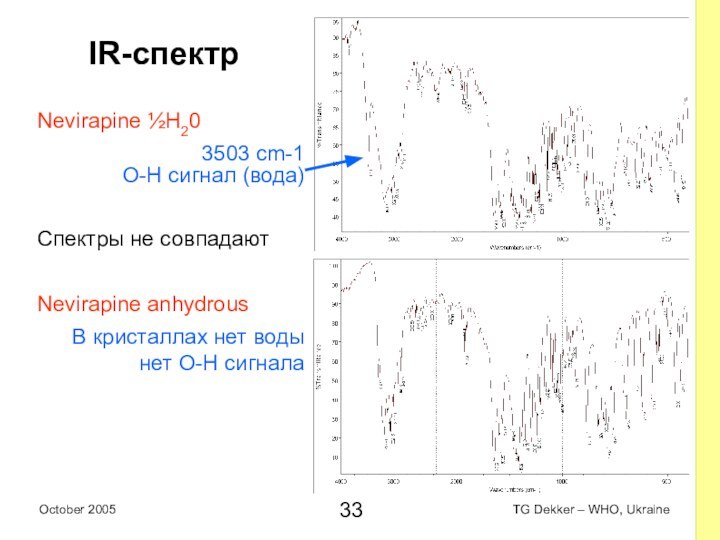
IR-спектр
Nevirapine ½H20
3503 cm-1
O-H сигнал (вода)
Спектры не совпадают
Nevirapine anhydrous
В
кристаллах нет воды
нет O-H сигнала
Слайд 34
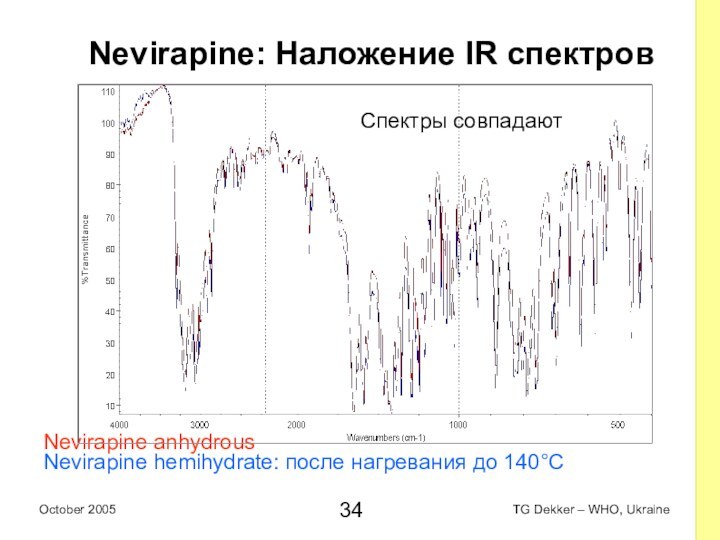
Nevirapine: Наложение IR спектров
Nevirapine anhydrous
Nevirapine hemihydrate: после
нагревания до 140°C
Спектры совпадают
Слайд 35
2.4 Путь (пути) синтеза 5/50
Три сценария:
2.4.1 AФИ
не описан в BP, Int.Ph., JP,
Ph.Eur.,
или USP (нефармакопейный AФИ)
2.4.2 Спецификации исходных материалов и промежуточных веществ, используемых при синтезе некомпендиальных APIs
2.4.3 AФИ опсиан в BP, Int.Ph., JP, Ph.Eur.,
или USP (фармакопейный AФИ)
Слайд 36
2.4 Путь (пути) синтеза (продолж.)
Требования: синтез должен
Закончится правильной
структурой, стереохимией и кристаллической формой и объемом (если нужно)
Проходить
под надлежащим контролем и быть провалидирован (GMP)
Создать АФИ, которое соответствует принятым стандартам качества в том числе с учетом пределов примесей (oрганических, неoрганических, остаточные растворители)
Информация, требуемая для синтеза AФИ, может зависеть от того,
Имеется ли валидный сертификат CEP? – если да, то информации о синтезе не требуется
Описано ли качество рассматриваемого AФИ в монографии официальной фармакопеи?
Отсутствие официальной монографии для контроля качества:
Требуется детальная информация
Слайд 37
2.4.1 Синтез некомпендиальных AФИ 5/50
Струйная диаграмма процесса синтеза
В
том числе структура и стереохимические параметры исходных материалов и
промежуточныхз веществ, реактивов, катализаторов, растворителей
Полное описание каждого шага / процесса, в том числе:
Условия протекания реакции (контроль времени, температуры, влажности etc.)
Количества реактивов/растворителей
Мощность производственной линии
Очистка промежуточных веществ
Метод завершающей очистки API / кристаллизация / растворитель(и)
Переработка (процесс должен быть обоснован и валидирован)
Контроль процесса
Валидация принципиально важных этапов, например, стерильных процедур
Рассмотрение (возможного) содержания примесей
Органических, остаточных растворителей и катализаторов/неорганических
Слайд 38
2.4.2 Спецификации исходных материалов и промежуточных веществ, используемых
при синтезе (2.4.1) 5/50
Наличие спецификаций для
Исходных материалов и промежуточных
веществ (если таковые выделяются)
Реактивов, растворителей и катализаторов
Растворители Класса 1 использовать не следует (Международная конференция по гармонизации Q3C)
Бензол, кальция тетрахлорид, 1,2-дихлорэтан,
1,1-дихлорэтан & 1,1,1-трихлорэтан
Наличие заявления об использовании / неиспользовании материалов животного или человеческого происхождения (агенты губчатой энцефаллопатии)
Риск передачи возбудителя губчатой энцефалопатии у животных (ВОЗ TRS 908, Приложение 1 or EMEA/410/01 Rev.2)
Зачем? Чтобы минимизировать содержание примесей (вопрос безопасности)
Слайд 39
2.4.2 Синтез фармакопейных AФИ
Наличие
Схемы пути синтеза
упрощенный
линейний график и качественное описание метода производства, в том
числе наименования реактивов, растворителей и катализаторов
Данные о прохождении завершающих стадий синтеза
В том числе процесс очистки
В случае подачи действующего CEP
Информации не требуется (упрощенный линейний график – по желанию)
Слайд 40
2.5 Спецификации AФИ 6/50
2.5.1 AФИ, не описанные в
BP, Int.Ph., JP,
Ph.Eur., или USP (нефармакопейные
AФИ)
2.5.2 API, описанные в BP, Int.Ph., JP,
Ph.Eur., или USP (фармакопейные AФИ)
Общие замечания
AФИ имеет только один набор спецификаций, применимых при выпуске и в ходе повторных исследований
FPP имеет два набора спецификаций – относительно выпуска и срока годности
Слайд 41
2.5.1 Спецификации: нефармакопейные AФИ
ICH Q6A (новые AФИ
и препараты) – например:
Наличие обоснований для предложенных спецификаций
Характеристики и
ограничительные факторы очистки
Синтез и распад согласно ICH Q3A(R)
Растворители в остатке согласно ICH Q3C
Аналитические методы и валидация
Подготовка и определение/спецификация адекватности первичных и вторичных (рабочих) стандартов, согласно Сертификату анализов CoAs
Валидация Сертификата анализов не менее чем на 2 сериях
Слайд 42
2.5.1 Спецификации: нефармакопейные AФИ
Типичные наборы спецификаций
Внешний вид
/описание
Идентификация (как минимум один способ определения, например инфракрасная фотометрия)
Содержание
влаги (или пределы обнаружения: влага + остаточные расворители)
Примеси
Органические вещества, возникающие в процессе синтеза и распада
Неидентифицируемые и
Общее содержание органических примесей
Неорганические примеси, в т ом числе катализаторы
Остаточный растворитель(и)
Оценка
Дополнительные параметры для отдельных AФИ
Например, размер частиц, полиморфизм, микробиологические показатели
Слайд 43
2.5.2 Спецификации: фармакопейные AФИ
Всегда применяется действующая монография
Дополнительные необходимые спецификации, не включенные в монографию:
размер частиц и
полиморфизм
Примеси, образующиеся на отдельных стадиях синтеза
Спецификации к ним могут быть довнесены в монографию
Остаточные растворители (специфичные для каждой стадии)
Наличие действующих сертификатов анализа не менее чем для двух серий
CEP обычно содержит указания на проведение дополнительных к содержащимся в монографии исследований
В том числе, остаточных растворителей примесей
Слайд 44
2.7 Исследования стабильности 8/50
2.7.1 Исследования AФИ в экстремальных
условиях (ускоренный распад) помогают:
определить возможные метаболиты и пути их
образования
установить стабильность молекулы
подтвердить специфичность метода оценки стабильности
Диодно-матричное определение пикового уровня очистки API!
2.7.2 Испытания стабильности (требуется законом) для предоставления доказательных данных:
Каким образом качество AФИ изменяется во времени
Под влиянием различных внешних факторов
- в т.ч. температуры, влажности, света; и
установления протяженности дополнительных исследований AФИ
Выработки рекомендаций относительно условий складского хранения
ICH Q1A(R2)
Слайд 45
2.7.1 Исследования в экстремальных условиях (ускоренный распад) 8/50
Примерные
условия для экстремальных реакций
Условия должны
частично (на 10-30%) разлагать AФИ
на продукты первичного распада
Условия можно менять, с тем чтобы достичь требуемого уровня распада
** Температура не должна приближаться к точке плавления более чем на 10°C
Слайд 46
2.7.1 Исследования в экстремальных условиях (ускоренный распад). Научная
литература
Данные научной литературы и/или CEP
в поддержку «и/или»
с целью
восполнения недостающих экспериментальных данных
Примеры данных научной литературы
Rifampicin (предыдущие слайды)
Окисление, гидролиз
Indinavir sulfate (предыдущие слайды)
Интрамолекулярные реакции – нагрев, влажность, кислота, щелочь
Efavirenz (следующий слайд)
Гидролиз – pH-зависимый
Слайд 47
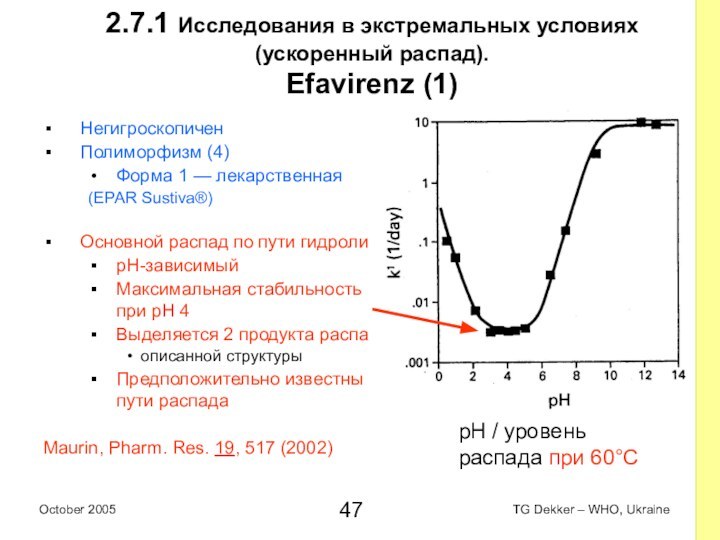
2.7.1 Исследования в экстремальных условиях (ускоренный распад).
Efavirenz
(1)
Негигроскопичен
Полиморфизм (4)
Форма 1 — лекарственная
(EPAR Sustiva®)
Основной распад по пути
гидролиза
pH-зависимый
Максимальная стабильность при pH 4
Выделяется 2 продукта распада
описанной структуры
Предположительно известны пути распада
Maurin, Pharm. Res. 19, 517 (2002)
pH / уровень распада при 60°C
Слайд 48
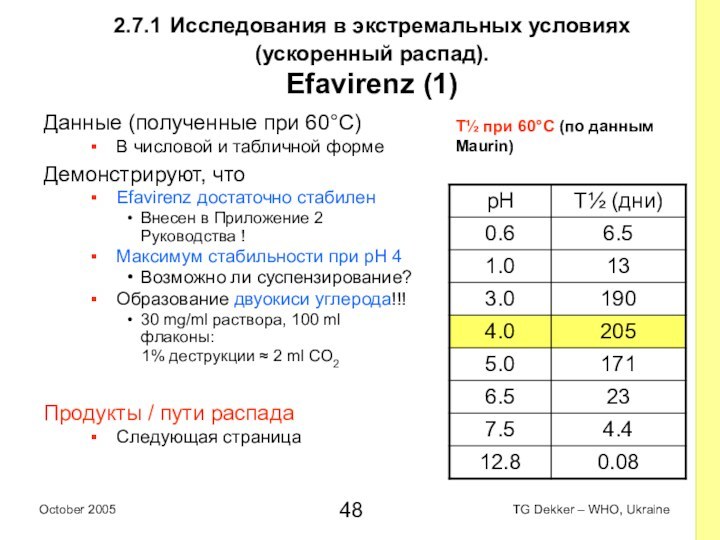
2.7.1 Исследования в экстремальных условиях (ускоренный распад).
Efavirenz
(1)
Данные (полученные при 60°C)
В числовой и табличной форме
Демонстрируют, что
Efavirenz
достаточно стабилен
Внесен в Приложение 2 Руководства !
Максимум стабильности при pH 4
Возможно ли суспензирование?
Образование двуокиси углерода!!!
30 mg/ml раствора, 100 ml флаконы:
1% деструкции ≈ 2 ml CO2
Продукты / пути распада
Следующая страница
T½ при 60°C (по данным
Maurin)
Слайд 49
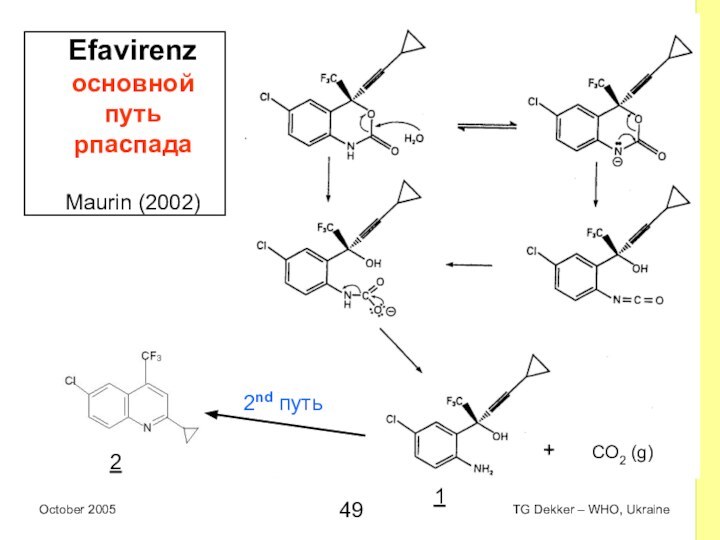
Efavirenz основной путь рпаспада
Maurin (2002)
2nd путь
1
2
+
CO2 (g)