- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химиопрепараты и антибиотики
Содержание
- 2. Основная цель применения антибактериальных агентов – подавление
- 3. П. Эрлих - основоположник химиотерапии. 1885 г
- 4. Микробиологические основы химиотерапии и химиопрофилактики инфекционных болезнейХимиотерапия
- 5. 1932 г.- Г. Домагк синтезировал первый сульфаниламидный
- 6. АНТИБИОТИКИ- низкомолекулярные продукты метаболизма микроорганизмов, подавляющие в
- 7. По химическому составу:1. Беталактамные – азот содержащие
- 8. 5. Левомицетин – синтетическое вещество, идентичное природному
- 9. Препараты 2–го ряда:Флоримицин, циклосерин, рифампицин.11. Фосфомицины –
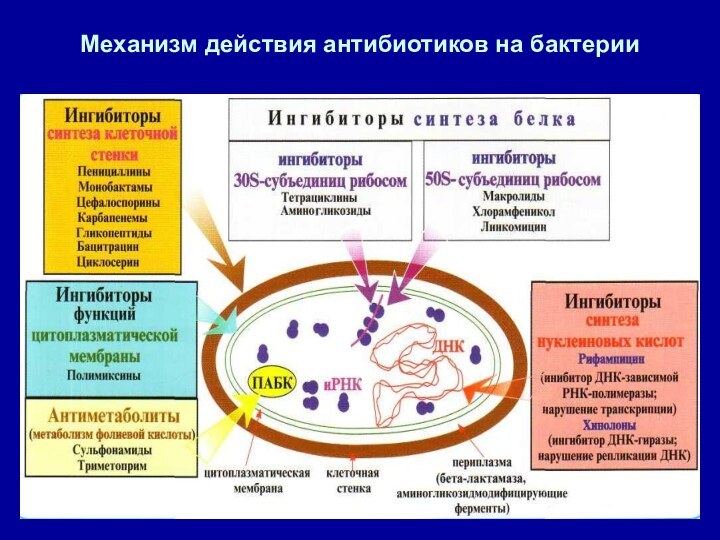
- 10. Механизм действия антибиотиков на бактерии
- 11. Механизм действия бета-лактамов (БЛА)Молекула БЛАпреодолевает внешнюю мембрану
- 12. Механизм действия антибиотиков● Все антибиотики обладают избирательностью
- 13. Ингибиторы синтеза белка на уровне рибосом 70S●
- 14. Механизм действия фторхинолонов- избирательно подавляет бактериальные ферменты
- 16. Лекарственная устойчивость бактерийСуществуют два типа: естественная (природная)
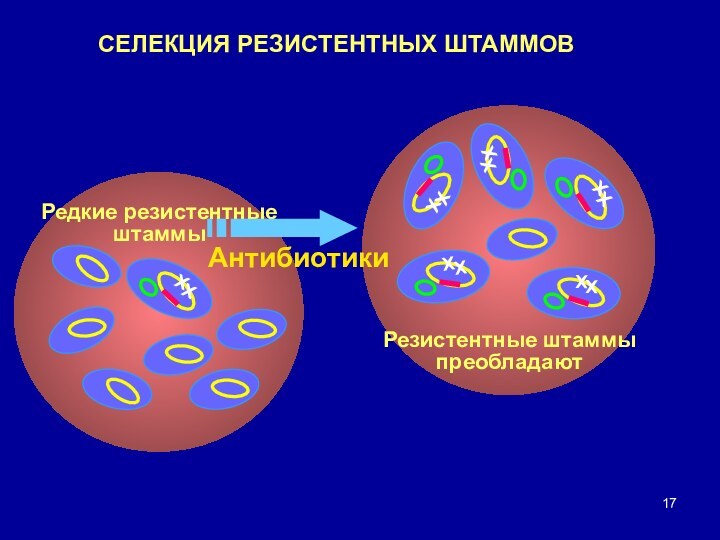
- 17. СЕЛЕКЦИЯ РЕЗИСТЕНТНЫХ ШТАММОВ
- 18. Причины лекарственной устойчивости:– массовое, бесконтрольное применение антибиотиков;– неоправданное назначение
- 19. БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ РЕЗИСТЕНТНОСТИ1. Разрушение молекулы антибиотика
- 20. 3. Изменение структуры чувствительных к действию антибиотиков
- 21. Механизм устойчивости к изониазиду у М. tuberculosis.
- 22. Возможности и пути образования лекарственной устойчивости у
- 23. ПРИЧИНЫ ОШИБОК ИРИ АНТИБИОТИКОТЕРАПИИ:- назначение антибиотиков без достаточных
- 24. Показания к определению чувствительности к антибиотикамОбязательному исследованию
- 25. Показания к определению чувствительности к антибиотикамОпределение чувствительности
- 26. Показания к определению чувствительности к антибиотикамПрямое определение
- 27. Методы определения чувствительности к антибиотикамМетоды серийных разведенийв
- 28. Питательные среды«Для оценки чувствительности необходимо использовать только
- 29. Приготовление суспензии исследуемых микроорганизмов (инокулюма) Главное требование:
- 30. Приготовление суспензии исследуемых микроорганизмов (инокулюма) Главное требование:
- 31. Определение чувствительности к антибиотикам диско-диффузионным методом
- 32. Диспенсоры для наложения дисков
- 33. МЕТОДЫ СЕРИЙНЫХ РАЗВЕДЕНИЙ
- 34. Приготовление серийных разведений в жидкой среде
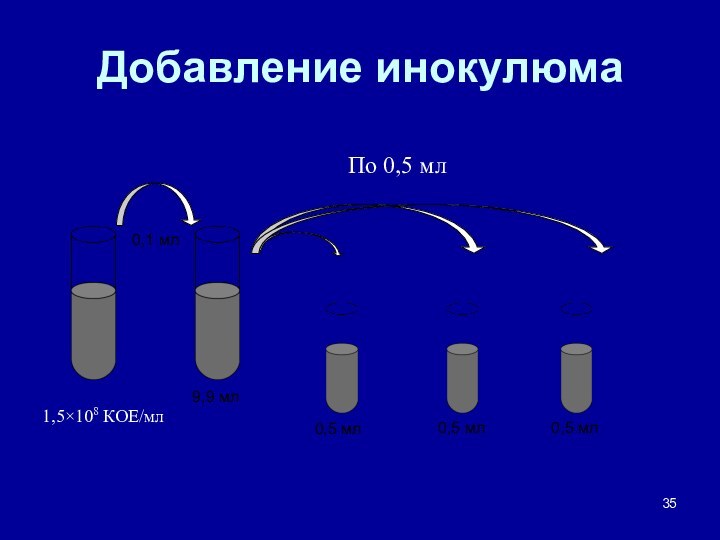
- 35. Добавление инокулюма 9,9 мл 0,1 мл0,5 мл0,5 мл0,5 мл1,5×108 КОЕ/млПо 0,5 мл
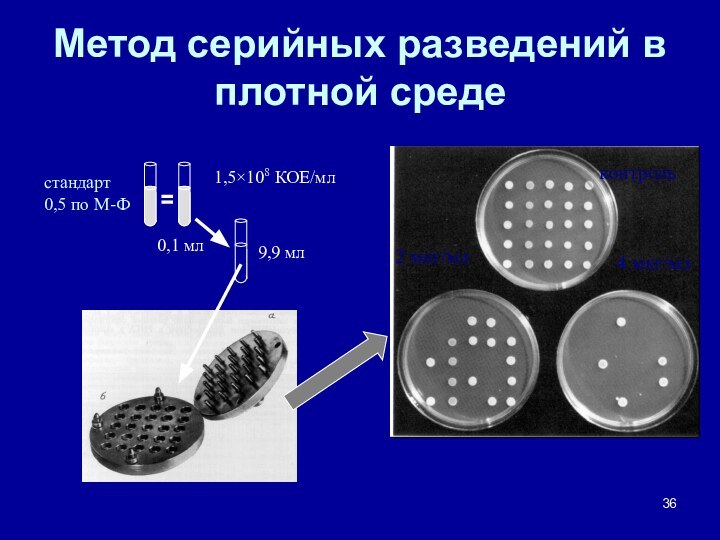
- 36. Метод серийных разведений в плотной среде1,5×108 КОЕ/млстандарт 0,5 по М-Ф9,9 мл0,1 мл
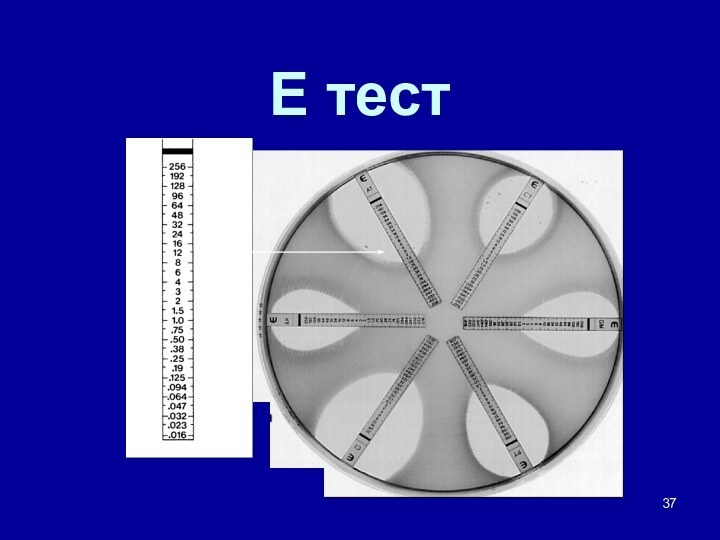
- 37. Е тест
- 38. АНТИБАКТЕРИАЛЬНЫЕ ПРЕПАРАТЫПенициллины:1. Природные пениииллиныБензилпенициллинФеноксиметилпенициллин (для орального применения)
- 39. Цефамицины: цефокситин, цефотетан Монобактамы: азтреонам Карбапенемы: имипенем,
- 40. ПРОТИВОТУБЕРКУЛЕЗНЫЕ ПРЕПАРАТЫ1-я группа — препараты высокой эффективности:
- 41. Общие принципы антибактериальной терапииПрепараты не следует применять
- 42. Общие принципы антибактериальной терапииПри состояниях, угрожающих жизни
- 43. Общие принципы антибактериальной терапииПри невозможности определения чувствительности
- 44. Общие принципыЛечение бактериальных инфекций следует проводить интенсивно.
- 45. Скачать презентацию
- 46. Похожие презентации







































Слайд 3
П. Эрлих - основоположник химиотерапии. 1885 г –
сформулировал теорию специфических рецепторных взаимодействий. В химиотерапии и иммунологии
признана как рецепторная теория.Он синтезировал сальварсан и неосальварсан (OH- группа усиливала спирохетоцидное NH2- группа- трипаноцидные свойства).
Слайд 4
Микробиологические основы химиотерапии и химиопрофилактики инфекционных болезней
Химиотерапия -
лечение бактериальных, вирусных, грибковых или протозойных заболеваний с помощью
лекарственных средств, избирательно подавляющих развитие и размножение инфекционных агентов.Химиопрофилактика - использование лекарственных средств для профилактики.
Общие признаки химиотерапевтических средств:
● Отсутствие заметного токсического действия на организм. Устанавливается по химиотерапевтическому индексу-
● Избирательное действие на микроорганизмы определяется антимикробным спектром:
бактериостатическое действие- подавление роста и размножения микроорганизмов;
бактериоцидное - гибель
Слайд 5
1932 г.- Г. Домагк синтезировал первый сульфаниламидный препарат
– стрептоцид (Германия).
Антиметаболиты- имеют структурное сходство с важнейшими метаболитами.
Включение метаболита в эти реакции приводит к задержке размножения и последующей гибели.Сульфаниламиды - имеют структурное сходство с пароаминобензойной кислотой (ПАБК), блокируется синтез жизненно важных ростовых веществ - фолиевой, дегидрофолиевой кислот. Избирательное действие на бактерии, синтезирующие фолиевую кислоту (норсульфазол, сульфазин).
Действуют на Гр- и Гр+.
Слайд 6
АНТИБИОТИКИ
- низкомолекулярные продукты метаболизма микроорганизмов, подавляющие в малых
концентрациях рост других микроорганизмов (не превышают несколько дальтон), а
также относят:- продукты, полученные химической модификацией природных антибиотиков или других продуктов метаболизма микроорганизмов.
- продукты, полученные в результате микробиологической трансформации синтетических соединений.
Классифицируют:
- по происхождению
- химическому составу
- механизмам ингибирующего действия
- антимикробным спектрам
- частоте возникновения антибиотико-резистентных форм
По происхождению образуют:
--актиномицеты
- грибы
Бактерии
Растения
Клетки животных, человека
Слайд 7
По химическому составу:
1. Беталактамные – азот содержащие гетероциклические
соединения с бета-лактамным кольцом:
А-природные - пенициллины
Б-полусинтетические(метицилин)
В-цефалоспорины-цефалоридин
2. Тетрациклин и его
полусинтетические производные: окситетрациклин, хлортетрациклин, морфоциклин.Состоят из 4-х конденсированных бензольных колец с разными радикалами.
3. Аминогликозиды включают группы:
А. Стрептомицина, состоящие из 3-х частей: стрептидина, стрептозы,
N-метилглюкозамина.
Б. Аминогликозидные, содержащие дезоксистрептамин (неомицин, мономицин, канамицин, гентамицин – олигосахаридной природы).
4. Макролиды – содержащие макроциклическое лактонное кольцо (эритромицин, олеандомицин).
Слайд 8
5. Левомицетин – синтетическое вещество, идентичное природному хлорамфениколу
с составом: нитрофенил, дихлорацетамин, пропандиол.
6. Рифампицины: природный – рифамицин;
полусинтетический – рифампицин. Имеют макроциклическое кольцо (+BC).7. Полиеновые – нистатин, леворин, амфотерицин. С двойными связями (CH=CH).
8. Гликопептиды – высокомолекулярные соединения, содержащие углеводы и аминокислоты: ванкомиции, ристомицин, линкомиции.
9. Стрептомицины – активны против возбудителя туберкулёза и Гр – бактерий
противотуберкулёзные – производные парааминосалициловой кислоты (паск), изоникотиновой кислоты (изониазиды)- это препараты первого ряда.
Слайд 9
Препараты 2–го ряда:
Флоримицин, циклосерин, рифампицин.
11. Фосфомицины – из
группы фосфоновой кислоты: фосфомицин ( действие на Гр –
бактерицидно).12. Неприродные соединения – фторхинолоны: циклофлоксацин, нефлоксацин, офлоксацин.
Слайд 11
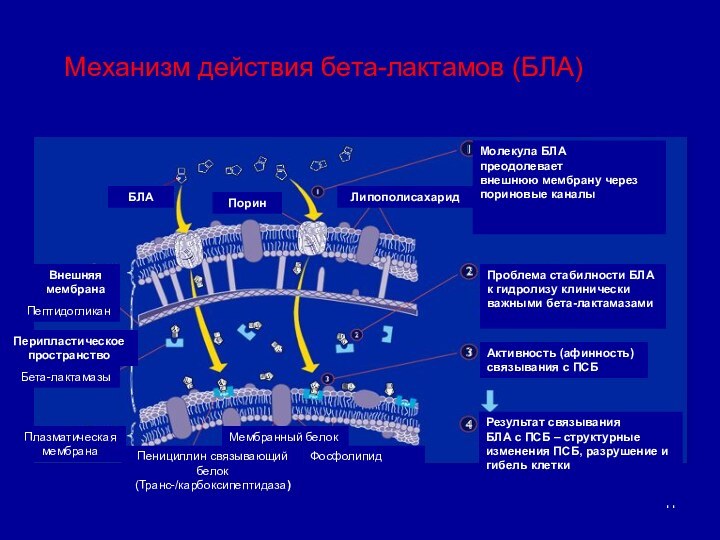
Механизм действия бета-лактамов (БЛА)
Молекула БЛА
преодолевает
внешнюю мембрану через
пориновые
каналы
Проблема стабилности БЛА к гидролизу клинически
важными бета-лактамазами
Активность (афинность)
связывания с ПСБ
Результат связывания
БЛА с ПСБ – структурные
изменения ПСБ, разрушение и гибель клетки
Липополисахарид
Порин
БЛА
Внешняя
мембрана
Пептидогликан
Перипластическое
пространство
Бета-лактамазы
Плазматическая
мембрана
Мембранный белок
Пенициллин связывающий белок
(Транс-/карбоксипептидаза)
Фосфолипид
Слайд 12
Механизм действия антибиотиков
● Все антибиотики обладают избирательностью действия.
● Относительная безвредность для человека определяется тем, что они
специфически подавляют метаболические процессы в микробной клетке, которые отсутствуют в эукариотной клетке. Ингибиторы синтеза пептидогликанов
- снижают активность промежуточных предшественников синтеза клеточной стенки (бацитрацин, фосфомицин, циклосерин, ванкомицин, ристомицин).
Вызывают бактерицидный эффект (кроме циклосерина).
Ингибиторы сборки и пространственного расположения молекул пептидокликана - это бета-лактамные антибиотики (пенициллины, цефалоспорины).
Мишенью являются транспептидазы, которые завершают синтез пептидогликана. Транспептидазы - это белки-ферменты в цитоплазматической мембране.
Бета-лактамы различаются по степени сродства к ферментам, которые получили название пенициллинсвязываюших белков.
Биологический эффект бета-лактамных антибиотиков - от бактериостатического до бактерицидного (литического).
Слайд 13
Ингибиторы синтеза белка на уровне рибосом 70S
● Тетрациклины
блокируют связывание аа-тРНК на А-участке рибосомы 70S.
● Хлорамфеникол
подавляет пептидилтрансферазную реакцию. ● Стрептомицины препятствуют превращению инициаторного комплекса в функционально активную рибосому.
● Эритромицин блокирует реакцию транслокации.
● Пуромицин, присоединяясь к растущему концу синтезируемой полипептидной цепи, вызывает преждевременное отделение ее от рибосомы.
Слайд 14
Механизм действия фторхинолонов
- избирательно подавляет бактериальные ферменты ДНК-гиразы,
участвующих в репликации ДНК.
● Фторхинолоны связываются со специфическими
участками ДНК, которые создаются воздействием ДНК-гиразы, и подавляют ее активность.Рифампицины угнетают активность ДНК
- зависимых РНК-полимераз, вследствие чего у бактерий подавляются процессы транскрипции.
Активность противоопухолевых
антибиотиков
связана с тем, что они либо являются ингибитором синтеза ДНК (брунеомицин), либо подавляют активность ДНК в системе ДНК-зависимой РНК-полимеразы, т. е. блокируют транскрипцию (антрациклины, актиномицины, оливомицин).
Слайд 16
Лекарственная устойчивость бактерий
Существуют два типа: естественная (природная) и
приобретенная.
● Естественная лекарственная устойчивость является видовым признаком и не
зависит от первичного контакта с данным антибиотиком (в ее основе нет никаких специфических механизмов). Недоступность мишени для данного антибиотика обусловлена слабой проницаемостью клеточной стенки и цитоплазматической мембраны. Низкая проницаемость к нескольким антибиотикам обусловливает полирезистентность этих бактерий.
● Приобретенная лекарственная устойчивость возникает только в результате изменения ее генома (хромосомный и плазмидный).
Варианты генетических изменений:
1. Мутация в генах бактериальной хромосомы, вследствие чего продукт атакуемого гена перестает быть мишенью для данного антибиотика. Происходит изменение структуры белка, либо он становится недоступным для антибиотика.
2. Устойчивость к антибиотику или сразу к нескольким благодаря приобретению дополнительных генов, носителями которых являются R-плазмиды.
● Приобретая устойчивость к антибиотику, бактерии получают наивыгоднейшие преимущества: благодаря селективному давлению антибиотиков происходитвытеснение чувствительных к ним штаммов, а устойчивые выживают и играют главную роль в эпидемиологии данного заболевания.
Слайд 18
Причины лекарственной устойчивости:
– массовое, бесконтрольное применение антибиотиков;
– неоправданное назначение антибиотиков;
назначение антибиотиков без определения чувствительности к ним;
– миграция
в микро6ных популяциях R-плазмид;– использование антибиотиков в качестве продуктов питания;
– высокая адаптивность микробов к изменяющимся условиям
среды обитания.
Слайд 19
БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ РЕЗИСТЕНТНОСТИ
1. Разрушение молекулы антибиотика -
бета-лактамазы, разрушая структуру пенициллинов и цефалоспоринов (бета-лактамным антибиотикам)
2.
Модификация структуры молекулы антибиотика. Гены, содержащиеся в R-плазмидах, кодируют белки, которые вызывают различные модификации молекул антибиотика путем их ацетилирования, фосфорилирования или аденилирования. В результате - утрачивается ее биологическая активность. Инактивируются: аминогликозиды, макролиды, хлорамфеникол, клиндамицин.Существуют семейства генов, определяющих инактивацию антибиотика даже по одному из указанных выше механизмов (среди клинических штаммов грам+ и грам--- бактерий обнаружены различные изоферменты аминогликозидфострансфераз, -ацетилтрансфераз и -аденилтрансфераз, которые обеспечивают устойчивость бактерий к различным спектрам аминогликозидных антибиотиков.
Слайд 20 3. Изменение структуры чувствительных к действию антибиотиков мишеней.
Изменение структуры белков рибосом 70S - в основе устойчивости
к стрептомицину, аминогликозидам, макролидам, тетрациклинам. Изменение структуры бактериальных гираз в результате мутации приводит к формированию устойчивости к хинолонам;РНК-полимераз - к рифампицину;
пенициллинсвязывающих белков (транспептидаз) - к бета-лактамам.
4. Образование бактериями «обходного» пути метаболизма для биосинтеза белка-мишени, который оказывается нечувствительным к данному химиопрепарату - к сульфаниламидным препаратам.
5. Формирование механизма активного выведения из клетки антибиотика, в результате чего он не успевает достичь своей мишени (один из вариантов устойчивости к тетрациклинам).
Слайд 21 Механизм устойчивости к изониазиду у М. tuberculosis. Действие
изониазида на туберкулезную палочку зависит от наличия плазмиды, в
составе которой имеется ген, продукт которого превращает неактивный изониазид в активную форму, разрушающий бактериальную клетку. Утрата этого гена обусловливает устойчивость М. tuberculosis к изониазиду.Механизмы формирования устойчивости к бета-лактамным антибиотикам: слабая проницаемость наружной мембраны клеточной стенки грамотрицательных бактерий, обеспечивающая природную устойчивость;
изменение структуры пенициллинсвязывающих белков в результате мутаций, которое приводит к утрате их сродства к антибиотику; продукция бета-лактамаз, разрушающих антибиотик.
Механизмы устойчивости и к тетрациклинам: - устойчивость, определяемая выносом тетрациклина из клетки белком цитоплазматической мембраны;
- устойчивость, определяемая изменением структуры белка-мишени рибосом:
- устойчивость, определяемая модификацией тетрациклина в неактивную форму.
Слайд 22
Возможности и пути образования лекарственной устойчивости у бактерий
Устойчивость,
возникающая как следствие мутации - не играет основную роль.
Основная роль принадлежит генам, которые содержатся в R-плазмидах. Такой генофонд образуется за счет генов, имеющихся у продуцентов антибиотиков. Каждый из них защищен от синтезируемого им антибиотика. Сколько бы ни было в природе антибиотиков, против каждого из них должен быть и ген самозащиты.
В природе, особенно в почве, а также в кишечнике человека и животных микроорганизмы сосуществуют в столь тесных взаимоотношениях, что это обеспечивает им постоянную возможность обмена генетическим материалом (конъюгации).
Слайд 23
ПРИЧИНЫ ОШИБОК ИРИ АНТИБИОТИКОТЕРАПИИ:
- назначение антибиотиков без достаточных клинических
и
лабораторных показаний;
- неправильный выбор антибиотиков
(например, при сепсисе назначают бактериостатические препараты);
- назначение антибиотика без определения чувствительности к ним
выделенных микробов;
назначение низких доз антибиотиков и др.
ОСЛОЖНЕНИЯ И ПОБОЧНЫЕ ДЕЙСТВИЯ АНТИБИОТИКОВ:
- аллергия (зуд, покраснение, астма, анафилактический шок),
для предупреждения ставят кожные пробы, под язык;
- токсическое действие: на печень, почки, органы кроветворения,
слух, ЖКТ, нервную систему (стрептомицин - на слух,
тетрациклин на печень, левомицетин на кpоветворные органы);
- иммунодепрессивное действие: нарушение формирования
иммунитета, нарушение антителообразования приводит к
рецидивам, повторным заболеваниям;
- тератогенное действие тетрациклин - уродство плода;
- феномен Герца-Геймера (реакция обострения) - интоксикация,
вызванная эндотоксином, выделяющимся при массовой гибели
грамотpицательных бактерий;
- дисбактериоз; .
- формирование антибиотикоустойчивости y возбудителей болезни
Слайд 24
Показания к определению чувствительности к антибиотикам
Обязательному исследованию на
чувствительность к АБП подлежат все микроорганизмы, выделенные из первично
стерильных жидкостей, органов и тканей человека. В осталь-ных случаях оценке чувствительнос-ти должна предшествовать оценка клинической значимости выделен-ного микроорганизма.МУК 4.12.1890-04
Слайд 25
Показания к определению чувствительности к антибиотикам
Определение чувствительности выделенного
штамма микроорга-низма показано, если уровень его устойчивости к АБП
не может быть предсказан на основании данных идентификации или вероятной таксономической принадлежности микроорганизма.МУК 4.12.1890-04
Слайд 26
Показания к определению чувствительности к антибиотикам
Прямое определение чувствительности
с использованием клинического материала (без выделения чистой культуры) возможно
только в исключительных случаях при условии подтверждения однородности культуры и высокой степени обсемененности при окраске по Граму, причем исследование следует повторить после выделения чистой культуры микроорганизма.МУК 4.12.1890-04
Слайд 27
Методы определения чувствительности к антибиотикам
Методы серийных разведений
в жидкой
среде
в плотной среде
пограничным значениям (breakpoints)
Диффузионные методы
диско-диффузионный (Kirby-Bauer Disk-Diffusion
Method) Е-тест
Слайд 28
Питательные среды
«Для оценки чувствительности необходимо использовать только специально
предназначенные для этой цели среды, по своим характеристикам удовлетворяющие
требованиям приведенным в разделе 5. Внутрилабораторный контроль качества среды необходимо проводить при использовании всех известных коммерчески доступных питательных сред (Мюллера-Хинтон, Изосенситест, АГВ и др.) независимо от их производителя»
Слайд 29
Приготовление суспензии исследуемых микроорганизмов (инокулюма)
Главное требование:
концентрация 1,5×108
КОЕ/мл, что при визуальном контроле соответствует стандарту мутности 0,5
по МакФарланду
Слайд 30
Приготовление суспензии исследуемых микроорганизмов (инокулюма)
Главное требование:
концентрация 1,5×108
КОЕ/мл, что при визуальном контроле соответствует стандарту мутности 0,5
по МакФарланду
Слайд 31
Определение чувствительности к антибиотикам
диско-диффузионным методом
После
посева культуры бактерий газоном, диск с антибиотиком наносится на
поверхность питательной среды В результате диффузии антибиотика из диска рост чувствительного возбудителя подавляется (зона задержки роста). Метод стандартизован только для «быстрорастущих» микроорганизмов, образующих сплошной рост на плотной питательной среде (в виде «газона») через 18-20 часов инкубации.Синегнойная палочка (Pseudomonas aeaiginosa) природою устойчива ко многим антибиотикам. Для лечения инфекций, вызванных Р. aeruginosa, применяют бета-лактамные антибиотики, аминогликозиды и хинолоны.
Слайд 38
АНТИБАКТЕРИАЛЬНЫЕ ПРЕПАРАТЫ
Пенициллины:
1. Природные пениииллины
Бензилпенициллин
Феноксиметилпенициллин (для орального применения)
2.
Полусинтетические пениииллины
Устойчивые к пенициллиназам: клоксациллин, оксациллин, метициллин
Карбоксипенициллины: карбенициллин, тикарциллин
Уреидопенициллины:
антисинегнойные — азлоциллин, пиперациллинАминопенициллины: ампициллин, амоксициллин
Комбинированные препараты, содержащие ингибиторы бета-лактамаз: амоксициллин+клавулановая кислота,
ампициллин+сульбактам, пиперациллин+тазобактам,
тикарциллин+ клавулановая кислота
Цефалоспорины:
1-е поколение: цефалотин, цефазолин, цефалексин, цефаклор, цефадроксил
2-е поколение: цефуроксим, цефметазол, цефотиам, цефамандол, цефокситин
3-е поколение: цефотаксим, цефтриаксон, цефтазидим, цефтизоксим, цефиксим
4-е поколение: цефпиром, цефепим
Слайд 39 Цефамицины: цефокситин, цефотетан Монобактамы: азтреонам Карбапенемы: имипенем, меропенем
Гликопептиды: ванкомицин, тейкопланин Полимиксины: полимиксин В, полимиксин Е (колистин)
Макролиды:
эритромицин, азитромицин, кларитромицин, спирамицин, олеандомицинТетрациклины: тетрациклин, доксициклин, окситетрациклин
Аминогликозиды: стрептомицин, гентамицин, амикацин, тобрамицин, канамицин
Анзамицины: рифамицин, рифампицин, рифабутин
Хинолоны: налидиксовая кислота, пипемидиевая кислота
Фторхинолоны: офлоксацин, ципрофлоксацин, норфлоксацин, пефлоксацин
Сульфаниламиды*: сульфадимидин, сульфадиметоксин, сульфаметоксазол
Нитрофураны: фурагин, фуразолидон, нитрофурантоин Нитроимидазолы: метронидазол, тинидазол, орнидазол
Производные хиноксолина: диоксидин, хиноксидин
Линкозамиды: линкомицин, клиндамицин
Пиримидины: триметоприм*, пириметамин
Амфениколы: хлорамфеникол (левомицетин) *Ко-тримоксазол (сульфаметоксазол стриметопримом)
Слайд 40
ПРОТИВОТУБЕРКУЛЕЗНЫЕ ПРЕПАРАТЫ
1-я группа — препараты высокой эффективности: изониазид,
рифампицин
2-я
группа — препараты средней эффективности:
стрептомицин, канамицин, флоримицин, циклосерин,
этамбутол, этионамид,
протионамид3-я группа - препараты низкой эффективности: ПАСК, тиоацетазон
ПРОТИВОГРИБКОВЫЕ ПРЕПАРАТЫ
Полиеновые антибиотики: нистатин, амфотерицин В, леворин
Азолы (имидазолы, триазолы): клотримазол, кетоконазол,
миконазол, флуконазол
Аллиламины: тербинафин (ламизил)
Другие: гризеофульвин, флуцитозин (фторцитозин)
Пентамидин, ко-тримоксазол (при пневмоцистозе)
ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ
Амантадин, ремантадин, ацикловир, фамцикловир, ганцикловир, валацикловир, видарабин, идоксуридин, трифторидин, рибавирин, фоскарнет, зидовудин (азидотимидин), диданозин