Слайд 2
Популяционно-статистический метод используется для изучения:
а) частоты генов в
популяции, включая частоту наследственных болезней;
б) закономерности мутационного процесса;
в)
роли наследственности и среды в возникновении болезней с наследственной предрасположенностью;
г) влияния наследственных и средовых факторов в создании фенотипического полиморфизма человека по многим признакам и др.
Слайд 3
Популяционно-статистический метод
Использование популяционно-статистического метода включает
-правильный
выбор популяции,
- сбор материала,
- статистический анализ полученных результатов.
Слайд 4
В основе метода лежит закономерность, установленная в 1908
г. английским математиком Годфри Харди и немецким врачом Вильгельмом
Вайнбергом для идеальной популяции. Обнаруженная ими закономерность получила название закона Харди - Вайнберга.
Godfrey Hardy
Wilhelm Weinberg
(из http://bioquest.org)
Слайд 5
Идеальная популяция
Для идеальной популяции характерны следующие черты: большая
численность, свободное скрещивание (панмиксия) организмов, отсутствие отбора и мутационного
процесса, отсутствие миграций в популяцию и из нее.
Слайд 6
закон Харди-Вайнберга
основной смысл закона Харди-Вайнберга состоит в том,
что в идеальной популяции соотношение частоты доминантных гомозигот (АА),
гетерозигот (Аа) и рецессивных гомозигот (аа) сохраняется постоянным из поколения в поколение, если никакие эволюционные факторы не нарушают это равновесие.
Слайд 7
закон Харди-Вайнберга
В реальных популяциях человека соотношение численности генотипов
в постоянно нарушается. Факторы, стимулирующие сдвиг равновесия: родственные браки,
мутации, дрейф генов, отбор, миграции и другие.
Закон Харди-Вайнберга является основой при рассмотрении генетических преобразований, происходящих в естественных и искусственно созданных популяциях растений, животных и человека.
Слайд 8
закон Харди-Вайнберга
Соотношение численности разных генотипов и фенотипов в
панмиктической популяции определяется по формуле бинома Ньютона:
(p +
q)2 = p2 + 2pq + q2; (P+q) = 1,
где р — частота доминантного аллеля A, q — частота рецессивного аллеля а, р2 — частота генотипа АА (гомозигот по доминантному аллелю), q - частота генотипа аа (гомозигот но рецессивному аллелю).
Слайд 9
закон Харди-Вайнберга
Таким образом, популяционно-статистический метод дает возможность рассчитать
в популяции человека частоту нормальных и патологических генов -
гетерозигот, доминантных и рецессивных гомозигот, а также частоту нормальных и патологических фенотипов, т.е. определить генетическую структуру популяции.
Слайд 10
закон Харди-Вайнберга
Подобные расчеты широко используются в медико-генетических исследованиях
популяций. Вместе с тем следует отметить, что в малочисленных
популяциях человека закон Харди-Вайнберга не применим, т.к. статистические закономерности, на которых он основан, не имеют значения в случае малых чисел.
Слайд 11
Генетико-автоматические процессы (дрейф генов)
Важным фактором, влияющим на частоту
аллелей в малочисленных популяциях и в изолятах являются генетико-автоматические
процессы или дрейф генов. Это явление было описано в 30-хх гг. Н.П. Дубининым и Д.Д. Ромашовым (СССР) и С.Райтом и Р.Фишером (США).
Слайд 12
Генетико-автоматические процессы (дрейф генов)
Рональд Фишер
Сьюэл Райт
Николай Дубинин
Дмитрий
Ромашов
Слайд 13
Генетико-автоматические процессы (дрейф генов)
Оно выражается в случайных изменениях
частоты аллелей, не связанных с их селекционной ценностью и
действием естественного отбора.
Из-за дрейфа генов адаптивные аллели могут быть элиминированы из популяции, а менее адаптивные и даже патологические (в силу случайных причин) могут сохраниться и достигнуть высоких концентраций.
Слайд 14
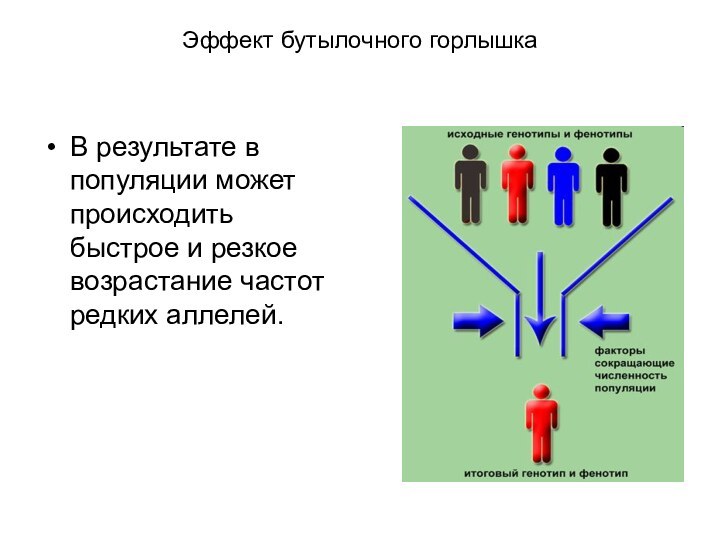
Эффект бутылочного горлышка
В результате в популяции может происходить
быстрое и резкое возрастание частот редких аллелей.
Слайд 15
Изоляты
Примером действия дрейфа генов в популяциях человека может
служить «эффект родоначальника». Он наблюдается, если структура популяции формируется
под влиянием аллелей ограниченного числа семей (эффект инбридинга). В таких популяциях нередко наблюдается высокая частота аномального гена, сохранившегося в результате случайного дрейфа генов.
Слайд 16
Типы малых популяций:
1. Изолят: численность до 1500 человек,
частота внутригрупповых браков > 90%, процент мигрантов из других
групп < 1%
2. Дем: численность 1500-4000 человек, частота внутригрупповых браков 80-90%, процент мигрантов из других групп 1-2%
Слайд 17
Изоляты
в некоторых изолятах Дагестана наблюдается высокая степень риска
заболевания шизофренией – до 5 процентов (в среднем по
миру этот показатель колеблется в пределах одного процента).
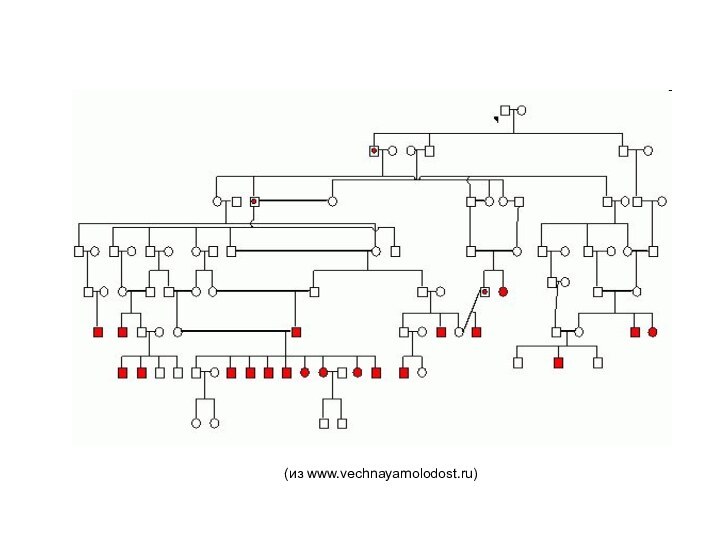
Особенно показателен пример одного высокогорного села, где проживает 700 жителей: на протяжении пяти поколений браки в нем заключались между двоюродными братьями и сестрами, в результате чего на данный момент восемь из девяти детей, проживающих в этом селе, болеют параноидальной формой шизофрении
Слайд 19
Дрейф генов
Результатом дрейфа генов является разная частота резус
отрицательных людей в Европе (14%) и в Японии (1%),
неравномерное распространение наследственных болезней по разным группам населения земного шара. Например, в некоторых популяциях Швеции широко распространен ген ювенильной амавротической идиотии, в Южной Африке — ген порфирии, в Швейцарии — ген наследственной глухоты и др.
Слайд 20
Миграции
Новые гены могут поступать в популяцию в результате
миграции (потока генов), когда особи из одной популяции перемещаются
в другую и скрещиваются с представителями данной популяции. Реальные популяции редко бывают полностью изолированными.
Слайд 21
Миграции создают поток генов
В США потомство от смешанных
браков между белыми и неграми относится к негритянскому населению.
По данным Ф. Айала и Дж. Кайгера (1988) частота аллеля, контролирующего резус-фактор у белого населения, составляет 0,028. В африканских племенах, от которых происходит современное негритянское население, частота этого аллеля равна 0,630. Предки современных негров США были вывезены из Африки 300 лет (около 10 поколений) назад. Частота аллеля у современного негритянского населения Америки составляет 0,446. Таким образом, поток генов от белого населения к негритянскому шел со скоростью 3,6 % за 1 поколение. В результате через 10 поколений доля генов африканских предков составляет сейчас 0,694 общего числа генов современного негритянского населения США. Около 30% генов американские негры унаследовали от белого населения. Очевидно, поток генов между белым и негритянским населением был значительным.
Слайд 22
Мутации
как фактор эволюции, мутации обеспечивают приток новых
аллелей в популяцию.
Накопление мутаций в генофонде приводит к
увеличению мутационного давления, что проявляется в виде генетического груза.
Слайд 23
Генетический груз
Генетический груз - насыщенность популяции
рецессивными генами, снижающими приспособленность отдельных особей к среде обитания,
по сравнению со всей популяцией.
Генетический груз в популяциях человека может иметь фенотипическое проявление (спонтанные аборты, внутриутробная гибель плода, мертворождение, генные и хромосомные болезни, пороки развития), либо не иметь проявления (гетерозиготное носительство патологических рецессивных генов).
Сегрегационный генетический груз передается из поколения в поколения
Мутационный – возникает в результате мутагенеза и зависит от степени загрязнения окружающей среды.
Слайд 24
Естественный отбор
К факторам, нарушающим постоянство генетической структуры популяций,
относится и естественный отбор, вызывающий направленное изменение генофонда путем
элиминации из популяции менее приспособленных особей или снижения их плодовитости.
Слайд 25
Естественный отбор
В современных популяциях человека действие естественного отбора
снижено, отбор утратил видообразовательную функцию, он обеспечивает стабилизацию генофонда
и поддержание генетического полиморфизма.
Слайд 26
Проявления отбора в популяциях человека:
•внутриутробная гибель плода –15%
•
мертворождение – 3%
• детская смертность – 2%
• не вступают
в брак – 20%
•бесплодные браки – 10%
Слайд 27
Цитогенетический метод
используют для изучения нормального кариотипа человека, а
также при диагностике наследственных заболеваний, связанных с геномными и
хромосомными мутациями. Кроме того, этот метод применяют при исследовании мутагенного действия различных химических веществ, пестицидов, инсектицидов, лекарственных препаратов и других мутагенов (кластогенов).
Основа метода — микроскопическое изучение хромосом человека.
Слайд 28
Цитогенетический метод
Развитие современной цитогенетики человека связано с именами
цитологов Джо Хин Тио и Альберта Левана. В 1956
г. они первыми установили, что у человека 46 (а не 48, как думали раньше) хромосом, что положило начало широкому изучению митотических и мейотических хромосом человека.
В 1959 г. французские ученые Д. Лежен, Р.Тюрпен и М. Готье установили хромосомную природу болезни Дауна. В последующие годы были описаны многие другие хромосомные синдромы, часто встречающиеся у человека.
Слайд 29
Цитогенетический метод
В 1960 г. в г. Денвере (США)
была разработана первая Международная классификация хромосом человека. В ее
основу легли размеры хромосом и положение первичной перетяжки — центромеры. Все хромосомы по форме разделены на метацентрические, субметацентрические и акроцентрические и подразделены на 7 групп, обозначенных латинскими буквами А, В, С, D, Е, F и G. Каждая пара хромосом была наделена порядковым номером от 1 до 22, выделены отдельно и поименованы латинскими буквами — X и Y половые хромосомы.
Слайд 30
Групповая идентификация метафазных хромосом человека
Слайд 31
Индивидуальная идентификация хромосом человека
В 1971 г. на IV
Пражской конференции генетиков в дополнении к Денверской классификации были
представлены методы дифференциальной окраски хромосом, благодаря которым каждая хромосома приобретает свой неповторимый рисунок, что помогает точной идентификации.
Схематическое изображение дифференциально окрашенных хромосом человека согласно международной классификации
Слайд 32
Типы дифференциальной окраски хромосом человека (G banding)
Слайд 33
Типы дифференциальной окраски хромосом человека (Q banding)
Слайд 34
Типы дифференциальной окраски хромосом человека (R banding)
Слайд 35
Типы дифференциальной окраски хромосом человека (С banding)
Слайд 36
Типы дифференциальной окраски хромосом человека (Ag banding)
Слайд 37
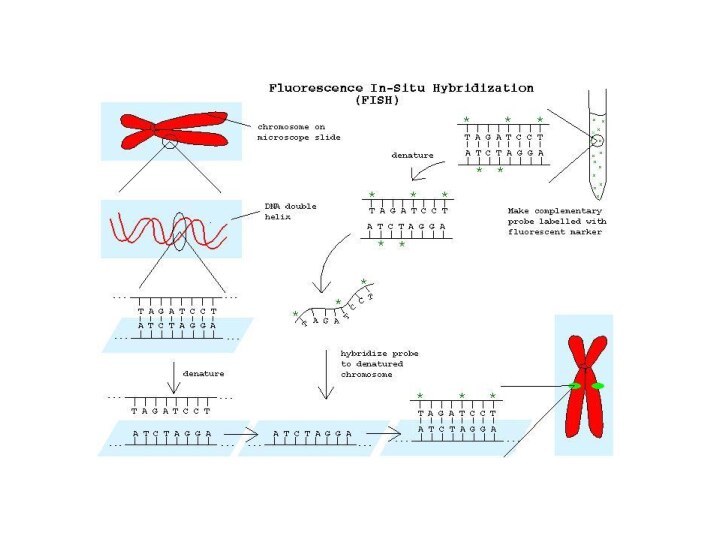
Молекулярно-цитогенетические методы
основаны на технологии флюоресцентной гибридизации in situ
(FISH). Для исследуемой хромосомы или ее участка готовят однонитевой
участок ДНК, к которому присоединяют биотин и дигоксигенин. Такой "помеченный" участок ДНК называется зондом. На микроскопическом препарате in situ денатурируют хромосомную ДНК щелочной обработкой, то есть разрывают связи между двумя цепочками ДНК. Препарат обрабатывают зондом. Так как последовательность нуклеотидов зонда и соответствующего участка исследуемой хромосомы комплементарны, то зонд присоединяется к хромосоме. В этом участке происходит ренатурация ДНК.
Слайд 38
Молекулярно-цитогенетические методы
Далее препарат обрабатывают стрептовидином (вещество, избирательно присоединяющееся
к биотину) и антидигоксигениновым антителом (избирательно присоединяется к дигоксигенину).
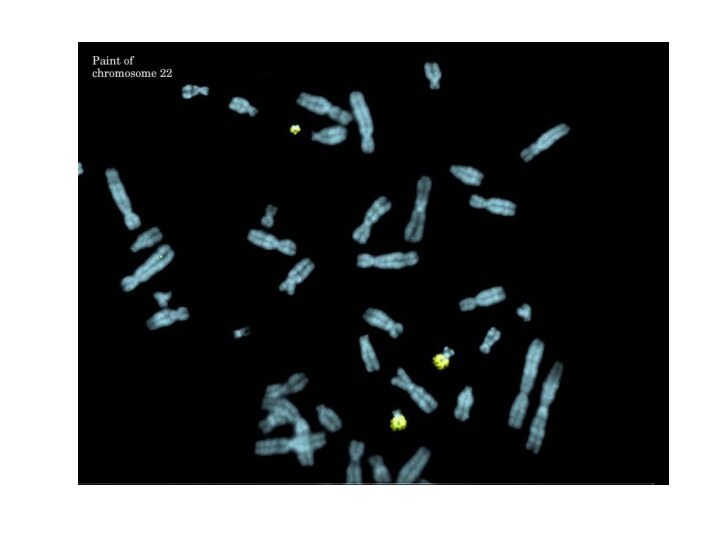
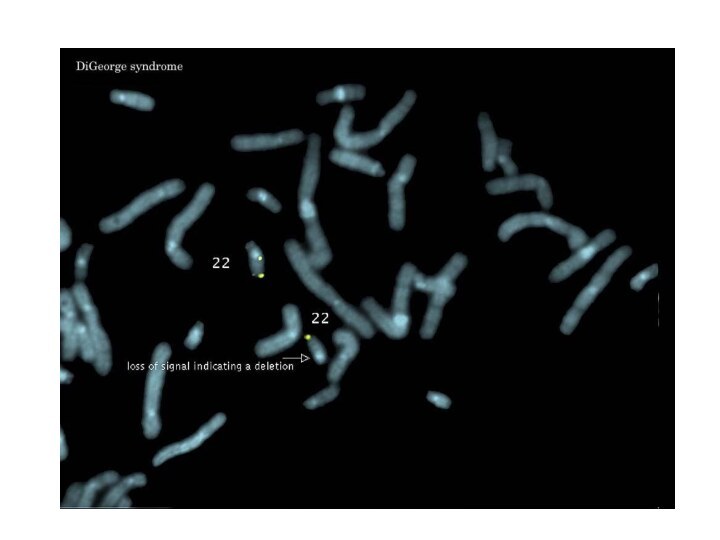
К этим веществам присоединяют флюоресцентные красители (родамин - красный цвет или флюоресцеин - зеленый цвет). В специальном люминесцентном микроскопе хорошо видны окрашенные хромосомы на фоне неокрашенных. С помощью метода FISH можно определять локализацию генов в хромосомах и все хромосомные аберрации.
Слайд 40
Молекулярно-цитогенетические методы
24-цветная FISH хромосом человека: a - метафазная
пластинка; b - pаскладка хромосом.
(из Рубцов Н. Б., Карамышева
Т. В. Вестн. ВОГиС, 2000).