Слайд 2
Учебные цели занятия
В результате проведенного лекционного занятия курсант
должен:
иметь представление:
- о фундаментальном единстве естественных наук, незавершенности естествознания
и возможности его дальнейшего развития;
-о новейших открытиях естествознания, перспективах их использования,
знать:
- основные понятия, современные теории, законы,
уметь:
использовать основные понятия, законы для решения задач.
Воспитательные цели
На занятии необходимо формировать и развивать у курсантов:
- любовь к Отечеству, гордость и ответственность за принадлежность к Вооруженным Силам Российской Федерации и их офицерскому корпусу;
- офицерскую честь и достоинство, дисциплинированность;
-общую культуру, стремление к самосовершенствованию.
Слайд 4
Основная литература
1. Коровин Н.В. Общая химия: Учебник. Для
технических направлений и специальностей вузов. – 2-е изд., испр.
и доп. - М.: Высшая школа,2000. – 558 с., ил.
2. Кривко В.М. Химия. Курс лекций. Учебное пособие.– Ейск: филиал ВВА им. Ю.А.Гагарина, 2001.–157 с., ил.
3. Кривко В.М. Руководство к лабораторным работам по химии. Учебное пособие.– Ейск: филиал ВВА им .Ю.А.Гагарина, 2003– 35с., ил.
Дополнительная литература
1. Глинка Н.Л. Общая химия. Учебное пособие для вузов. – Л.: Химия, 1979.- 720 с.
Учебные кинофильмы
55/16 – Полимеры. – М.: Киностудия МО.,30 мин.
62/16 – Процессы электролиза. – М.: Киностудия МО.,30 мин.
138/16 – Строение атома. – М.: Киностудия МО.,20 мин.
179/16 – Теория электролитической диссоциации. – М.: Киностудия МО.,20 мин.
201/16 – Основы электрохимии. – М.: Киностудия МО.,20 мин.
211/16 – Энергетика химических процессов. – М.: Киностудия МО.,20 мин.
Слайд 5
План лекции
Тема 1 . Химия и периодическая система
элементов Д.И. Менделеева
Введение
Учебные вопросы
1.1. Первые модели строения атома
1.2. Квантово-механическая
модель атома водорода
1.3. Строение многоэлектронных атомов
1.4. Периодическая система элементов Д.И. Менделеева
1.5. Периодические свойства элементов (самостоятельно)
Заключение
Слайд 6
Введение
Система подготовки инженеров
1. На младших курсах изучаются ФУНДАМЕНТАЛЬНЫЕ
НАУКИ, которые представляют собой системы знаний о наиболее общих
законах и принципах нашего мира. Это - Физика, Химия, Математика, Информатика, Теоретическая механика, Философия, Политология, Психология, Экономика, История и т.п.
2. Далее изучаются ПРИКЛАДНЫЕ НАУКИ, которые изучают действие фундаментальных законов природы в частных областях жизни, таковыми являются Механика, Сопротивление материалов, Теория механизмов и машин и т.п.
3. На старших курсах (3-й и выше) студенты приступают к изучению ОБЩЕТЕХНИЧЕСКИХ ДИСЦИПЛИН отраслевые различия здесь ещё сравнительно невелики.
4. Обучение завершается освоением СПЕЦИАЛЬНЫХ ДИСЦИПЛИН.
Слайд 7
Химия – наука, изучающая состав, строение, свойства и
превращения веществ, а также явления, сопровождающие эти превращения.
Слайд 8
Роль химия в жизни и практической деятельности:
Химия имеет
огромное значение не только для практической деятельности человека, но
и для научного понимания картины мира:
способствует развитию образного мышления;
дает знания о нежелательных химических процессах (коррозия металлов, старение полимеров);
дает знания о биологической роли химических элементов, влиянии их на организм человека и др.
Слайд 9
помогает освоению системы знаний о фундаментальных теориях, необходимых
для понимания естественнонаучной картины мира;
дает возможность овладению умениями: характеризовать
свойства веществ, химические реакции; выполнять лабораторные эксперименты; проводить расчеты по химическим формулам и уравнениям; ориентироваться и принимать решения в проблемных ситуациях, связанных с знанием химии;
помогает развитию политехнической направленности образования при изучении способов промышленного получения наиболее важных веществ;
способствует развитию познавательных интересов, интеллектуальных и творческих способностей;
воспитание убежденности в необходимости химических знаний для любого инженера, положительной роли химии в решении экологических и других проблем, стоящих перед современным обществом; понимание все возрастающей роли химии как основы современного материаловедения;
воспитание качеств личности, способствующих сознательному выбору инженерной или другой профессии.
Слайд 10
1.1. Первые модели строения атома
Модель – упрощенное и
наглядное изображение сложной системы; она воспроизводит лишь определенные, важные
для правильного понимания стороны предмета или явления; дает искусственное схематическое представление действительности.
Слайд 11
Модель Резерфорда
Суть планетарной модели строения атома (Э. Резерфорд,
1911 г.) можно свести к следующим утверждениям:
В центре атома
находится положительно заряженное ядро, занимающее ничтожно малую часть пространства внутри атома.
2.Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3.Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Слайд 12
Теория Бора
1.Электрон может вращаться вокруг ядра не по
произвольным, а только по строго определенным (стационарным) круговым орбитам.
2.При
движении по этим орбитам электрон не излучает и не поглощает энергии.
3.Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходных состояниях
Слайд 13
1.2. Квантово-механическая модель атома водорода
Квантовая теория строения атома
базируется на следующих основных положениях:
Дискретность энергии электрона.
Двойственная (корпускулярно-волновая природа
электрона).
Невозможность определения траектории электрона (принцип неопределенности).
Согласно этой теории, электроны в атоме могут иметь определенные (дискретные) значения энергии:
- энергетические уровни;
- энергетические подуровни;
- занимать определенные области в пространстве.
Слайд 14
Область пространства, в которой вероятность нахождения электрона наибольшая
(> 95%) – называется атомной орбиталью.
Поведение электрона в
атоме описывается волновым уравнением Шредингера.
Оно связывает энергию, координаты и волновую функцию. Квадрат волновой функции 2 определяет вероятность нахождения электрона в данной точке пространства.
Слайд 15
При решении уравнения Шредингера вводятся три постоянные (три
квантовых числа):
1. главное квантовое число n,
2. орбитальное
квантовое число l ,
3. магнитное квантовое число ml.
Если для атома водорода решать не Уравнение Шредингера, а более точное уравнение Дирака, то появляется еще одно квантовое число – спиновое ms,
Слайд 16
Главное квантовое число (n).
Определяет энергетический уровень электрона,
удаленность уровня от ядра, размер электронного облака.
Принимает целые
значения (n = 1, 2, 3 ...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним.
Энергетические урони разделяются на энергетические подуровни, обозначаемые буквами s, p, d, f.
Число подуровней соответствует номеру уровня, например: первый энергетический уровень имеет один подуровень, второй два и т.д.
Квантовые числа электронов
Слайд 17
2.Орбитальное квантовое число (l) характеризует геометрическую форму орбитали.
Принимает значение целых чисел от 0 до (n -
1). Общая формула: l = n-1.
Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы.
Слайд 18
3. Магнитное квантовое число (ml) характеризует положение электронной
орбитали в пространстве и принимает целочисленные значения от -l
до +l, включая 0.
Это означает, что для каждой формы орбитали существует (ml = 2l + 1) энергетически равноценных ориентации в пространстве.
Для s- орбитали (l = 0) такое положение одно и соответствует ml = 0. Сфера не может иметь разные ориентации в пространстве.
Для p- орбитали (l = 1) - три равноценные ориентации в пространстве (2l + 1 = 3): ml = -1, 0, +1.
Для d- орбитали (l = 2) - пять равноценных ориентаций в пространстве (2l + 1 = 5): ml = -2, -1, 0, +1, +2.
Для f- орбитали (l = 3) - семь равноценных ориентаций в пространстве (2l + 1 = 7):ml = -3,-2, -1, 0, +1, +2,+3.
Слайд 19
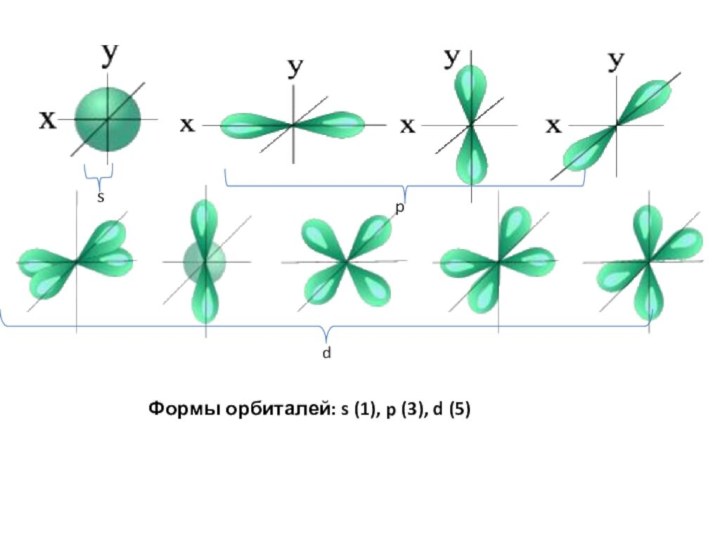
Формы орбиталей: s (1), p (3), d (5)
s
p
d
Слайд 20
Условно атомную орбиталь обозначают в виде клеточки
Соответственно для:
s – подуровня одна АО
,
p – подуровня три АО ,
d – подуровня пять АО ,
f – подуровня семь АО .
Слайд 21
1.3. Строение многоэлектронных атомов
Принципы заполнения орбиталей
1. Принцип наименьшей
энергии (Правило Клечковского): в основном состоянии каждый электрон располагается
так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду:
2. Принцип Паули: на каждой орбитали может находится один электрон или параэлектронов с противоположными спинами, поэтому каждый электрон может иметьтолько один набор из четырех квантовых чисел
3. Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
В пределах одного подуровня свободные орбитали заполняются электронами поодиночке, и только когда на каждой орбитали уже есть по одному электрону, последующие электроны образуют электронные пары с уже имеющимися на орбиталях электронами.
Слайд 22
Полная электронная формула элемента
Запись, отражающая распределение электронов в
атоме химического элемента по энергетическим уровням и подуровням, называется
электронной конфигурацией этого атома.
Например: для углерода 6C = 1s2 2s2 2p2
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденном состояниях электроны могут находиться на любых орбиталях атомов.
Слайд 23
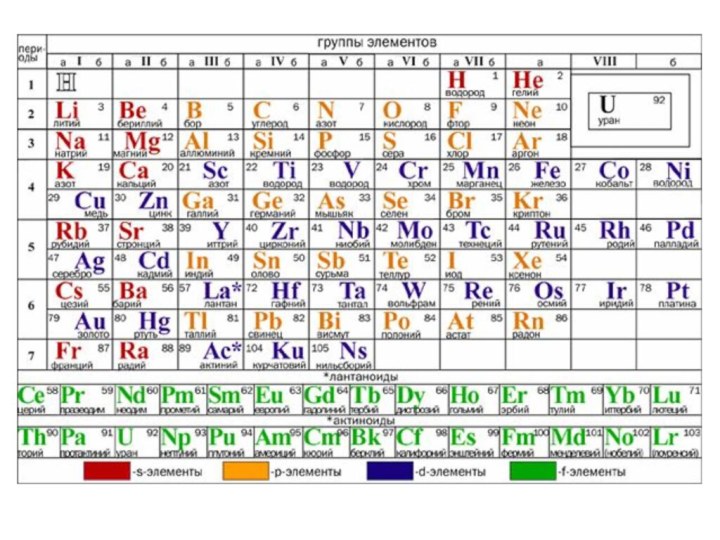
1.4. Периодическая система элементов Д. И. Менделеева
В 1869
году Д. И. Менделеев сообщил об открытии периодического закона:
свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов.
Периодическая система элементов – это графическое изображение периодического закона.
Слайд 25
Рассмотрим связь между положением элемента в периодической системе
и электронным строением его атомов.
У каждого последующего элемента
на один электрон больше, чем у предыдущего.
Слайд 26
Периодом в периодической системе называется последовательный ряд элементов,
расположенных в порядке возрастания ядер их атомов.
Номер периода
совпадает со значением главного квантового числа n внешнего энергетического уровня.
Группой называются вертикальные колонки, в которых объединены элементы, имеющие сходное электронное строение.
Номер группы, как правило, указывает число электронов, которое может участвовать в образовании химических связей.
Слайд 27
1.5. Периодические свойства элементов
Рассмотрим зависимость некоторых свойств атомов

от строения их электронных оболочек.
1) Зависимость атомных радиусов от
заряда ядра атома Z:
в пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атома. Это объясняется увеличивающимся притяжением электронов внешнего слоя к ядру по мере возрастания его заряда;
в пределах подгруппы с возрастанием заряда ядра размеры атомов увеличиваются. Это объясняется появлением нового электронного слоя.
2) Энергия ионизации (I) – энергия, необходимая для превращения нейтрального атома в положительно заряженный ион.
В периоде энергия ионизации постепенно увеличивается, так как увеличивается заряд ядра, а радиус уменьшается.
В подгруппе, с увеличением атомного номера энергия ионизации уменьшается – эта закономерность связана с возрастанием радиусов атомов. Кроме того, увеличение числа промежуточных электронных слоев, расположенных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т.е. к уменьшению его эффективного заряда.
3) Сродство к электрону (Е) – энергия, которая выделяется при присоединении электрона к атому.
Отрицательное значение Е означает, что присоединение электрона к атому требует затраты энергии. Сродство к электрону атомов металлов близко к нулю или отрицательно и тем больше, чем ближе к благородному газу расположен неметалл.
4.Электроотрицательность – способность атома к присоединению электрона при образовании химической связи.
Учитывая, что эта способность атомов зависит от типа соединений, валентного состояния элемента, эта характеристика имеет условный характер. Однако ее использование полезно для объяснения типа химических связей и свойств соединений.
Электроотрицательность определяется как полусумма энергии ионизации и сродства к электрону:
В периодах ЭО возрастает слева направо, в главных подгруппах она возрастает снизу вверх.
Слайд 28
Заключение
Таким образом, установлено, что химия – это наука
о веществах, их свойствах и превращениях друг в друга.
Химия подобно любой науке представляет собой не природный, а человеческий феномен.
В веществах нет химии. Местожительство химии не природа, а субъективный мир человека.
Теоретической основой химии является атомно-молекулярное учение и квантовая механика.
Зная квантовые числа, понятия «атомная орбиталь», принципы минимума энергии, Паули, Гунда и, основываясь на понимании периодического закона Д.И.Менделеева можно представить электронную конфигурацию любого атома и предсказать его свойства.