Слайд 2
Содержание
Положение в ПС
Строение атома
Нахождение в природе
Формы существования
Физические свойства
Химические
свойства простого вещества
Химические свойства простого вещества
Химические свойства простого вещества
Химические
свойства простого вещества
Химические свойства простого вещества
Комплексы алюминия
Получение алюминия
Применение
Слайд 3
Положение в ПС
хим. элемент III гр. ПС, ат.
н. 13, ат. м. 26,98154. В природе один стабильный изотоп 27Аl
Слайд 4
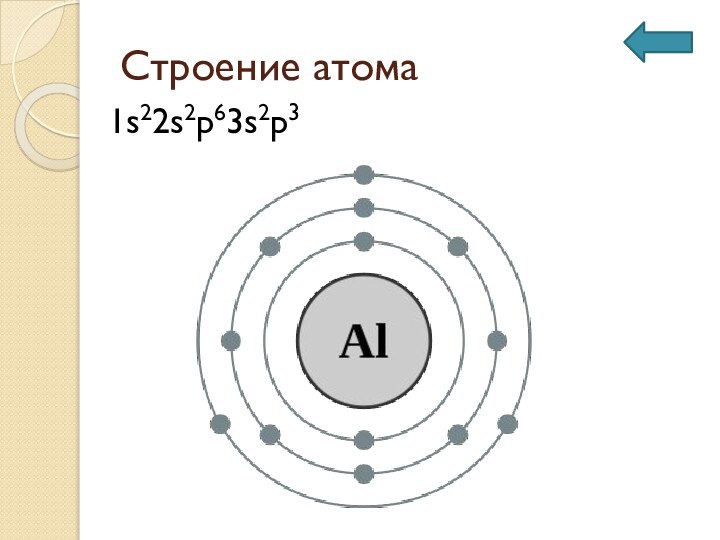
Строение атома
1s22s2p63s2p3
Слайд 5
Нахождение в природе
По распространённости в Земной коре Земли
занимает 3-е место среди элементов, уступая только кислороду и
кремнию.
Слайд 6
Формы существования в природе
Бокситы — Al2O3 · H2O (с примесями)
Нефелины —
KNa3[AlSiO4]4
Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
Каолинит — Al2O3·2SiO2 · 2H2O
Глинозёмы (смеси каолинов с песком)
Корунд (наждак) — Al2O3
Хризоберилл — BeAl2O4.
Полевые шпаты — (K,Na)2O·Al2O3·6SiO2,
Ca[Al2Si2O8]
Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
Сапфир и рубин- окрашенные формы корунда
Слайд 7
Физические свойства
Металл серебристо-белого цвета, лёгкий
Чистый алюминий- относительно мягкий
металл
высокая пластичность: прокатывается в тонкий лист и даже фольгу
Алюминий
обладает высокой электропроводностью и теплопроводностью, 65 % от электропроводности меди
обладает высокой светоотражательной способностью.
Слайд 8
Химические свойства простого вещества
После удаления защитной оксидной пленки
Al энергично взаимодействует с водой
2Al+6H2O→2Al(OH)3 +H2
С ВОДОРОДОМ Al НЕ РЕАГИРУЕТ!
Реагирует с галогенами(с Cl2 и Br2- при комнатной температуре, с F2 и I2- при нагревании) Al образует галогениды Al[Ha]3
Слайд 9
Химические свойства простого вещества
При высокой температурах Al реагирует
с S , С, N2 с образование сульфида Al2S3,
карбида Al4C3 и нитрида AlN-атомная решетка
Al ярко горит на воздухе
4Al+O2→2Al2O3+Q
Al восстанавливает из оксидов металлы и неметаллы
2Al+3SrO→Al2O3+3Sr+Q-олимпиада
4Al+3CO2→2Al2O3+3C+Q
Слайд 10
Химические свойства простого вещества
Большинство кислот растворяет Al. Соляная
кислота легко растворяет Al:
2Al + 6HCl →
2AlCl3 + 3H2
разбавленная серная-с трудом
2Al+H2SO4→Al2(SO4)3+3H2
Очень разбавленная HNO3 не взаимодействует с Al, разбавленная HNO3 растворяет Al с образованием NO, а конц.(при нагревании)-с выделением NO2:
Al+4HNO3(разб.)→Al(NO3)3+NO+2H2O
Al+6HNO3(конц.)→Al(NO3)3+3NO2+3H2O
Слайд 11
Химические свойства простого вещества
Концентрированная H2SO4 при нагревании восстанавливается
алюминием до SO2:
2Al+6H2SO4→Al2(SO4)3+3SO2+6H2O
Холодные концентрированные H2SO4
и HNO3
пассивируют Al-оксидная пленка упрочняется
Слайд 12
Химические свойства простого вещества
Растворы щелочей взаимодействуют с Al:
сначала растворяется пленка Al2O3, затем Al реагирует с водой
, а образовавшийся Al(OH)3 взаимодействует со щелочью:
2Al + 2NaOH + 6H2O→2Na[Al(OH)4] +3H2
Слайд 13
Комплексы алюминия
Тетрагидроксоалюминат взаимодействие с диоксидом углерода:
2[Al(OH)4]- + CO2 → 2Al(OH)3 +
CO32- + H2O
Аквакомплексы обладают кислотными свойствами, например:
[Al(Н20)6]3+ →
[Al(Н20)5ОН]2+ + Н +
Слайд 14
Получение алюминия
При получении Al2O3 из нефилина его сначала
спекают с известняком
Me(AlSiO4)+CaCO3→CaSiO3+MeAlO2+CO2
затем растворяют алюминаты в воде(CaSiO3 не
растворяется в воде):
MeAlO2+2H2O→Me[Al(OH)4]
пропускают через раствор CO2:
Me[Al(OH)4]+CO2→MeHCO3+Al(OH)3
и прокаливают Al(OH)3:
2Al(OH)3→Al2O3+3H2O




![Алюминий Формы существования в природеБокситы — Al2O3 · H2O (с примесями)Нефелины — KNa3[AlSiO4]4Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3Каолинит — Al2O3·2SiO2 · 2H2OГлинозёмы (смеси каолинов с](/img/tmb/13/1279906/966bfda763a89223ff39faa667a908ec-720x.jpg)






![Алюминий Комплексы алюминияТетрагидроксоалюминат взаимодействие с диоксидом углерода:2[Al(OH)4]- + CO2 → 2Al(OH)3 + CO32- + H2OАквакомплексы обладают кислотными](/img/tmb/13/1279906/e997e6f47f9928eee769e407617fe4c6-720x.jpg)































