- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Белки и их характеристика
Содержание
- 2. БелкиГемоглобин - С3032H4816O872N780S8Fe4УглеродВодородКислородАзотСераФосфор
- 3. Белки – высокомолекулярные природные соединения (биополимеры), состоящие из остатков аминокислот, которые соединены пептидной связью.
- 4. Строение аминокислотАминогруппа Карбоксильная группаРадикал ( они разные у всех аминокислот)
- 5. H2N – CH – COОН
- 6. Дипептид – соединение двух аминокислот в одну
- 7. Незаменимые аминокислоты. Незаменимыми для человека и животных
- 9. Четвертичная структура - функциональное объединение нескольких молекул белка, обладающих третичной структурной организацией.
- 10. БелкиМогут включать:ионы металла (металлопротеиды) пигмент (хромопротеиды), комплексы
- 11. Свойства белкаРастворимостьБольшой поверхностный зарядТермолабильностьДенатурация – нарушение природной
- 12. ДенатурацияОБРАТИМАЯ(ренатурация)Если сохранена первичная структураНЕОБРАТИМАЯЕсли первичная структура разрушена
- 14. Функции белков
- 15. Скачать презентацию
- 16. Похожие презентации
БелкиГемоглобин - С3032H4816O872N780S8Fe4УглеродВодородКислородАзотСераФосфор













Слайд 3 Белки – высокомолекулярные природные соединения (биополимеры), состоящие из
остатков аминокислот, которые соединены пептидной связью.
Слайд 4
Строение аминокислот
Аминогруппа
Карбоксильная группа
Радикал ( они разные
у
всех аминокислот)
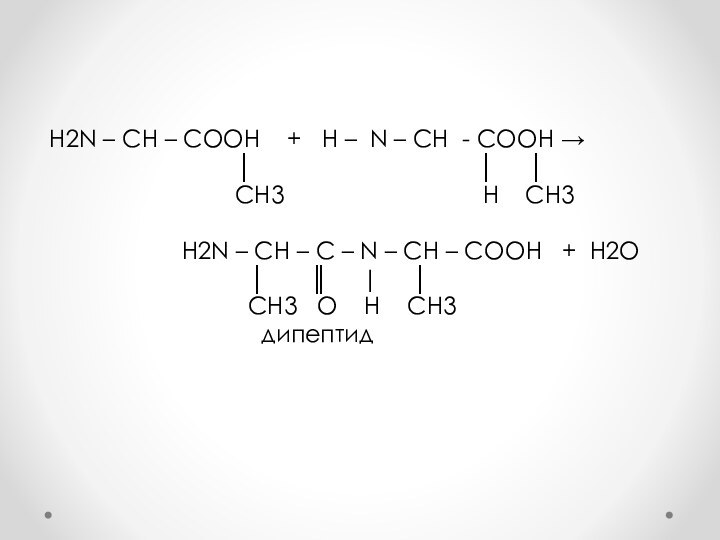
Слайд 5 H2N – CH – COОН +
Н – N – CH - COOH →
│ │ │ CH3 H CH3
H2N – CH – C – N – CH – COOH + Н2О
│ ║ | │
CH3 О Н CH3
дипептид
Слайд 6
Дипептид – соединение двух аминокислот в одну молекулу.
Полипептид
– соединение, состоящее из 20 и более аминокислотных остатков.
Слайд 7
Незаменимые аминокислоты
. Незаменимыми для человека и животных являются
8 аминокислот:
Валин -зерновые, мясе, грибы, молочные продукты, арахис.
Изолейцин
- миндаль, кешью, куриное мясо, яйца, рыба, чечевица, печень, мясо. Лейцин – мясо, рыба, рис, чечевица, орехи.
Лизин – рыба, мясо, молочные продукты, пшеница, орехи.
Метионин - мясо, рыба, яйца, бобы, фасоль, чечевица и соя.
Треони́н – молочные продукты и яйца, в умеренных количествах в орехах.
Триптофан – овес, бананы, сушёные финики, арахис, кунжут, молоко, творог, рыба, курица, индейка, мясо.
Фенилалани́н - говядина, куриное мясо, рыба, соевые бобы, яйца, творог, молоко.
Слайд 9 Четвертичная структура - функциональное объединение нескольких молекул белка,
обладающих третичной структурной организацией.
Слайд 10
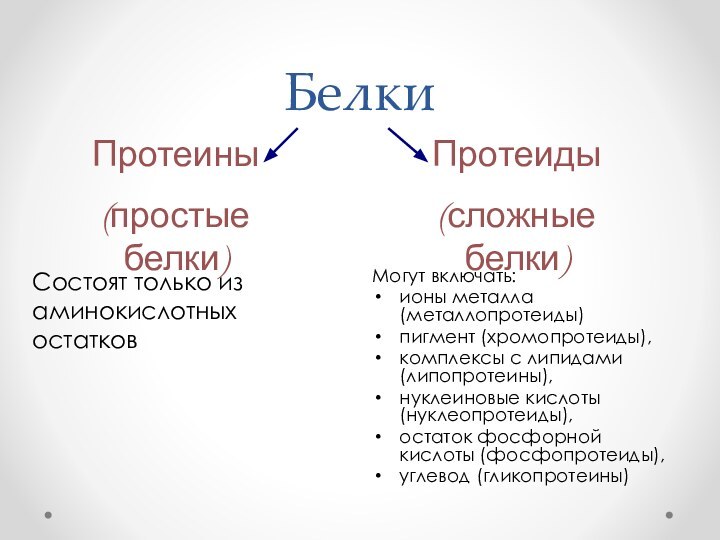
Белки
Могут включать:
ионы металла (металлопротеиды)
пигмент (хромопротеиды),
комплексы с
липидами (липопротеины),
нуклеиновые кислоты(нуклеопротеиды),
остаток фосфорной кислоты (фосфопротеиды),
углевод
(гликопротеины)Состоят только из аминокислотных остатков
Протеины
(простые белки)
Протеиды
(сложные белки)
Слайд 11
Свойства белка
Растворимость
Большой поверхностный заряд
Термолабильность
Денатурация – нарушение природной структуры
белка под действием внешних факторов:
а) высокая или
низкая температураб) механическое воздействие;
в) облучение;
г) яды;
д) действие спирта;
б) действие солей тяжелых металлов (Pb, Hg и др.)





























