Слайд 2
Гормоны
Гормоны — биологически активные вещества, вырабатывающиеся в специализированных
клетках желёз внутренней секреции, поступающие в кровь и оказывающие
регулирующее влияние на обмен веществ и физиологические функции.
Гормоны служат гуморальными (переносимыми с кровью) регуляторами определённых процессов в различных органах и системах.
Полипептидные гормоны — белки и полипептиды, выполняющие функцию гормона.
Слайд 3
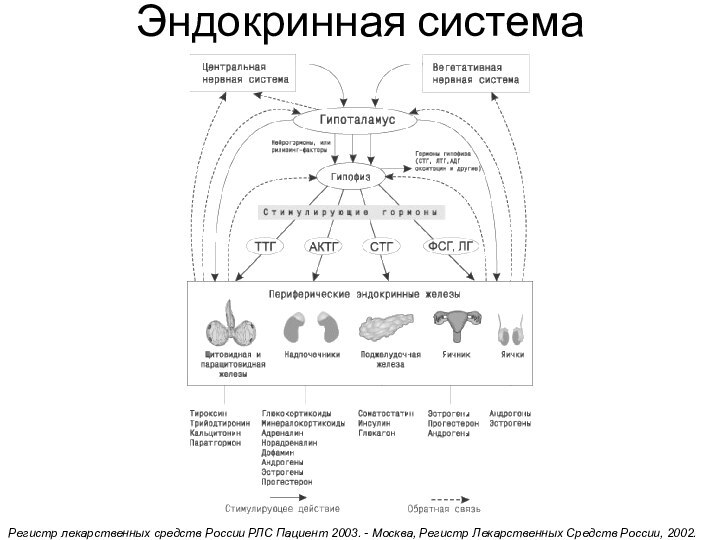
Эндокринная система
Регистр лекарственных средств России РЛС Пациент 2003.
- Москва, Регистр Лекарственных Средств России, 2002.
Слайд 4
Регуляция уровня глюкозы в крови
Слайд 5
Сахарный диабет тип I
Вызывается аутоиммунным поражением бета-клеток поджелудочной
железы, причины развития аутоиммунной реакции неясны, есть генетическая предрасположенность,
связанная с многими несвязанными между собой маркерами
Обычно возникает в детстве, частота 0,1-0,3%
Требует постоянной заместительной терапии препаратами инсулина
МКБ-9 250.01
Слайд 6
Сахарный диабет тип 2
Инсулин производится в нормальных количествах,
нарушается механизм взаимодействия инсулина с клетками организма (инсулинорезистентность).
Есть генетическая
предрасположенность, основной фактор предрасположенности - ожирение
Обычно возникает после 40 лет, частота 2-12% в зависимости от популяции
Инсулин используется как последняя линия терапии
МКБ-9 250.02
Слайд 7
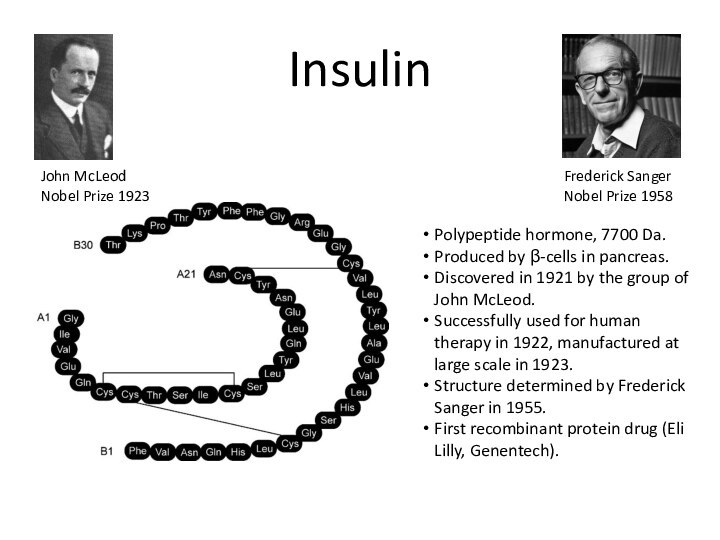
Insulin
Polypeptide hormone, 7700 Da.
Produced by β-cells in pancreas.
Discovered
in 1921 by the group of John McLeod.
Successfully used
for human therapy in 1922, manufactured at large scale in 1923.
Structure determined by Frederick Sanger in 1955.
First recombinant protein drug (Eli Lilly, Genentech).
John McLeod
Nobel Prize 1923
Frederick Sanger
Nobel Prize 1958
Слайд 8
Структура молекулы инсулина
Слайд 11
Комплекс инсулина с рецептором
doi: 10.1038/msb.2008.78
Слайд 12
Пути передачи сигнала от рецептора инсулина
Common transduction cascades

activated by the IGF-I and insulin receptors (IGF-IR and
IR, respectively). Activation of the IR or IGF-IR kinase results in receptor autophosphorylation and tyrosine phosphorylation of several substrates such as insulin receptor substrate (IRS) proteins and the protein, Shc. Once activated, IRS and Shc serve as docking proteins for Src homology 2 (SH2)-domain containing molecules such as Grb2, the p85 subunit of phosphatidyl-inositol-3′-kinase (PI 3-kinase), Nck, Syp and Fyn. Grb2 via Sos stimulates the activity of the Ras and mitogen-activated protein (MAP) kinase pathway which involves Raf-1 and extracellular signal-related kinase (ERK)-1/2. The binding of the p85 and p110 subunit of PI 3-kinase to the IRS family generates phospholipids that participate in activation of 3-phosphoinositide-dependent kinase (PDK) 1 and PDK2 and promote membrane translocation of AKt. PDK1 and PDK2 phosphorylate AKt at Ser473 and Thr308 resulting in its activation. Downstream targets of AKt include glycogen synthase kinase (GSK) 3, p70S6 kinase, glucose transporter protein (GLUT) 4, Bad and nuclear targets. AKt activation is regulated by several lipid phosphatases such as the protein tyrosine phosphatase, PTEN, or 5′ lipid phosphatases. JNK = Jun kinase; MEK and SEK1 = MAP kinase (MAPK) kinases.
DOI:10.1159/000063469
Слайд 14
История производства инсулина
Исходный способ производства – экстракция из
поджелудочных желез быков и свиней, хроматографическая очистка, кристаллизация, смешивание
Полусинтетический
инсулин – отделение Ala30 от B-цепи свиного инсулина и присоединение Thr
Инсулин crb – раздельная экспрессия цепей инсулина в E.coli, очистка цепей, смешивание и рефолдинг
Инсулин prb – экспрессия проинсулина, удаление C-пептида протеиназами
Текущий уровень потребления инсулина – около 5000 кг в год
Слайд 15
Схема производства инсулина prb
Слайд 16
Обращеннофазовая колонна производства NovaSep для финишной очистки инсулина.
Объем 180 л, емкость – 1200 г.
Цикл работы
включает загрузку полупродукта в кислом водном растворе и градиентную элюцию раствором ацетонитрила и уксусной кислоты. Время цикла – около 1 ч. Основные отделяемые примеси – дезамидированный и окисленный инсулин, Выход стадии более 95%, степень очистки около 5.
Слайд 17
Варианты лекарственных форм инсулина
Короткодействующие инсулины – раствор для
п/к или в/м введения
Долго действующие инсулины – суспензия кристаллов
с ионами цинка или комплексы с щелочными полипептидами: протамин-Zn-инсулин и инсулин-изофан
Слайд 18
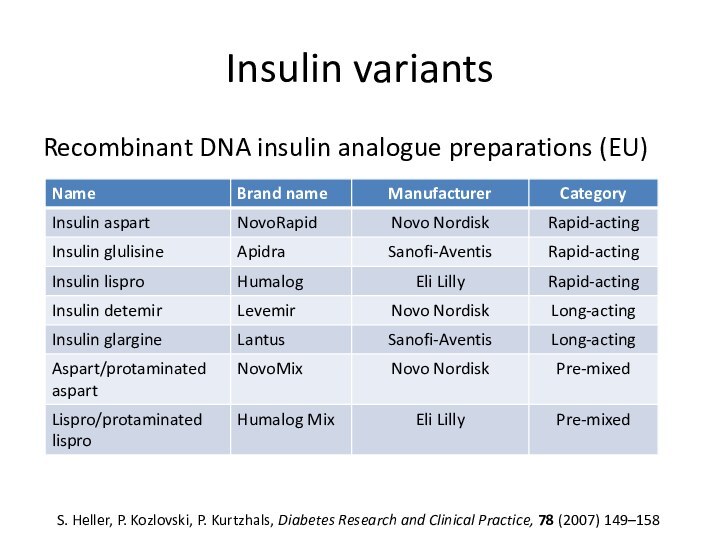
Insulin variants
Recombinant DNA insulin analogue preparations (EU)
S. Heller,
P. Kozlovski, P. Kurtzhals, Diabetes Research and Clinical Practice,
78 (2007) 149–158
Слайд 19
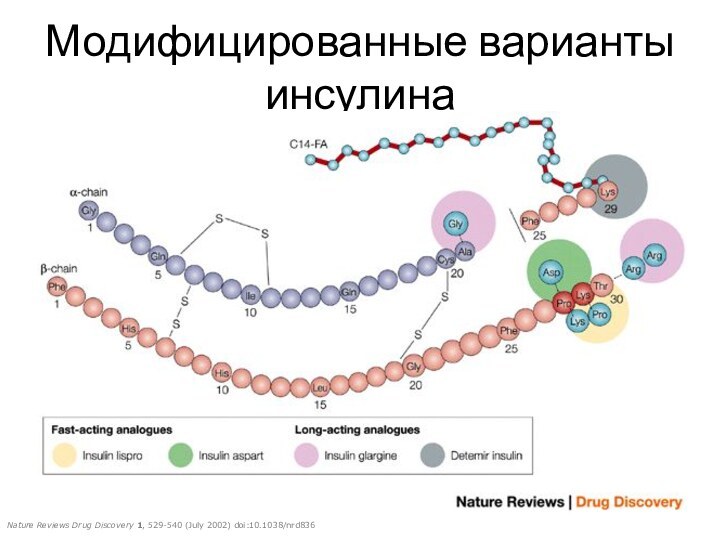
Модифицированные варианты инсулина
Nature Reviews Drug Discovery 1, 529-540 (July 2002) doi:10.1038/nrd836
Слайд 20
Глюкагон
Пептидный гормон 29 ак, секретируемый альфа-клетками поджелудочной железы
Антагонист
инсулина – вызывает увеличение уровня глюкозы
Показания – тяжелая гипогликемия,
доза – 1 мг п/к, в/м или в/в.
Рекомбинантный глюкагон производят при помощи дрожжей S.cerevisae, лекарственная форма – лиофилизат по 1 мг с 49 мг лактозы
Слайд 21
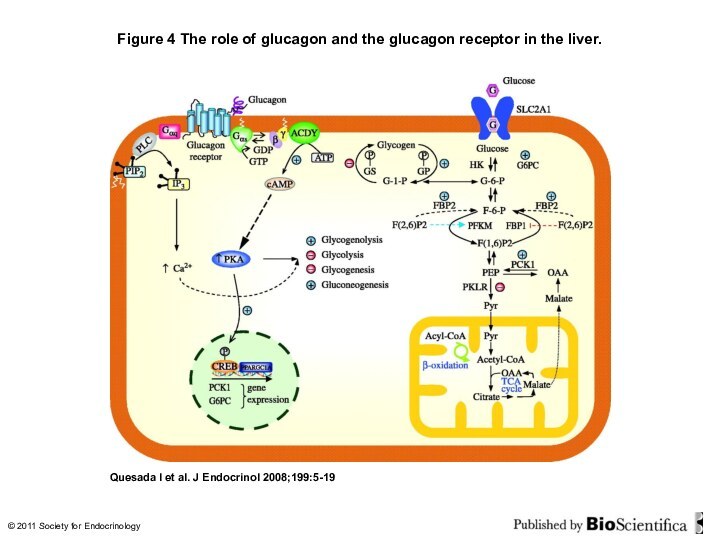
Figure 4 The role of glucagon and the
glucagon receptor in the liver.
Quesada I et al.
J Endocrinol 2008;199:5-19
© 2011 Society for Endocrinology
Слайд 22
Гормон роста человека (соматотропин)
Рис. 2. Пространственная структура ГРЧ.
Цифрами указаны номера основных альфа-спиральных участков. Сайт 1 и
сайт 2 – соответствующие сайты взаимодействия ГРЧ с рецепторами.
Слайд 23
Рис. 3. Схема сети гормональной регуляции, связанной с
ГРЧ. Активация секреции соответствующих гормонов обозначена кружком, ингибирование –
вертикальной чертой.
Слайд 24
Рис. 4. Пространственная структура комплекса ГРЧ-ГРЧР 1:2.
А
– проекция, приближенная к рис. 2, C-концевые домены внеклеточных
участков ГРЧР удалены. Обозначены N- и C- концы ГРЧ. Б – проекция вдоль оси пучка альфа-спиралей ГРЧ. N- и C- концы ГРЧ удалены от наблюдателя, сайт 1 находится справа.
Слайд 25
Антагонисты соматотропина
Пегвисомант (Сомаверт) – антагонист рецептора ГРЧ для
терапии акромегалии, лиофилизат 10, 15, 20 мг
Слайд 26
Метаболические эффекты соматотропина
Слайд 27
Терапевтическое применение соматотропина
Основные показания – гипофизарный нанизм (~1:5000),
синдром Шерешевского-Тернера, хроническая почечная недостаточность
Применение – 1-2 мг/м2/д до
достижения нормального роста.
Лекарственные формы – лиофилизат или раствор для в/м или п/к инъекций.
Способы получения – E.coli, S.cerevisae, CHO
Слайд 28
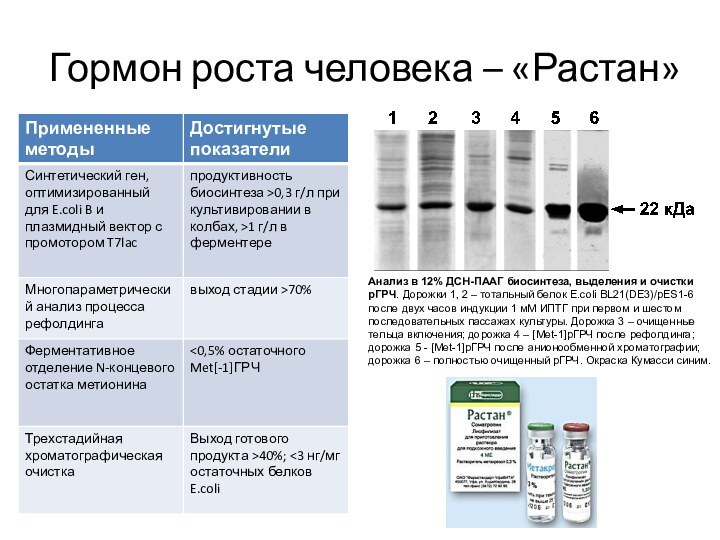
Гормон роста человека – «Растан»
Анализ в 12% ДСН-ПААГ
биосинтеза, выделения и очистки рГРЧ. Дорожки 1, 2 –
тотальный белок E.coli BL21(DE3)/pES1-6 после двух часов индукции 1 мМ ИПТГ при первом и шестом последовательных пассажах культуры. Дорожка 3 – очищенные тельца включения; дорожка 4 – [Met-1]рГРЧ после рефолдинга; дорожка 5 - [Met-1]рГРЧ после анионообменной хроматографии; дорожка 6 – полностью очищенный рГРЧ. Окраска Кумасси синим.
Слайд 29
Инсулиноподобный фактор роста
ИФР-1, соматомедин. 70 ак в одной
цепи с тремя дисульфидными связями, 7,6 кДа
Основной эндокринный посредник
соматотропина
Синтезируется гепатоцитами в ответ на активацию рецептора соматотропина, обеспечивает физиологические эффекты соматотропина в большинстве тканей
Обеспечивает обратную связь с гипоталамусом и гипофизом – недостаток ИФР-1 стимулирует выработку соматотропин-рилизинг-гормона, избыток - соматостатина
Слайд 31
Лекарственные средства ИФР-1
2 варианта ИФР-1 – Myotrophin и
Increlex
Increlex – многодозовый флакон с раствором для п/к применения,
10 мг/мл
Показания – задержка роста у детей с дефицитом ИФР-1, делеция гена соматотропина и нейтрализующие антитела к соматотропину
Дозировка – 40-80 мкг/кг два раза в день до достижения нормального роста
Слайд 32
ИФР-1 связывающие белки
IGFBP (Insulin-like growth factor-binding protein), 7
генов, основной – IGFBP-3, от 24 до 45 кДа
Связывают
практически весь ИФР-1 и ИФР-II, в том числе в печени
Комплекс ИФР-1 со связывающим белком лучше узнается рецептором, в разных тканях активны различные IGFBP
Лекарственное средство Mecasermin rinfabate (IPLEX) – комплекс ИФР-1 и IGFBP-3
Позволяет уменьшить гипогликемические проявления ИФР-1, показания - амиотрофический латеральный склероз
Слайд 33
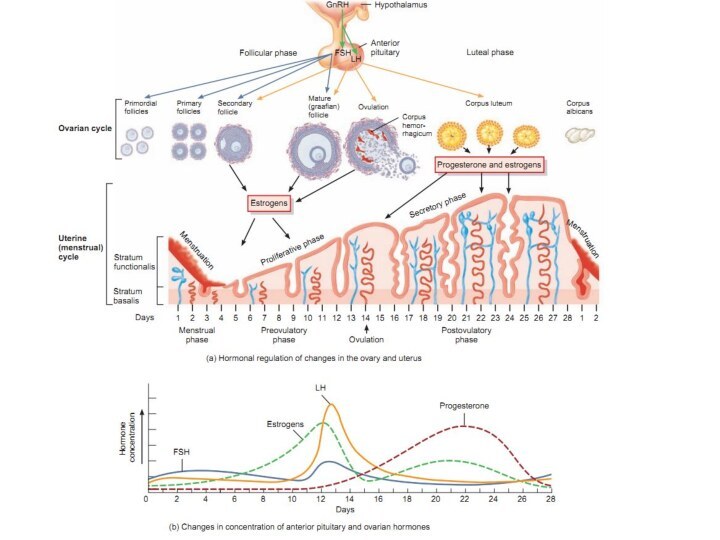
Семейство гонадотропных гормонов
Фолликулостимулирующий гормон –ФСГ, FSH
Лютеинизирующий гормон –
ЛГ, LH
Хорионический гонадотропин –ХГ, CG
Ранее к гонадотропинам причисляли пролактин
ФСГ
и ЛГ вырабатываются гипофизом, ХГ - плацентой
Слайд 35
Фолликулостимулирующий гормон
ФСГ, ЛГ и ХГ – гетеродимеры, содержат
общую альфа-цепь 92 ак и специфические бета-цепи около 110
ак, обе цепи N-гликозилированы, по 2 олигосахарида на цепь
Рекомбинантный ФСГ получают в клетках CHO, путем экспрессии двух отдельных генов
Лекарственные средства – фоллитропин альфа, фоллитропин бета
Лекарственные формы – лиофилизат и картриджи для шприц-ручек с раствором 80 мкг/мл для п/к или в/м введения
Типичный курс терапии при стимуляции овуляции – 5-20 доз по 15-25 мкг ежедневно
Слайд 36
Fig. 3. Separation of the N-glycans of r-hFSH
by HPAEC. Evidences of differences in sialylation levels for
two r-hFSH batches with different biospecific activities: (A) r-hFSH batch with a high biospecific activity; (B) r-hFSH batch with a low biospecific activity. Triangles.sialic acid; closed circles.galactose; closed squares.N-acetylgalactosamine; open squares.N-acetylglucosamine; open circles.mannose. The attribution of the
glycan structures to the peaks is deduced from MALDI-TOF mass spectra.
DOI: 10.1093/glycob/cwg020
Слайд 37
Индекс заряда гликанов
Z = A(neutral)*0+A(mono)*1+A(di)*2+A(tri)*3 +A(tetra)*4+A(penta)*5.
Для ФСГ очень
высокий Z – низкая биоактивность, большое время полувыведения
Средний Z
– высокая биоактивность, малое время полувыведения
Низкий Z – низкая биоактивность, малое вермя полувыведения
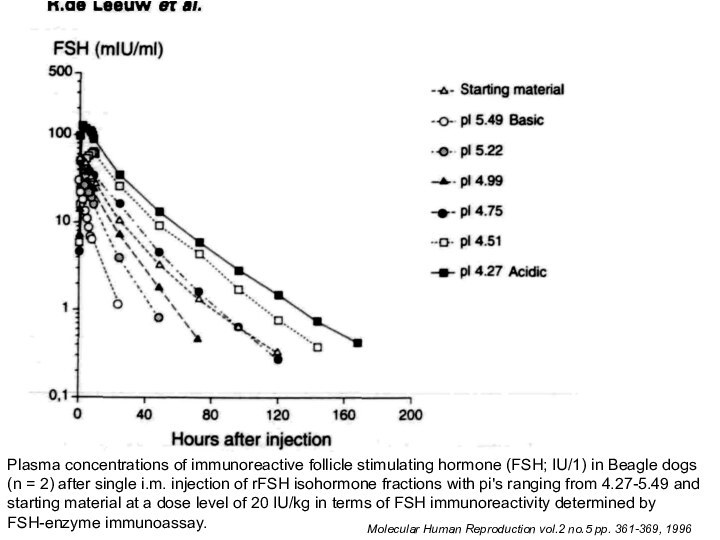
Слайд 38
Molecular Human Reproduction vol.2 no.5 pp. 361-369, 1996
Plasma
concentrations of immunoreactive follicle stimulating hormone (FSH; IU/1) in
Beagle dogs (n = 2) after single i.m. injection of rFSH isohormone fractions with pi's ranging from 4.27-5.49 and starting material at a dose level of 20 IU/kg in terms of FSH immunoreactivity determined by FSH-enzyme immunoassay.
Слайд 39
Постоянство индекса заряда гликанов рекомбинантного ФСГ
DOI: 10.1093/glycob/cwg020