- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему БИОХИМИЧЕСКАЯ ТРАНСФОРМАЦИЯ ВЕЩЕСТВ(2)
Содержание
- 2. Биотрансформация чужеродных соединений происходит во всех биосистемах
- 3. Фазы биотрансформацииРеакции 1-й фазыРеакции 2-й фазы(реакции синтеза)конъюгация
- 4. СИСТЕМА ОБЕЗВРЕЖИВАНИЯ ЛИПОФИЛЬНЫХ КСЕНОБИОТИКОВ
- 5. Основные пути биотрансформации чужеродных соединений.
- 6. Восстановление:а) восстановление нитросоединений, азосоединений микросомальными ферментами;б) микросомальное
- 7. Ферменты биотрансформации ксенобиотиков присутствуют, в основном, в
- 8. Ферментативные реакции 1-й фазы биотрансформациикарбоксиэстераза,ацетилхолинэстераза псевдохолинэстераза эпоксидная
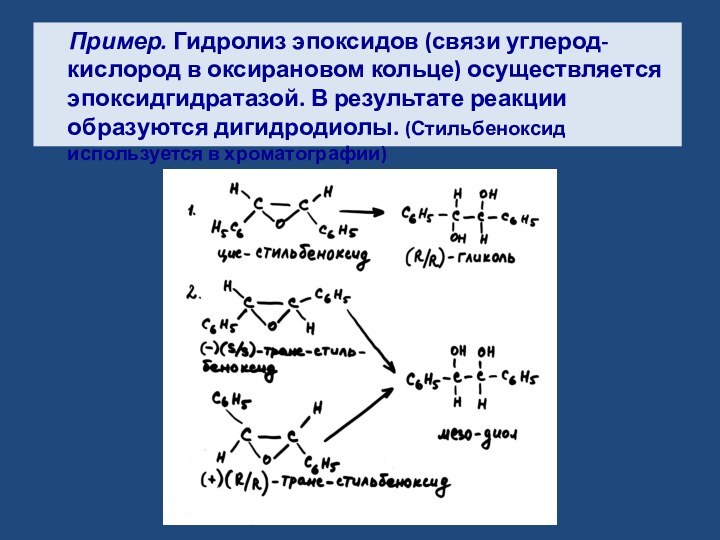
- 9. Пример. Гидролиз эпоксидов (связи углерод-кислород в оксирановом
- 10. 2 . Реакции восстановления.Восстанавливаются некоторые металлы, альдегиды,
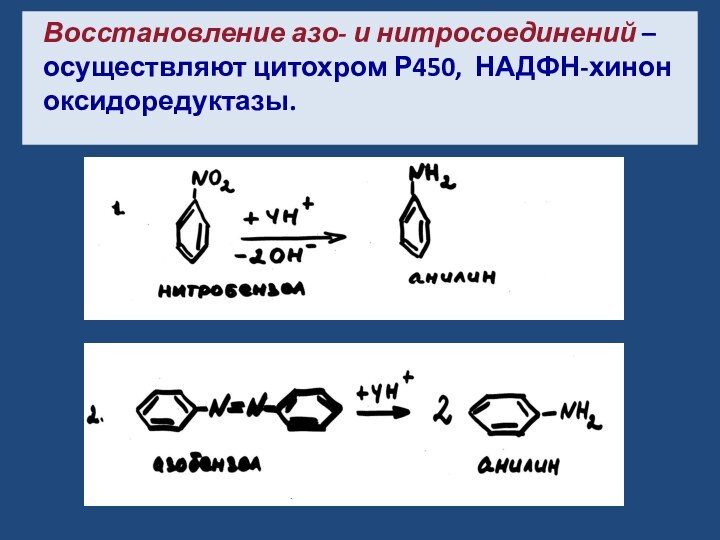
- 11. Восстановление азо- и нитросоединений – осуществляют цитохром Р450, НАДФН-хинон оксидоредуктазы.
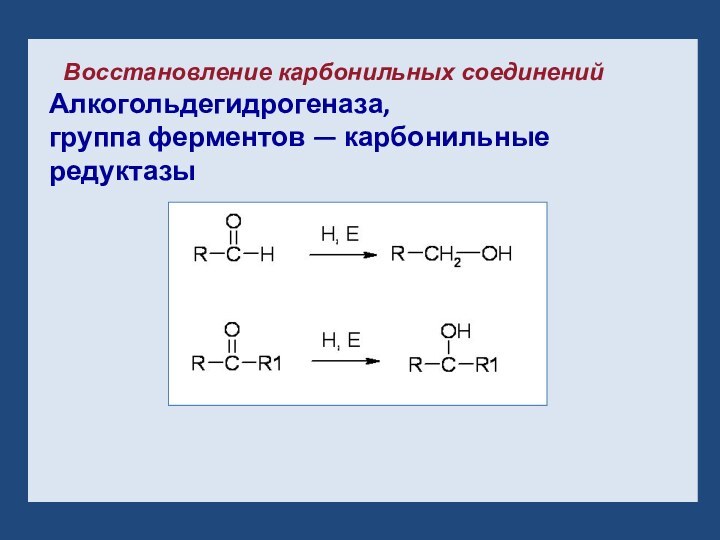
- 12. Восстановление карбонильных соединенийАлкогольдегидрогеназа,группа ферментов — карбонильные редуктазы
- 13. Восстановление дисульфидов – ферменты:глутатионредуктаза, глутатион - S-трансфераза, или неферментативно
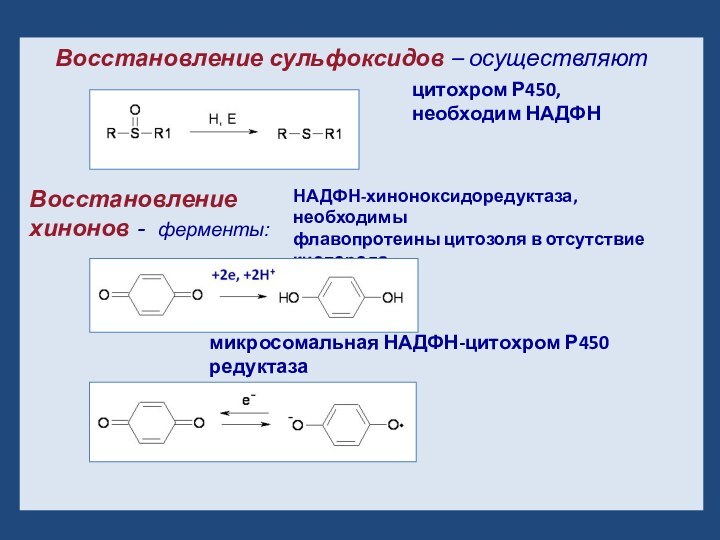
- 14. Восстановление сульфоксидов – осуществляют цитохром Р450, необходим
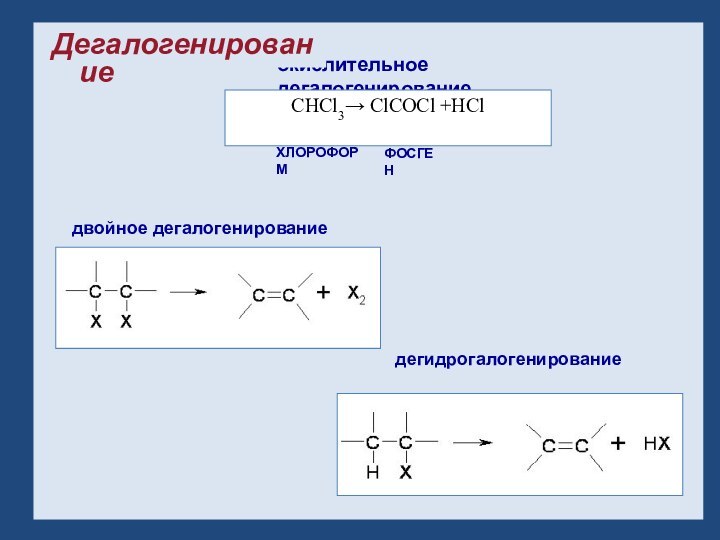
- 15. Дегалогенирование: окислительное дегалогенирование двойное дегалогенирование дегидрогалогенирование ХЛОРОФОРМФОСГЕНCHCl3→ ClCOCl +HClДегалогенирование
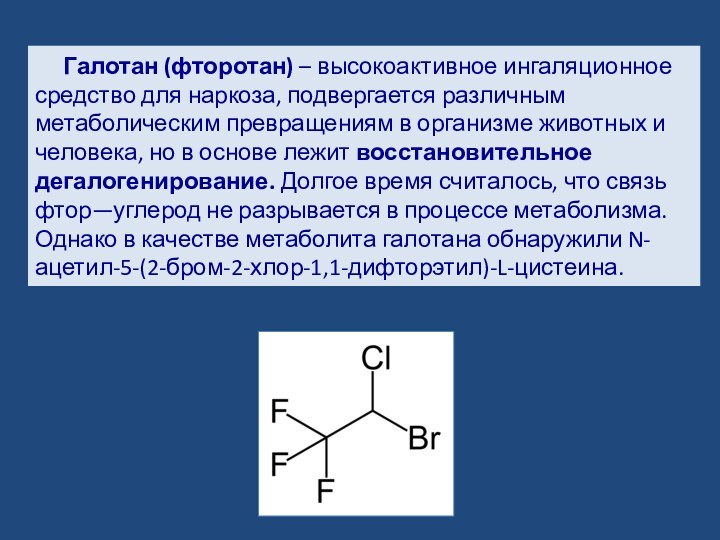
- 16. Галотан (фторотан) – высокоактивное ингаляционное средство для
- 17. Последние данные указывают, что метаболизм галотана условно
- 18. 3. Реакции окисления.Альдегиддегидрогеназы (АлДГ) - окисление альдегидов
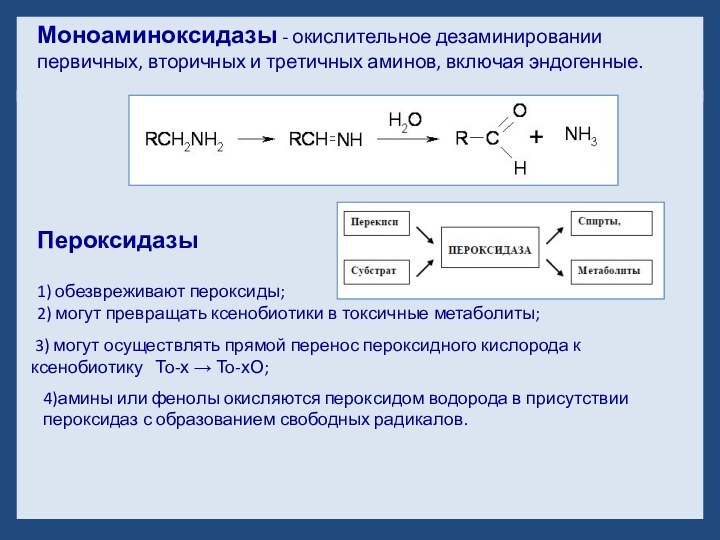
- 19. Пероксидазы 1) обезвреживают пероксиды;2) могут превращать ксенобиотики
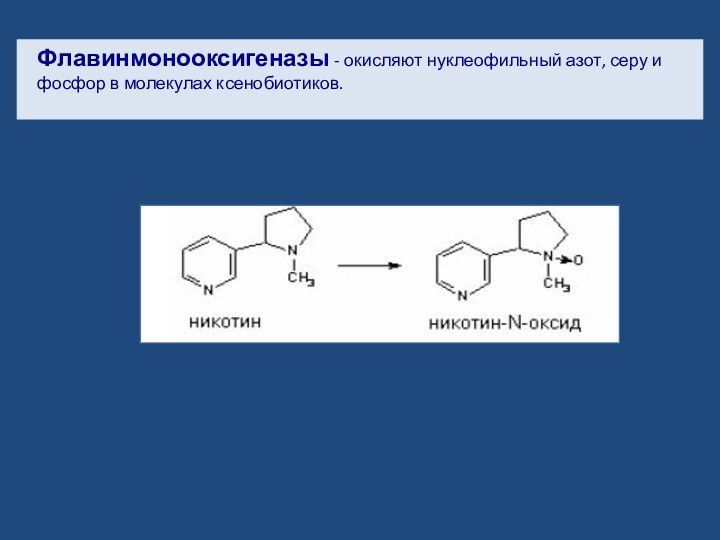
- 20. Флавинмонооксигеназы - окисляют нуклеофильный азот, серу и фосфор в молекулах ксенобиотиков.
- 21. Цитохром Р450 катализирует реакции окисления: -гидроксилирование алифатических
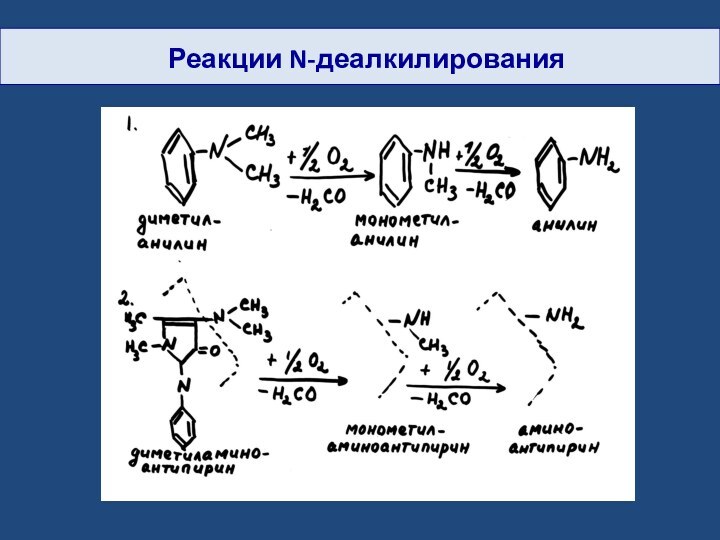
- 22. Реакции N-деалкилирования
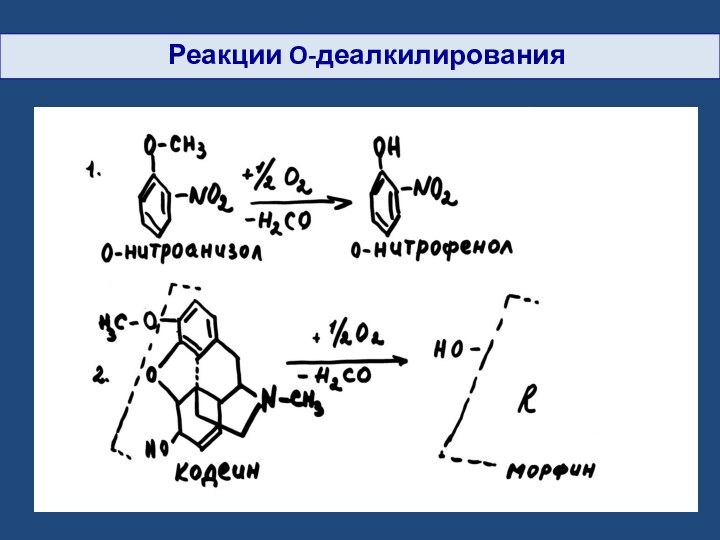
- 23. Реакции O-деалкилирования
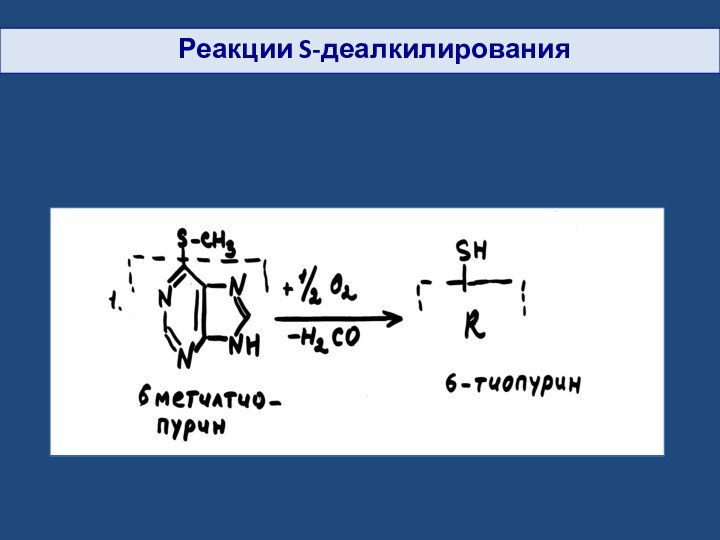
- 24. Реакции S-деалкилирования
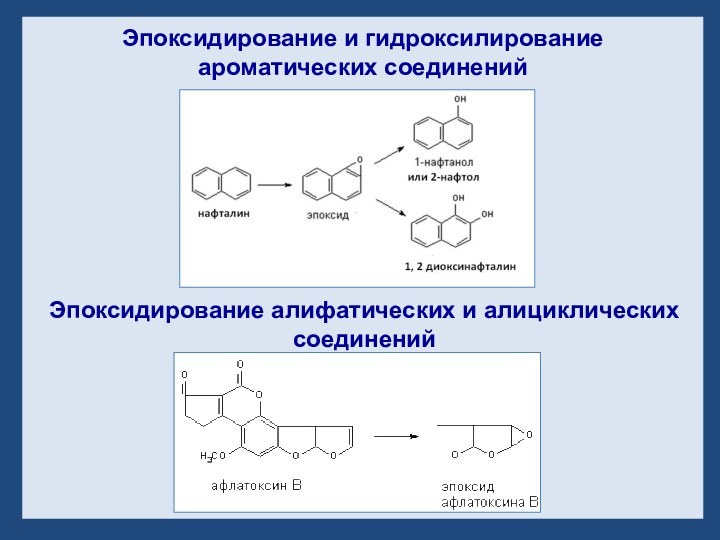
- 25. Эпоксидирование и гидроксилирование ароматических соединений Эпоксидирование алифатических и алициклических соединений
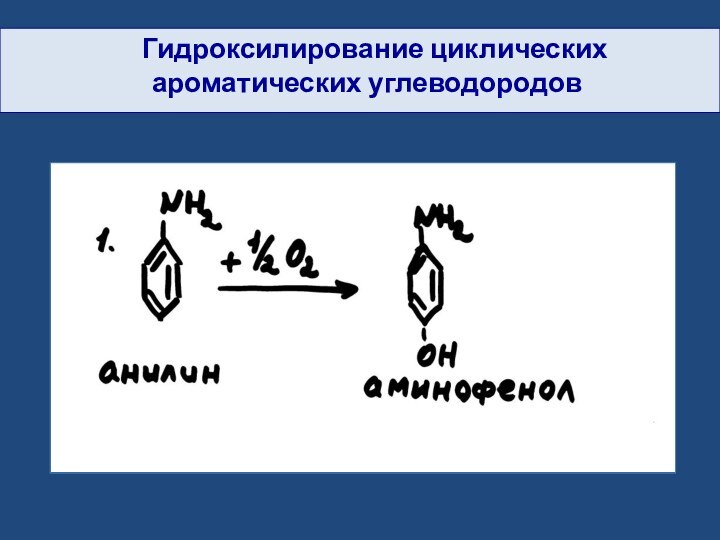
- 26. Гидроксилирование циклических ароматических углеводородов
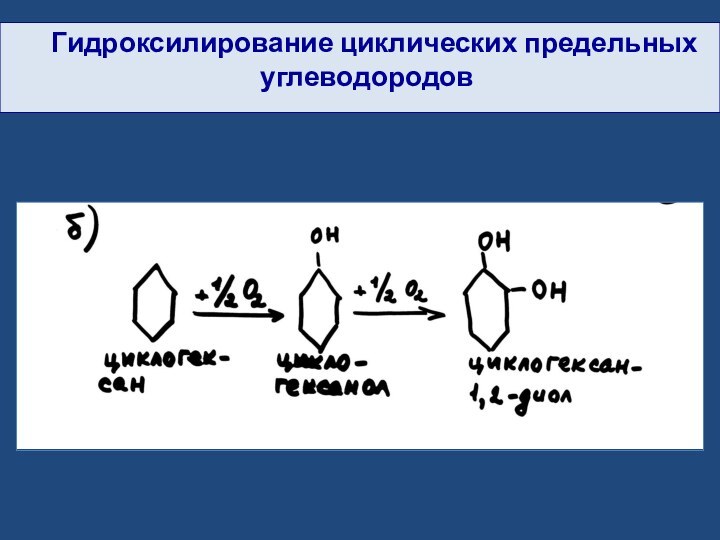
- 27. Гидроксилирование циклических предельных углеводородов
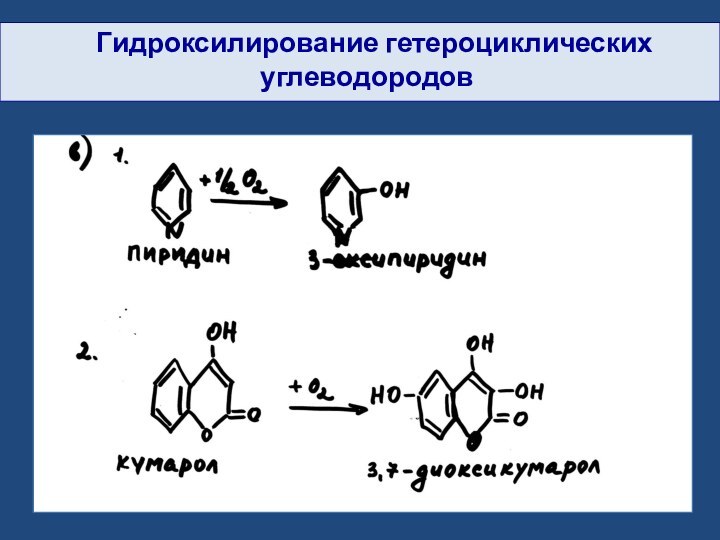
- 28. Гидроксилирование гетероциклических углеводородов
- 29. Гидроксилирование алифатических соединений:а) предельных углеводородов
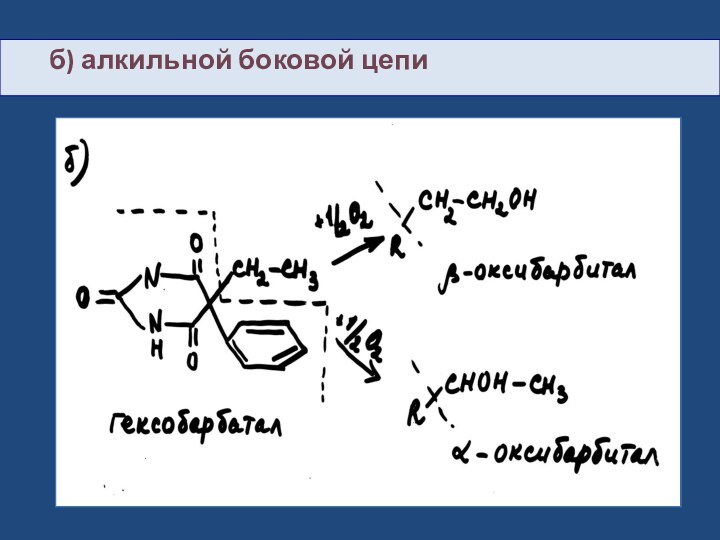
- 30. б) алкильной боковой цепи
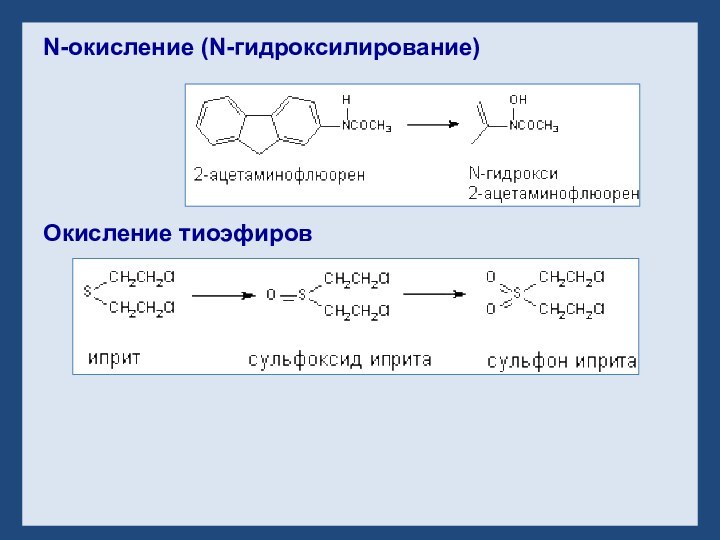
- 31. N-окисление (N-гидроксилирование) Окисление тиоэфиров
- 32. Обезвреживание этанолаПоступивший в организм этанол кровью переносится
- 33. Окисление этанола NAD-зависимой алкогольдегидрогеназойАлкогольдегидрогеназа катализирует обратимую реакцию,
- 34. Изоферменты алкогольдегидрогеназы.Класс I АДГ-изоферментов (-АДГ, β- АДГ
- 35. 2. Окисление этанола при участии цитохром Р450
- 36. При хроническом алкоголизме окисление этанола ускоряется на
- 37. 3. Окисление этанола каталазой Второстепенную роль в
- 38. Ацетальдегид, образовавшийся из этанола, окисляется до уксусной
- 39. 2) Ацетальдегиддегидрогеназа (АлДГ) – окисляет субстрат
- 40. Например, митохрондриальная изоформа АлДГ гепатоцитов, обладает более
- 41. Эффекты этанола в печени
- 42. Эффекты этанола в печени (пояснение схемы).
- 43. Следствия химической модификации молекулы ксенобиотика
- 44. Следствия химической модификации молекулы ксенобиотика
- 45. За возможность образования легко выводимого из организма
- 46. Механизм активации канцерогенов цитохромами P450 (подсемейство
- 47. Скачать презентацию
- 48. Похожие презентации
Биотрансформация чужеродных соединений происходит во всех биосистемах (органоид, клетка, ткань, орган, организм, надорганизменные биосистемы – биогеоценозы, биосфера).Основными органами метаболизма ксенобиотиков в организме животных являются печень, почки, эпителий желудочно-кишечного тракта , легкие, мозговая ткань.

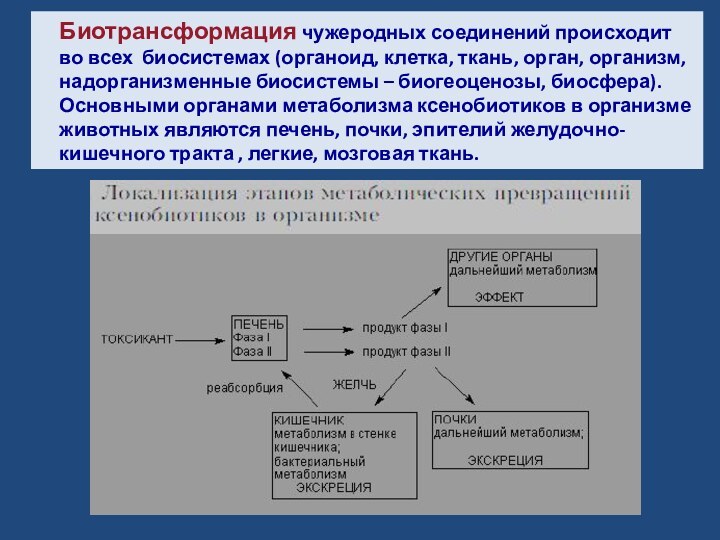






















Слайд 2 Биотрансформация чужеродных соединений происходит во всех биосистемах (органоид,
клетка, ткань, орган, организм, надорганизменные биосистемы – биогеоценозы, биосфера).
органами метаболизма ксенобиотиков в организме животных являются печень, почки, эпителий желудочно-кишечного тракта , легкие, мозговая ткань.
Слайд 3
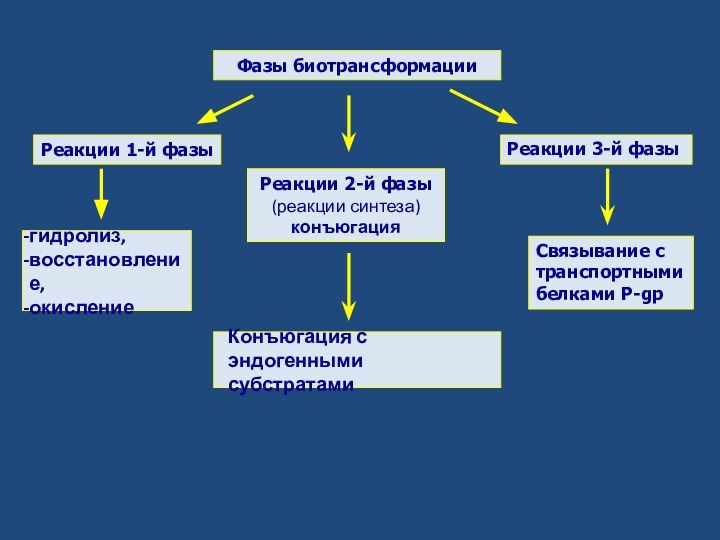
Фазы биотрансформации
Реакции 1-й фазы
Реакции 2-й фазы
(реакции синтеза)
конъюгация
гидролиз,
восстановление,
окисление
Конъюгация с эндогенными субстратами
Реакции 3-й фазы
Связывание с
транспортными
белками Р-gp
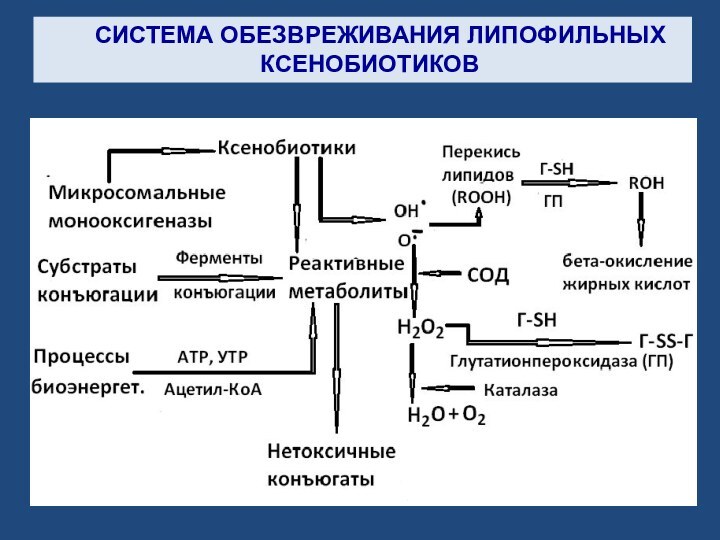
Слайд 5
Основные пути биотрансформации чужеродных соединений.
I ФАЗА
Окисление:
а) микросомальное
– алифатичекое или ароматическое гидроксилирование,
– эпоксидирование,
– N-гидроксилирование,
– N, S-окисление,
– дезалкилирование,
– дезаминирование,
– десульфирование;
б) немикросомальное
– окислительное дезаминирование,
– окисление спиртов, альдегидов,
– ароматизация алициклических соединений.
Слайд 6
Восстановление:
а) восстановление нитросоединений, азосоединений микросомальными ферментами;
б) микросомальное восстановительное
галогенирование;
в) немикросомальное восстановление.
Гидролиз с участием микросомальных и немикросомальных ферментов.
II
ФАЗАСинтез (реакции коньюгации):
глюкуронирование,
сульфатирование,
ацетилирование,
метилирование,
конъюгация (соединение) с:
а) глутатионом (синтез меркаптуровой кислоты)
б) аминокислотами (глицином, таурином и глутаминовой кислотой).
Слайд 7 Ферменты биотрансформации ксенобиотиков присутствуют, в основном, в микросомах
и в цитозоле, незначительная часть – в митохондриях, ядре
и лизосомах.
Слайд 8
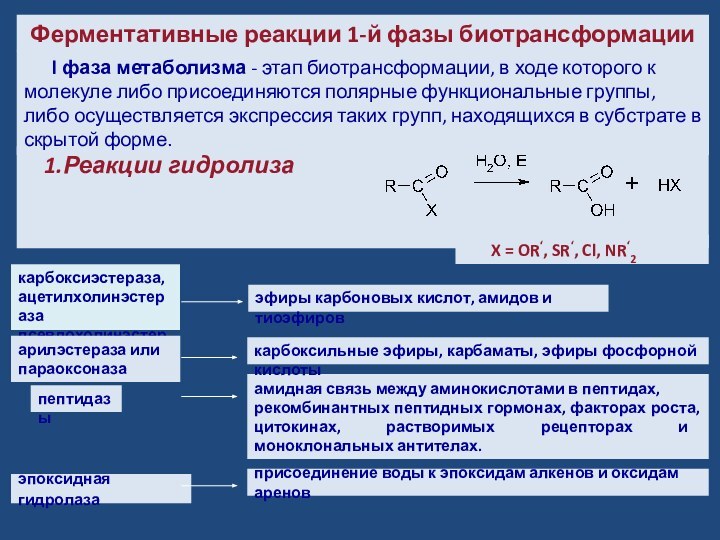
Ферментативные реакции 1-й фазы биотрансформации
карбоксиэстераза,
ацетилхолинэстераза
псевдохолинэстераза
эпоксидная гидролаза
l фаза метаболизма - этап биотрансформации, в ходе которого
к молекуле либо присоединяются полярные функциональные группы, либо осуществляется экспрессия таких групп, находящихся в субстрате в скрытой форме. Слайд 9 Пример. Гидролиз эпоксидов (связи углерод-кислород в оксирановом кольце)
осуществляется эпоксидгидратазой. В результате реакции образуются дигидродиолы. (Стильбеноксид используется
в хроматографии)
Слайд 10
2 . Реакции восстановления.
Восстанавливаются некоторые металлы, альдегиды, кетоны,
дисульфиды, сульфоксиды, хиноны, алкены, азо- и нитросоединения.
Коферменты —НАД+/НАДН и
НАДФ+/НАДФН;(ФАД/ФАДН2).
Слайд 11 Восстановление азо- и нитросоединений – осуществляют цитохром Р450,
НАДФН-хинон оксидоредуктазы.
Слайд 12
Восстановление карбонильных соединений
Алкогольдегидрогеназа,
группа ферментов — карбонильные редуктазы
Слайд 13
Восстановление дисульфидов – ферменты:
глутатионредуктаза,
глутатион - S-трансфераза,
или
неферментативно
Слайд 14
Восстановление сульфоксидов – осуществляют
цитохром Р450, необходим НАДФН
Восстановление хинонов - ферменты:
НАДФН-хиноноксидоредуктаза, необходимы
флавопротеины цитозоля в отсутствие кислорода
микросомальная НАДФН-цитохром Р450 редуктаза
Слайд 15
Дегалогенирование:
окислительное дегалогенирование
двойное дегалогенирование
дегидрогалогенирование
ХЛОРОФОРМ
ФОСГЕН
CHCl3→ ClCOCl
+HCl
Дегалогенирование
Слайд 16 Галотан (фторотан) – высокоактивное ингаляционное средство для наркоза,
подвергается различным метаболическим превращениям в организме животных и человека,
но в основе лежит восстановительное дегалогенирование. Долгое время считалось, что связь фтор—углерод не разрывается в процессе метаболизма. Однако в качестве метаболита галотана обнаружили N-ацетил-5-(2-бром-2-хлор-1,1-дифторэтил)-L-цистеина.Слайд 17 Последние данные указывают, что метаболизм галотана условно делится
на два пути:
включает окисление молекулы с образованием трифторуксусной
кислоты и отщепление галогенов Сl и Br; восстановительное дегалогенирование, в результате чего элиминирует атом фтора.
Вероятно, обе реакции протекают в микросомах и зависят от цитохрома Р450, так как для них необходимы НАДФН и цитохром Р450. Более того, они индуцируются фенобарбиталом и бифенилами.
Слайд 18
3. Реакции окисления.
Альдегиддегидрогеназы (АлДГ) - окисление альдегидов до
карбоновых кислот (кофактор НАД+).
Дигидродиолдегидрогеназы - окисление полициклических ароматических
углеводородов.Молибденовые гидроксилазы:
сульфитоксидаза – окисляет токсичный сульфит до относительно безопасного сульфата;
ксантиндегидрогеназа (XD) и ксантиноксидаза (ХО) — участвуют в процессах, связанных с оксидативным стрессом, пероксидном окислении липидов;
альдегидоксидаза — пероксидное окисление липидов, катаболизм биогенных аминов и катехоламинов.
Слайд 19
Пероксидазы
1) обезвреживают пероксиды;
2) могут превращать ксенобиотики
в токсичные метаболиты;
3) могут осуществлять прямой перенос
пероксидного кислорода к ксенобиотику То-х → То-хО;4)амины или фенолы окисляются пероксидом водорода в присутствии пероксидаз с образованием свободных радикалов.
Моноаминоксидазы - окислительное дезаминировании первичных, вторичных и третичных аминов, включая эндогенные.
Слайд 20 Флавинмонооксигеназы - окисляют нуклеофильный азот, серу и фосфор
в молекулах ксенобиотиков.
Слайд 21
Цитохром Р450 катализирует реакции окисления:
-гидроксилирование алифатических и
ароматических углеводородов;
эпоксидирование двойной связи;
окисление гетероатомов (О-, S-, N-,
Si-)N-гидроксилирование;
деалкилирование гетероатомов (О-, S-, N-, Si-),
окислительный перенос группы;
разрыв сложноэфирной связи;
дегидрирование.
RH + O2 + НАДФН+H+ → ROH + Н2О + НАДФ+
Слайд 25
Эпоксидирование и гидроксилирование ароматических соединений
Эпоксидирование алифатических и
алициклических соединений
Слайд 32
Обезвреживание этанола
Поступивший в организм этанол кровью переносится во
все органы и ткани организма. Его катаболизм осуществляется главным
образом в печени (от 75 % до 98 % поступившего в организм этанола).Превращение этанола в печени происходит тремя путями с образованием токсического метаболита – ацетальдегида.
Слайд 33
Окисление этанола NAD-зависимой алкогольдегидрогеназой
Алкогольдегидрогеназа катализирует обратимую реакцию, направление
которой зависит от концентрации ацетальдегида и соотношения NADH/NAD+ в
клетке.Алкогольдегидрогеназа (АДГ) — цитозольный фермент.
С2Н5ОН + HAD+ ↔ СН3СНО + NADH + H+
При хроническом алкоголизме количество фермента в печени не увеличивается, т.е. он не является индуцируемым ферментом.
Слайд 34
Изоферменты алкогольдегидрогеназы.
Класс I АДГ-изоферментов (-АДГ, β- АДГ и
γ - АДГ) – окисление этанола и других алифатических
спиртов небольших размеров.Класс II АДГ (π-АДГ) (в печени) - окисление более крупных алифатических и ароматических спиртов.
Класса III АДГ (χ-АДГ) - длинноцепочечные алифатические спирты (начиная от пентанола) и ароматические спирты.
Класс IV АДГ (σ- или μ-АДГ) — окислении ретинола.
Слайд 35 2. Окисление этанола при участии цитохром Р450 -
зависимой микросомальной этанолокисляющей системы
Цитохром Р450-зависимая микросомальная этанолокисляющая система локализована
в мембране гладкого ЭР гепатоцитов. Она индуцируется этанолом, другими спиртами и приобретает существенное значение при поступлении больших доз этанола и при злоупотреблении алкоголем. Окисление этанола происходит при участии изофермента Р450IIE1.
Слайд 36 При хроническом алкоголизме окисление этанола ускоряется на 50
– 70 % за счёт гипертрофии ЭР и индукции
цитохрома Р450IIE1.С2Н5ОН + NADPH + Н+ + О2 → СН3СНО + NADP+ + 2Н2О
Кроме основной реакции, цитохром Р450 катализирует образование активных форм кислорода (О2-, Н2О2), которые стимулируют ПОЛ в печени и других органах.
Слайд 37
3. Окисление этанола каталазой
Второстепенную роль в окислении
этанола играет каталаза, находящаяся в пероксисомах. Этот фермент расщепляет
примерно 2 % этанола, при этом одновременно разлагается пероксид водорода.СН3СН2ОН + Н2О2 → СН3СНО + 2Н2О.
Образующийся в этих реакциях ацетальдегид – очень токсичен и поэтому в тканях он превращается в нетоксичный ацетат.
Слайд 38
Ацетальдегид, образовавшийся из этанола, окисляется до уксусной кислоты.
Работают два фермента:
1) FAD -зависимая альдегидоксидаза:
СН3СНО + О2
+ H2O → СН3СООН + Н2О2 Повышение концентрации ацетальдегида в клетке вызывает индукцию фермента альдегидоксидазы. В ходе реакции образуются уксусная кислота, Н2О2 , другие активные формы кислорода, что приводит к усилению перекисного окисления липидов (ПОЛ).
Слайд 39
2) Ацетальдегиддегидрогеназа (АлДГ) – окисляет субстрат при
участии кофермента NAD+.
СН3СНО + Н2О + NAD+ →
СН3СООН + NADH + H+ В разных тканях организма человека встречаются полиморфные варианты АлДГ.
Они характеризуются широкой субстратной специфичностью, разным распределением по клеткам тканей (почки, эпителий, слизистая оболочка желудка и кишечника) и в компартментах клетки – митохондриях и цитозоли.
Слайд 40
Например, митохрондриальная изоформа АлДГ гепатоцитов, обладает более высоким
сродством к ацетальдегиду (имеет низкую константу Михаэлиса КМ ),
чем цитозольная (КМ существенно выше).У некоторых жителей Японии и Китая после употребления очень небольших доз алкоголя происходит расширение сосудов и увеличение частоты сердечных сокращений. Эти же дозы алкоголя у европейцев не вызывают такого действия.
Наблюдаемый физиологический эффект обусловлен тем, что у вышеупомянутых жителей присутствует только цитозольная АлДГ, а митохондриальная форма отсутствует поэтому ацетальдегид медленно превращается в нетоксичный ацетат.
Слайд 42
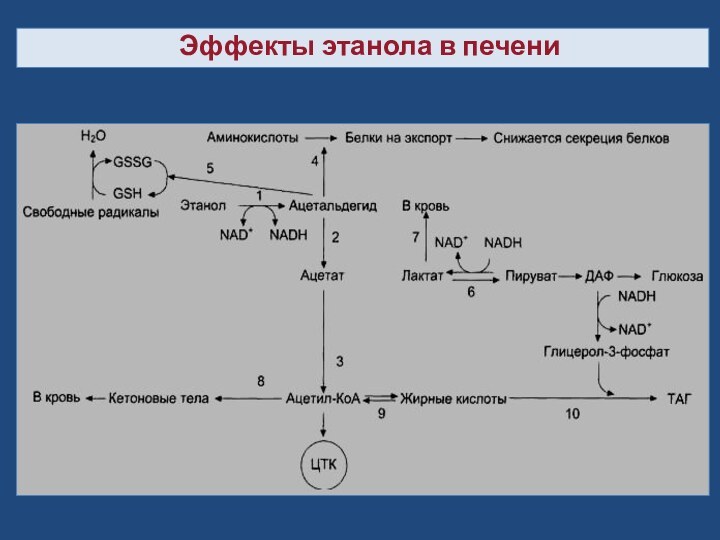
Эффекты этанола в печени (пояснение схемы).
1
→ 2 → 3 - окисление этанола до ацетата
и превращение его в ацетил-КоА (1 - реакция катализируется алкогольдегидрогеназой, 2 - реакция катализируется АлДГ).Скорость образования ацетальдегида (1) часто при приёме большого количества алкоголя выше, чем скорость его окисления (2), поэтому ацетальальдегид накапливается и оказывает влияние на синтез белков (4), ингибируя его, понижает концентрацию восстановленного глутатиона (5), в результате чего активируется ПОЛ.
Скорость глюконеогенеза (6) снижается, так как высокая концентрация NADH, образованного в реакциях окисления этанола (1, 2), ингибирует глюконеогенез (6).
Лактат выделяется в кровь (7), и развивается лактоацидоз. Увеличение концентрации NADH замедляет скорость ЦТК; ацетил-КоА накапливается, активируется синтез кетоновых тел (кетоз) (8).
Окисление жирных кислот также замедляется (9), увеличивается синтез жира (10), что приводит к ожирению печени и гипертриацилглицеролэмии.
Слайд 45
За возможность образования легко выводимого из организма вещества
путем окисления моноаминоксидазами клетка «платит» образованием в ряде случаев
активного токсичного, мутагенного или канцерогенного вещества (например, непрямые канцерогены превращаются в конечные канцерогены).В условиях увеличивающегося загрязнения окружающей среды количество поступающих в организм канцерогенов (и прямых, и непрямых) возрастает, это превышает стационарную концентрацию конечных канцерогенов, с которой справляется организм, и увеличивает таким образом вероятность заболевания раком.
Слайд 46
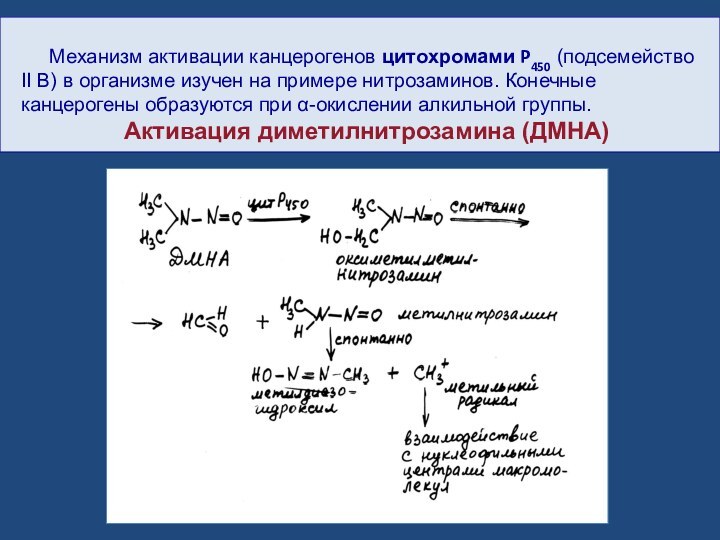
Механизм активации канцерогенов цитохромами P450 (подсемейство II
В) в организме изучен на примере нитрозаминов. Конечные канцерогены
образуются при α-окислении алкильной группы.Активация диметилнитрозамина (ДМНА)





























