Слайд 2
Историческая справка
Фосфор открыт гамбургским алхимиком Геннингом Брандом в
1669 г. Подобно другим алхимикам, Бранд пытался отыскать эликсир жизни
или философский камень, а получил светящееся вещество. Существуют данные, что фосфор умели получать еще арабские алхимики в XII в. То, что фосфор – простое вещество доказал Лавуазье.
Название «фосфор» происходит от греческих слов «фос» – свет и «феро» – несу.
Слайд 3
Строение
На внешнем энергетическом уровне атома фосфора содержится 5 электронов,
которые имеют электронную конфигурацию 3s23p3. Фосфор проявляет степени окисления
-3, +3, +5. Фосфор – типичный неметалл, в зависимости от типа превращения элемент может быть окислителем и восстановителем.
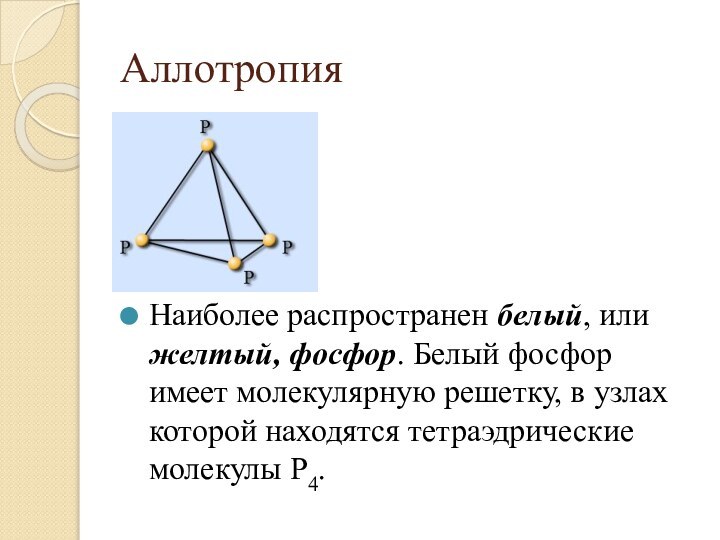
Наиболее распространен белый, или желтый, фосфор.
Белый фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические молекулы Р4.
Слайд 5
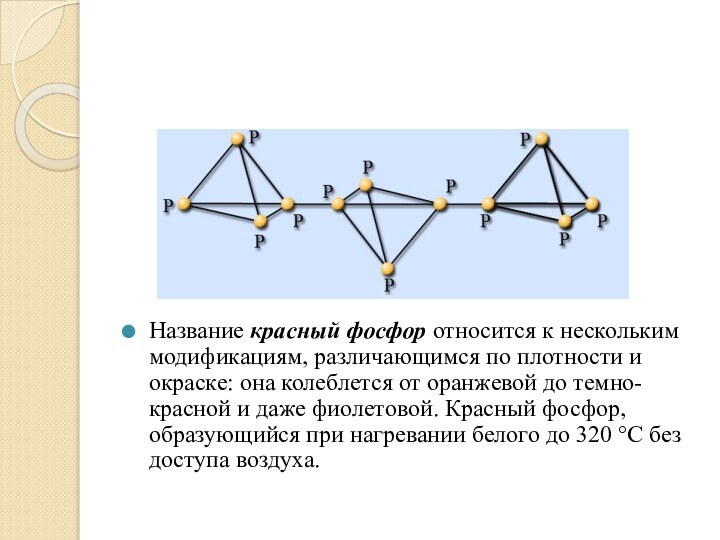
Название красный фосфор относится к нескольким модификациям, различающимся
по плотности и окраске: она колеблется от оранжевой до
темно-красной и даже фиолетовой. Красный фосфор, образующийся при нагревании белого до 320 °С без доступа воздуха.
Слайд 6
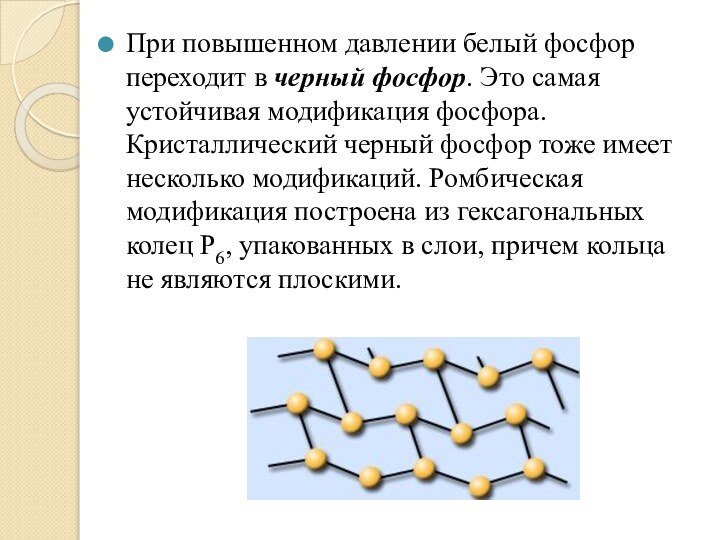
При повышенном давлении белый фосфор переходит в черный
фосфор. Это самая устойчивая модификация фосфора. Кристаллический черный фосфор
тоже имеет несколько модификаций. Ромбическая модификация построена из гексагональных колец Р6, упакованных в слои, причем кольца не являются плоскими.
Слайд 7
Получение
Фосфор получают из апатитов или фосфоритов в результате
взаимодействия с коксом и песком при температуре 1500 °С:
2Ca3(PO4)2 +
10C + 6SiO2 = 4P + 10CO + 6CaSiO3.
Образующиеся пары белого фосфора конденсируются в приемнике под водой.
Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
4HPO3 + 12C = 4P + 2H2 + 12CO.
Слайд 8
Химические свойства
Взаимодействие с простыми веществами Фосфор легко окисляется
кислородом:
4P + 5O2 = 2P2O5,
4P + 3O2 = 2P2O3.
с
металлами – окислитель, образует фосфиды:
2P + 3Ca = Ca3P2.
Слайд 9
с неметаллами – восстановитель :
2P + 3S =
P2S3,
2P + 3Cl2 = 2PCl3.
Взаимодействует с водой, при этом
диспропорционирует:
4Р + 6Н2О = РН3 + 3Н3РО2 (фосфорноватистая кислота).
В растворах щелочей диспропорционирование происходит в большей степени:
4Р + 3KOH + 3Н2О = РН3 + 3KН2РО2 .
Сильные окислители превращают фосфор в фосфорную кислоту:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO;
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O.
6P + 5KClO3 = 5KCl + 3P2O5.
Слайд 10
Соединения фосфора
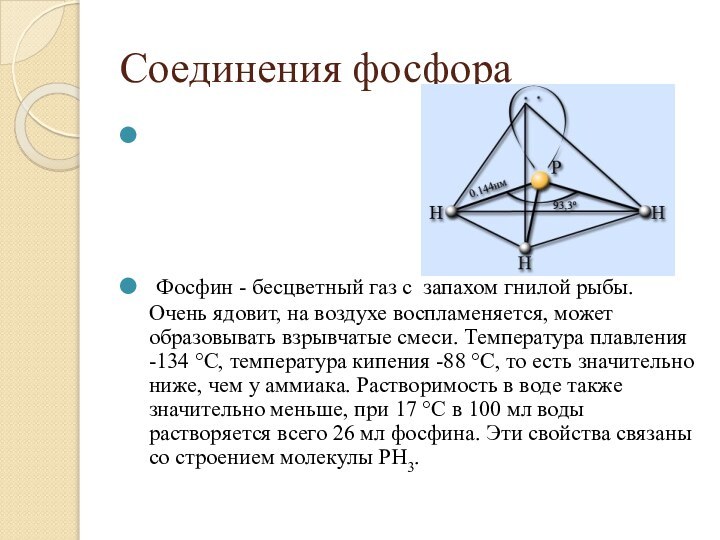
Фосфин - бесцветный газ с запахом гнилой рыбы. Очень ядовит, на воздухе воспламеняется, может образовывать взрывчатые смеси. Температура плавления -134 °С, температура кипения -88 °С, то есть значительно ниже, чем у аммиака. Растворимость в воде также значительно меньше, при 17 °С в 100 мл воды растворяется всего 26 мл фосфина. Эти свойства связаны со строением молекулы РН3.
Слайд 11
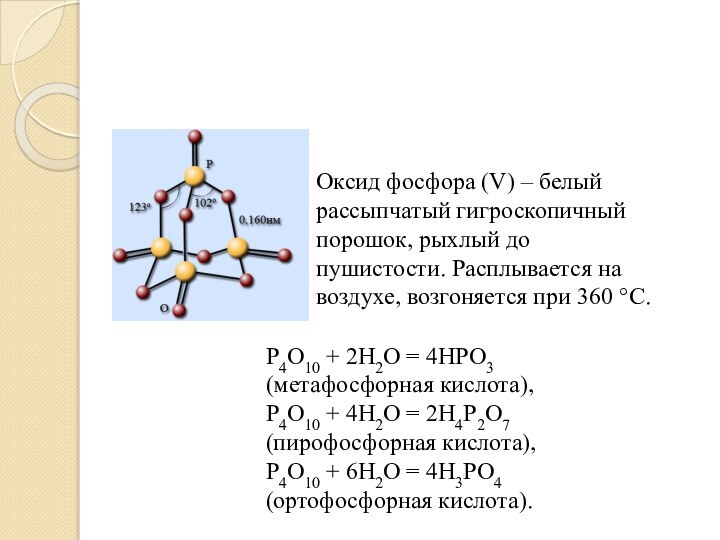
Оксид фосфора (V) – белый рассыпчатый гигроскопичный порошок,
рыхлый до пушистости. Расплывается на воздухе, возгоняется при 360 °С.
P4O10
+ 2H2O = 4HPO3 (метафосфорная кислота),
P4O10 + 4H2O = 2H4P2O7 (пирофосфорная кислота),
P4O10 + 6H2O = 4H3PO4 (ортофосфорная кислота).
Слайд 12
Свойства кислотного оксида Типичный кислотный оксид:
6CaO + P4O10
= 2Ca3(PO4)2,
6Ca(OH)2 + P4O10 = 2Ca3(PO4)2 + 6H2O.
Водоотнимающее свойство
Эффективное водоотнимающее средство, способен превращать азотную и серную кислоты в оксиды:
2HNO3 + P2O5 = 2HPO3 + N2O5;
H2SO4 + P2O5 = 2HPO3 + SO3.
Получается при горении фосфора в избытке кислорода:
4Р + 2О5 = Р4О10.
Слайд 13
Фосфорноватистая кислота – это белые кристаллы, хорошо растворимые
в воде и в органических растворителях. Температура плавления 27 °С.
Химические
свойства
Одноосновная кислота средней силы. Очень сильный восстановитель:
5H3PO2 + 4KMnO4 + 6H2SO4 = 5H3PO4 + 4MnSO4 + 2K2SO4 + 6H2O.
При температуре около 50 °С разлагается:
3H3PO2 = PH3 + 2H3PO3.
Соли – гипофосфиты. Практически все хорошо растворимы в воде, соли переходных металлов мгновенно разлагаются.
Получение
При диспропорционировании белого фосфора в концентрированной щелочи образуется гипофосфит – соль фосфорноватистой кислоты, раствор кислоты легко получается действием серной кислоты на гипофосфит:
2P4 + 3Ba(OH)2 + 6H2O = PH3 + 3Ba(H2PO2)2;
Ba(H2PO2)2 + H2SO4 = 2H3PO2 + BaSO4.
Слайд 14
Фосфористая кислота – это бесцветные кристаллы, хорошо растворимые
в воде и спирте, температура плавления 74 °С, температура разложения
197 °С.
Химические свойства
Двухосновная кислота средней силы. Является хорошим восстановителем, хотя и менее сильным, чем фосфорноватистая кислота, она также обесцвечивает раствор перманганата калия:
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + 2MnSO4 + K2SO4 + 3H2O.
При нагревании до 200 °С разлагается:
4H3PO3 = PH3 + 3H3PO4.
Соли – фосфиты и гидрофосфиты. Практически все хорошо растворимы в воде, соли переходных металлов разлагаются: при незначительном нагревании:
Ag2HPO3 = 2Ag + HPO3.
Получение
Образуется при гидролизе трихлорида фосфора:
PCl3 + 3H2O = H3PO3 + 3HCl.
Слайд 15
При комнатной температуре довольно инертна, при нагревании проявляет
свойства кислот, относится к кислотам средней силы.
Диссоциация в водном
растворе:
Н3РО4 = Н2РО4- + Н+
Н2РО4- = НРО42- + Н+
НРО42- = РО43-+ Н+
Суммарное уравнение:
Н3РО4 = РО43- + 3Н+.
Свойства кислоты Реагирует с металлами, стоящими в ряду напряжений металлов до водорода:
3Zn + 2H3PO4 = Zn3(PO4)2 + 3H2.
С оксидами металлов:
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O.
С основаниями:
3Ca(OН)2 + 2H3PO4 = Ca3(PO4)2 + 6Н2О;
Ca(OН)2 + H3PO4 = CaНPO4 + 2Н2О;
Ca(OН)2 + 2H3PO4 = Ca(Н2PO4)2 + 2Н2О.
Не проявляет ни окислительных, ни восстановительных свойств.
Слайд 16
Термический способ получения фосфорной кислоты основан на окислении
элементарного фосфора в избытке воздуха с последующей гидратацией и
образующегося оксида фосфора (V) и конденсацией фосфорной кислоты:
4Р + 5О2 = Р4О10;
nР4О10 + 2nH2O = 4(HPO3)n при 700 °С,
4(HPO3)n + 2nH2O = 2nH4P2O7 при 450 °С,
2nH4P2O7 + 2nH2O = 4nH3PO4 ниже 230 °С.
Суммарное уравнение:
Р4О10 + 6H2O = 4H3PO4.
Также ортофосфорную кислоту получают при переработке апатитов:
Ca5(PO4)3F + 5H2SO4 + 10H2O = 5CaSO4·2H2O + 3H3PO4 + HF.