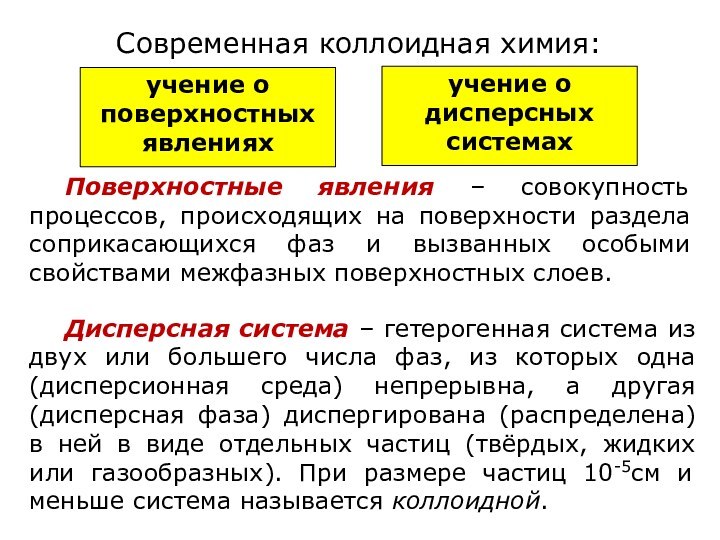
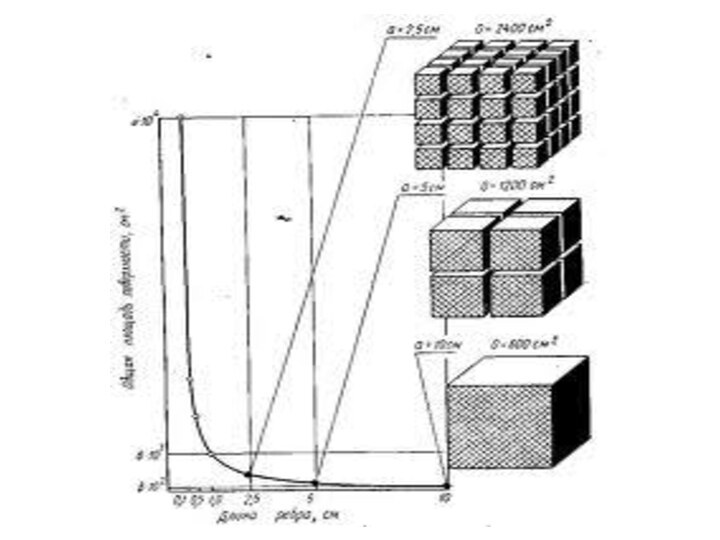
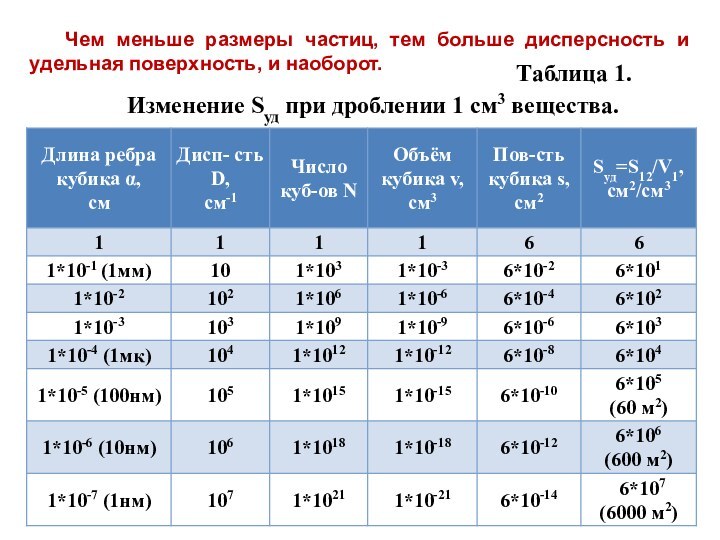
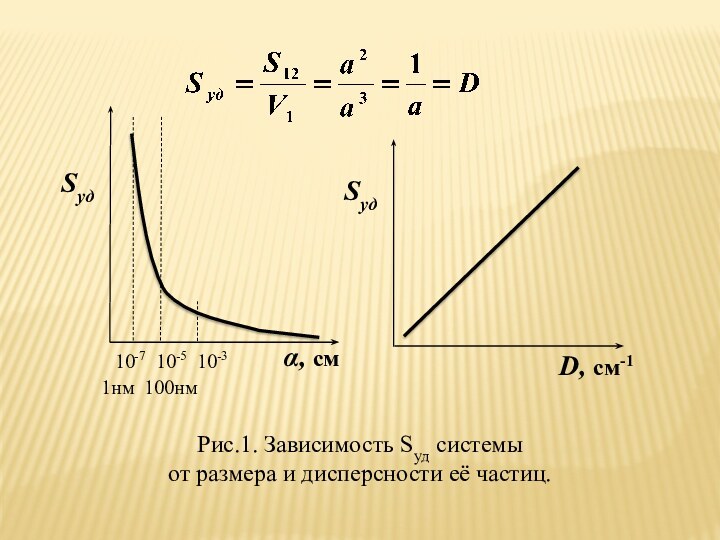
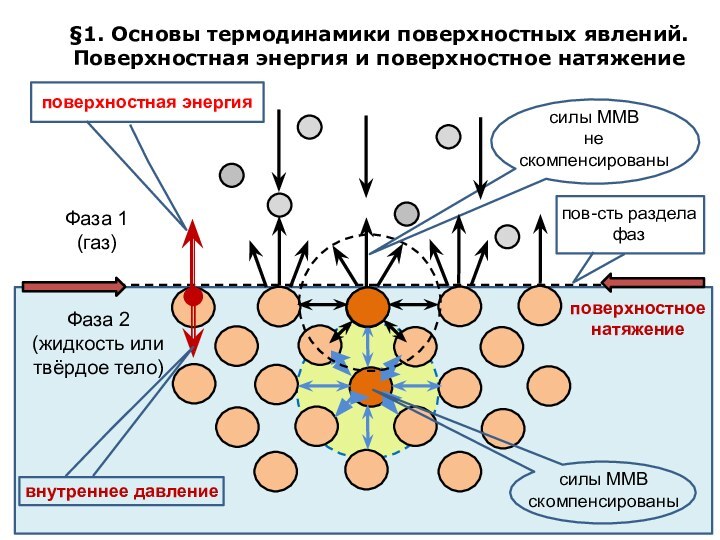
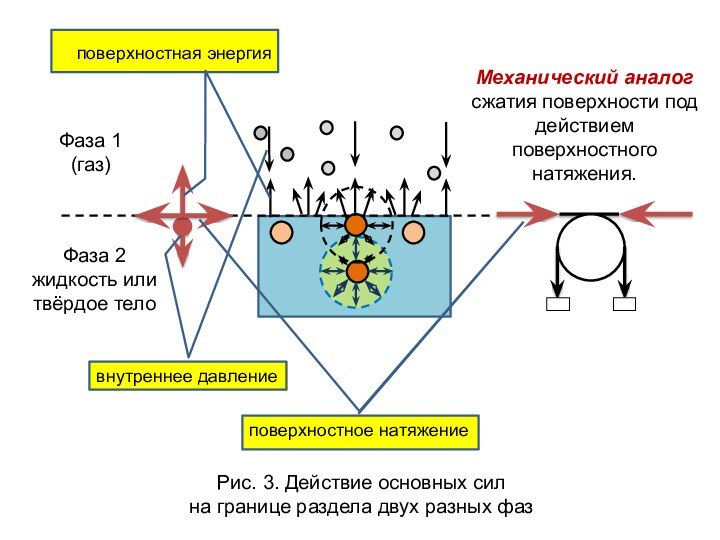
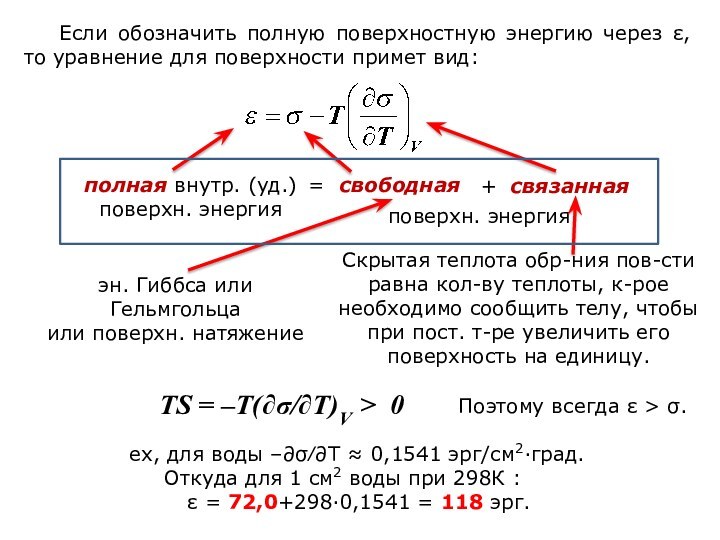
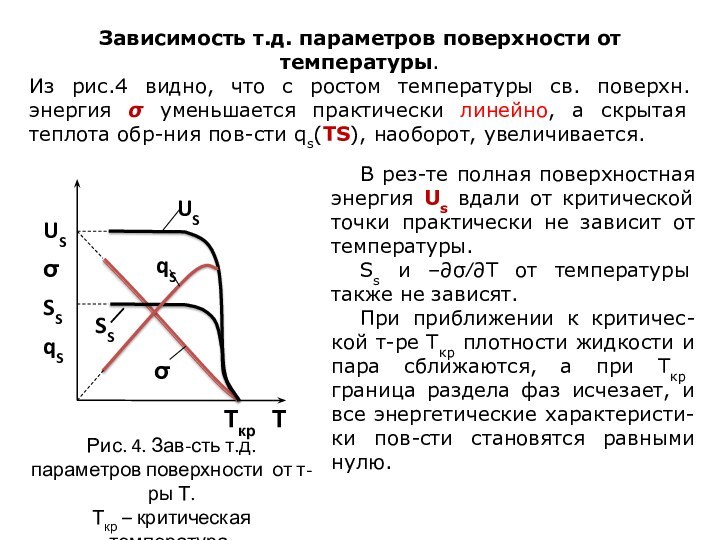
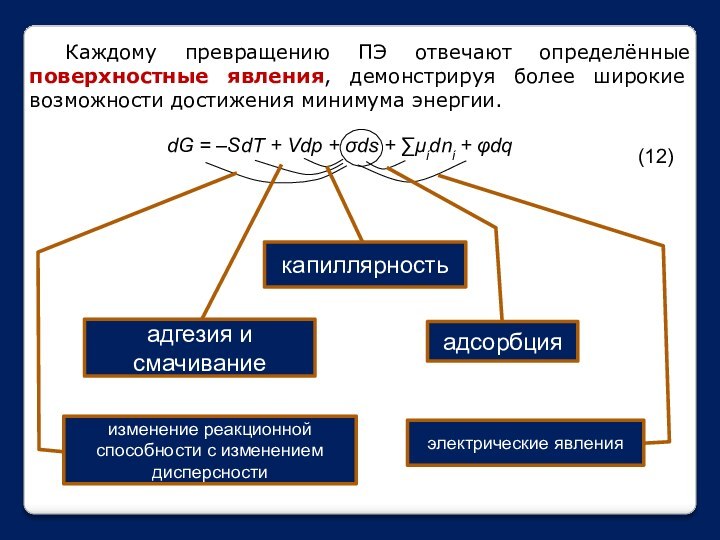
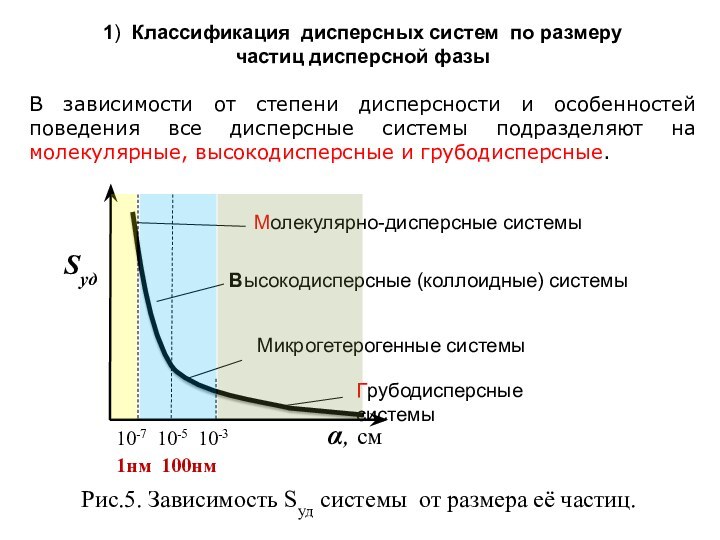
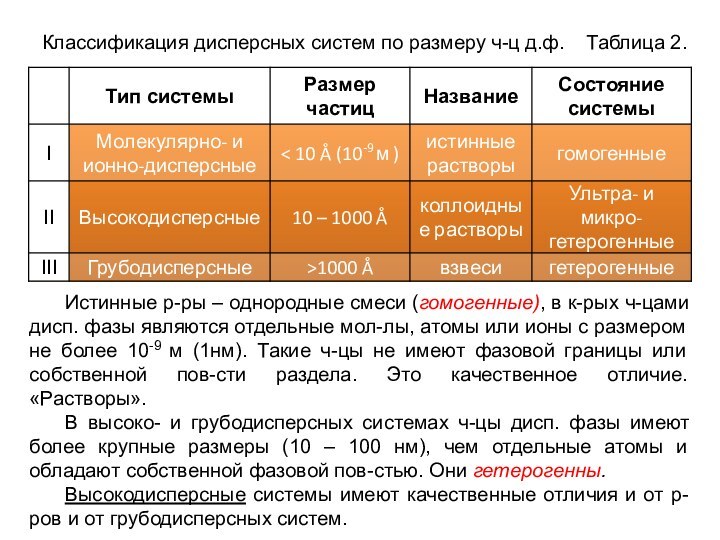
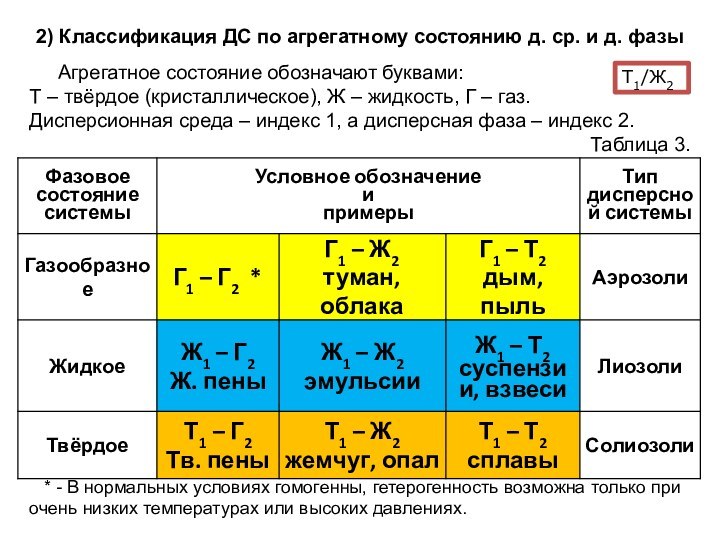
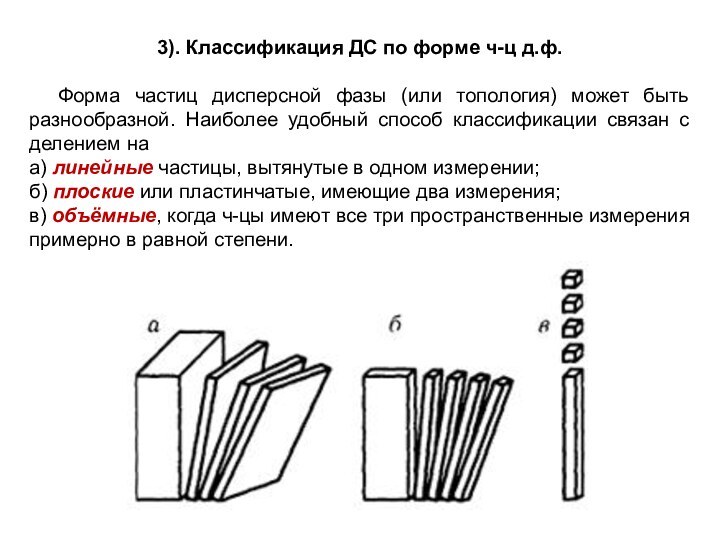
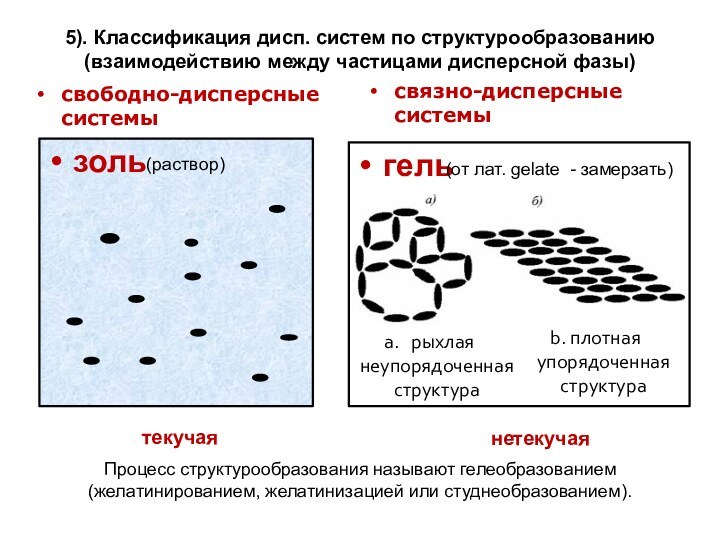
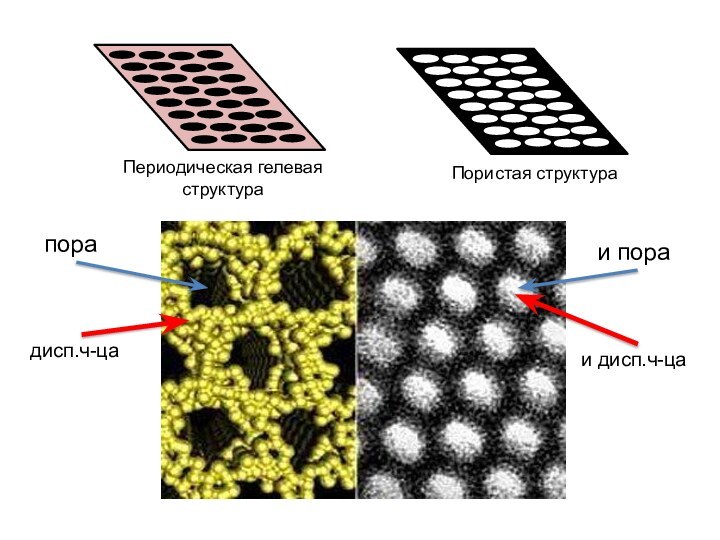
означает клееподобные тела (от греческого «æολλα» или латинского «colla»
- клей). Томас Грэм (1861г.).Дата возникновения как самостоятельной науки 1906 год,
в Лейпциге начал выходить журнал «Коллоидцайтшрифт»
(В.Ф. Оствальд).
Краткий исторический экскурс
Накопленный экспериментальный материал указывал на особые св-ва некоторых в-в и их р-ров: сами эти в-ва (желатина, крахмал, яичный белок) обладали клееподобными св-вами, не фильтровались в растворах через мембраны (пергаментную плёнку), а их р-ры рассеивали свет.
Т. Грэм выделил такие в-ва в особую группу в-в (коллоиды), в отличие от в-в первой группы - хорошо кристаллизирующихся и диффундирующих в р-рах через мембраны – (кристаллоиды).