- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему МИАСТЕНИЯ и МИАСТЕНИЧЕСКИЕ СИНДРОМЫ
Содержание
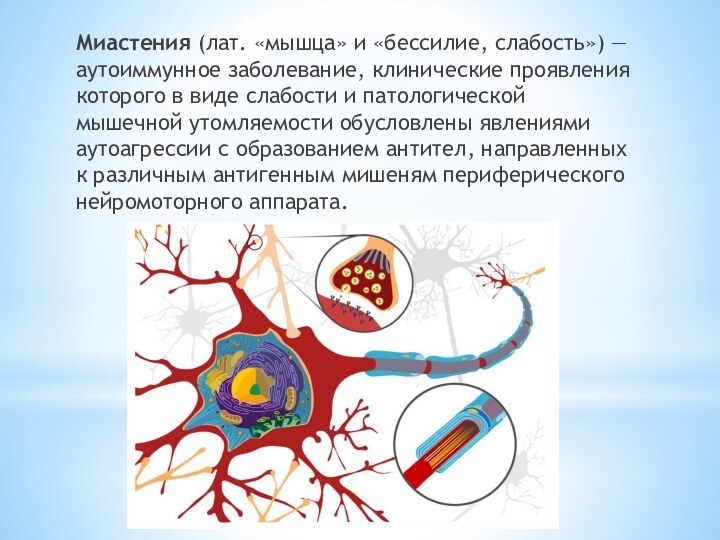
- 2. Миастения (лат. «мышца» и «бессилие, слабость») —аутоиммунное заболевание,
- 3. ЭпидемиологияЗаболеваемость - 6-7 человек на каждые 100
- 4. ИсторияВпервые заболевание было описано Томасом Уиллисом в
- 5. Физиология нервно-мышечного синапсаОсвобождения медиатора из везикул активной
- 6. Этиология
- 7. Антигенные мишени при миастении
- 8. Антитела против ацетилхолиновых рецепторов постсинаптической мембраны нервно-мышечных соединений (синапсов)
- 10. MuSK-белок-мышечная специфическая тирозинкиназа, мембранная белковая молекула, принимает
- 11. Мышечный белок титин - гигантский белок, охватывает
- 12. Рецепторы кальцийвысвобождающих каналов саркоплазматического ретикулума (RyR) –
- 13. Повышение уровня антител к титин-белку и рианодиновым
- 14. Интерлейкин-12-гетеродимерный цитокинструктурная гомология среди ИФ-а, ИФ-w, ИЛ-12
- 15. Ганглиозиды обеспечивают стабильность клеточных мембранВыявление АТ к ганглиозидам миелиновой оболочки нервов
- 16. «Миастенический синапс»Стадии формирования:Деструктивная - первые изменения происходят
- 17. Роль тимуса в патогенезе миастении1.Нарушение толерантности Т-лимфоцитов
- 18. Патологические изменения в вилочковой железе:Гиперплазия вилочковой железы
- 19. Классификация по Б.М. Гехту(1965)1.По характеру течения
- 20. Глазная миастения - Непрогрессирующая форма с поражением
- 21. Миастения с ранним началом заболевания без тимомыБольшинство
- 22. Миастения, сочетающаяся с тимомойСредний возраст у больных
- 23. Миастения с поздним началом заболевания без тимомыВозраст
- 25. Серонегативная миастенияУ 15% больных с миастенией отсутстуют
- 26. ДиагностикаФармакологические тестыЭлектрофизиологическое исследованиеУлучшающие нервно-мышечную передачуБлокирующие нервно-мышечную передачуИммунологические тестыкомпьютерная томография органов средостения
- 27. Блокирующие нервно-мышечную передачуГенерализованная проба с d-тубокурарином: в/в
- 28. Улучшающие нервно-мышечную передачуПроба с прозерином: прозерин в
- 30. Электрофизиологическое исследование-Исследование изменений, вызванных электрических ответов мышцы(М-ответов)
- 32. Миастенический криз - внезапно возникающий
- 33. Причины развитияНесвоевременная постановка диагноза, назначенеие патогенетического лечения
- 34. Предвестники смешанного кризаУкорочение времени действия пролонгированных АХЭП(калимин,
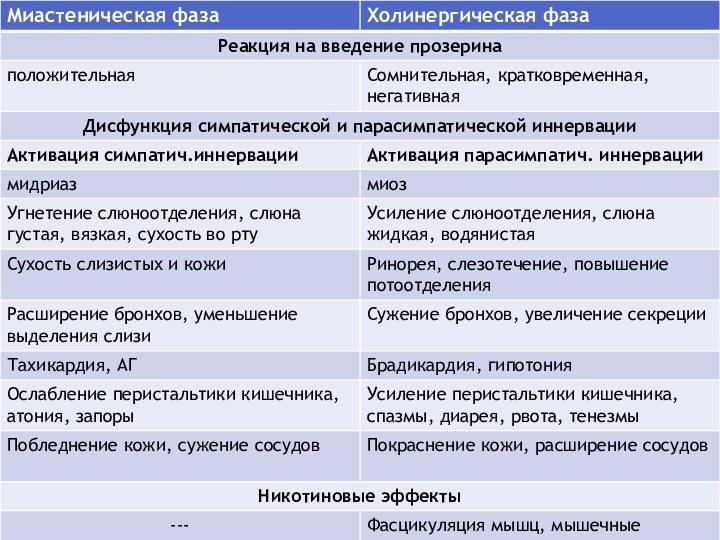
- 35. Диагностика фаз течения смешанного криза
- 36. Лечение кризов при миастенииИВЛ(при нарушении ритма и
- 37. Схема поэтапного патогенетического лечения(Гехт)1. Первый этап(компенсирующая терапия)АХЭП(калимин(местинон)
- 38. 2. Второй этапТимэктомия(удаление источника АГ по отношению
- 39. 3. Третий этап (иммуносупрессорная терапия)В случае недостаточной
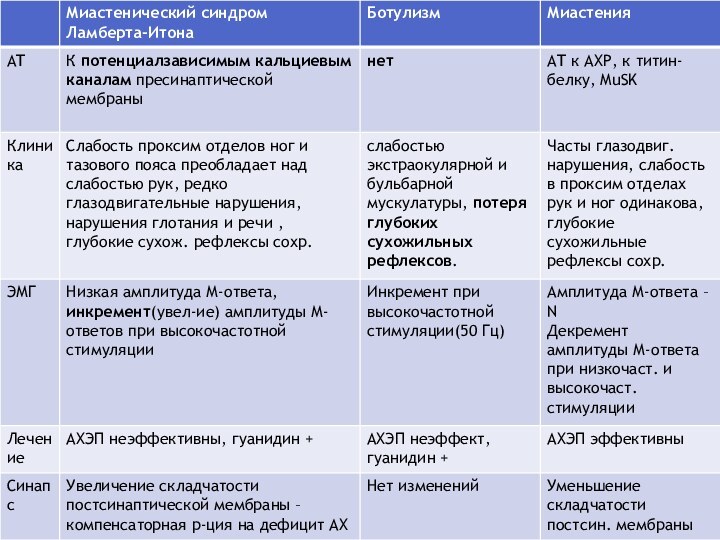
- 40. Дифференциальная диагностика
- 41. Скачать презентацию
- 42. Похожие презентации






















Слайд 3
Эпидемиология
Заболеваемость - 6-7 человек на каждые 100 тыс.
населения.
Женщины болеют миастенией в три раза чаще мужчин.
Пик
заболеваемости - в возрасте от 20 до 40 лет
Слайд 4
История
Впервые заболевание было описано Томасом Уиллисом в 1672 году
В
1899 г. Г. Оппенгайм впервые обратил внимание на связь
миастении с опухолью вилочковой железы - тимомой (у 80 % больных с миастенией обнаруживают опухоль или гиперплазию вилочковой железы).М. Волкер в 1934 г. обнаружила, что клиническая картина миастении имеет много общего с симптомами интоксикации при отравлении ядом кураре и предложила для ее лечения применять антагонист кураре - антихолинэстеразный препарат физостигмин (синтетический аналог прозерина).
В 1960 г. Штраус и соавторы установили, что в крови больных с миастенией обнаруживаются антитела к ткани вилочковой железы и скелетных мышц. Это дало основание считать, что предпосылкой заболевания является аутоиммунный процесс, нарушение нервно-мышечной передачи.
Слайд 5
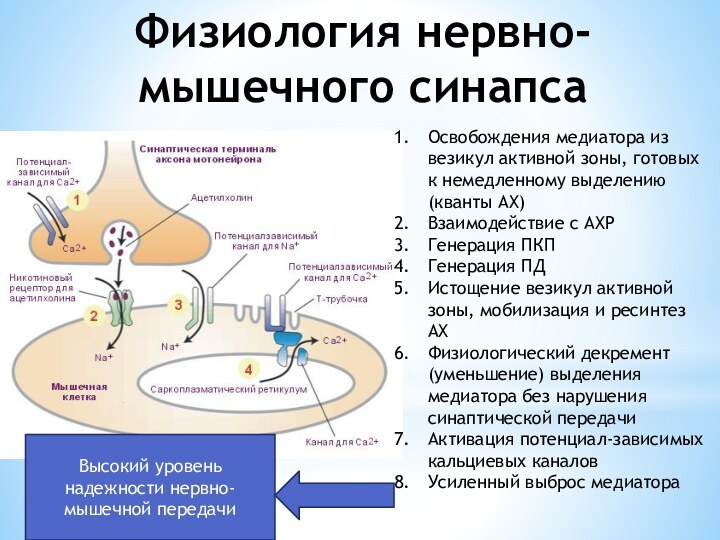
Физиология нервно-мышечного синапса
Освобождения медиатора из везикул активной зоны,
готовых к немедленному выделению(кванты АХ)
Взаимодействие с АХР
Генерация ПКП
Генерация
ПДИстощение везикул активной зоны, мобилизация и ресинтез АХ
Физиологический декремент(уменьшение) выделения медиатора без нарушения синаптической передачи
Активация потенциал-зависимых кальциевых каналов
Усиленный выброс медиатора
Высокий уровень надежности нервно-мышечной передачи
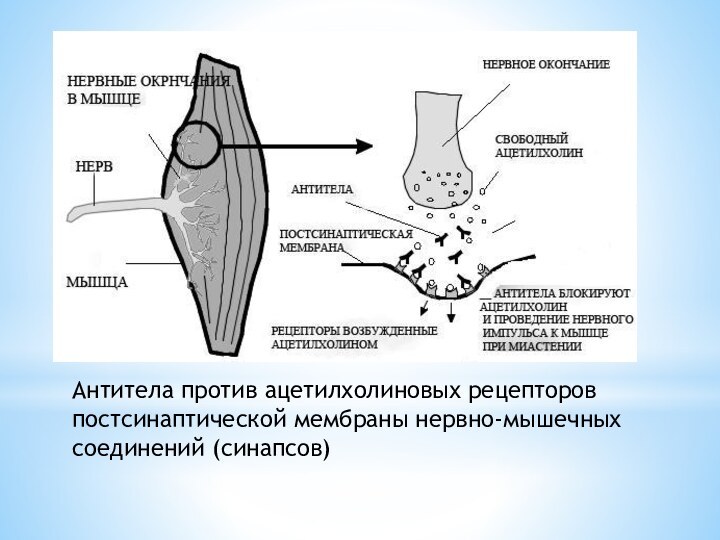
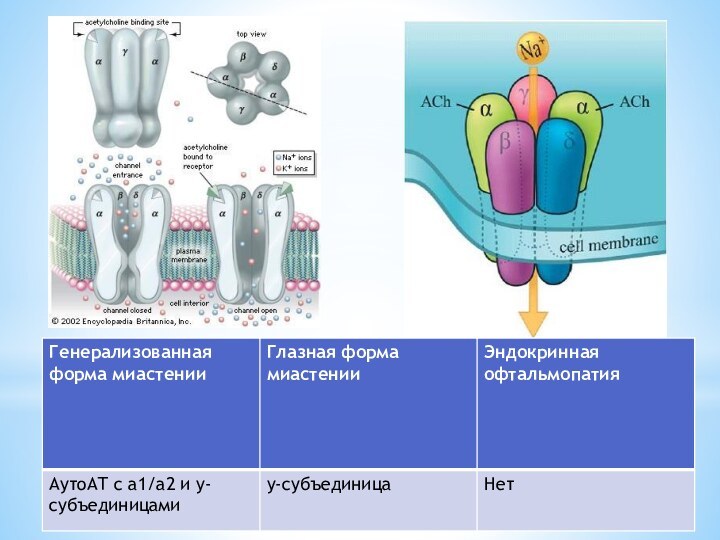
Слайд 8 Антитела против ацетилхолиновых рецепторов постсинаптической мембраны нервно-мышечных соединений
(синапсов)
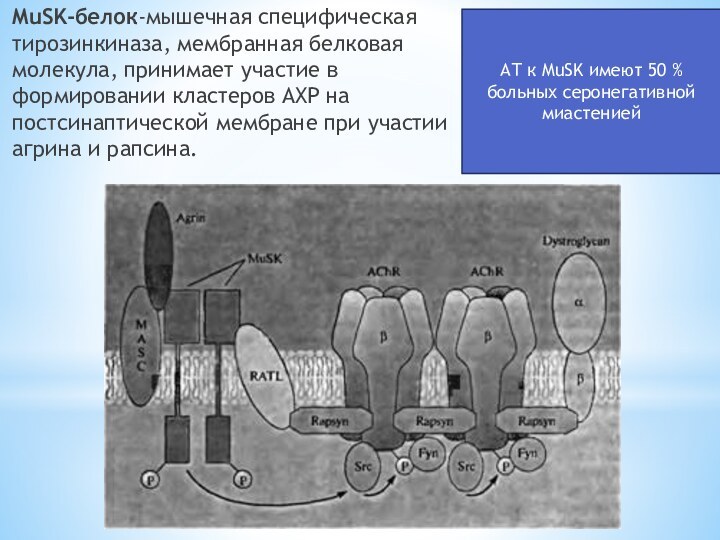
Слайд 10 MuSK-белок-мышечная специфическая тирозинкиназа, мембранная белковая молекула, принимает участие
в формировании кластеров АХР на постсинаптической мембране при участии
агрина и рапсина.АТ к MuSK имеют 50 % больных серонегативной миастенией
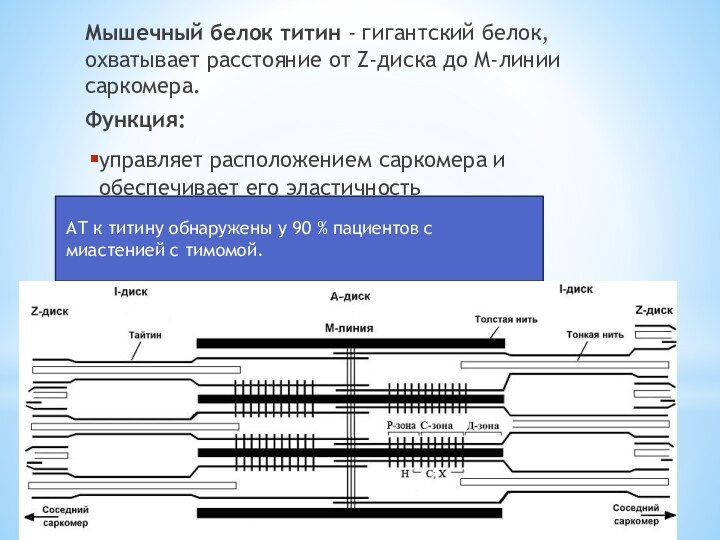
Слайд 11 Мышечный белок титин - гигантский белок, охватывает расстояние
от Z-диска до М-линии саркомера.
Функция:
управляет расположением саркомера и обеспечивает
его эластичностьАТ к титину обнаружены у 90 % пациентов с миастенией с тимомой.
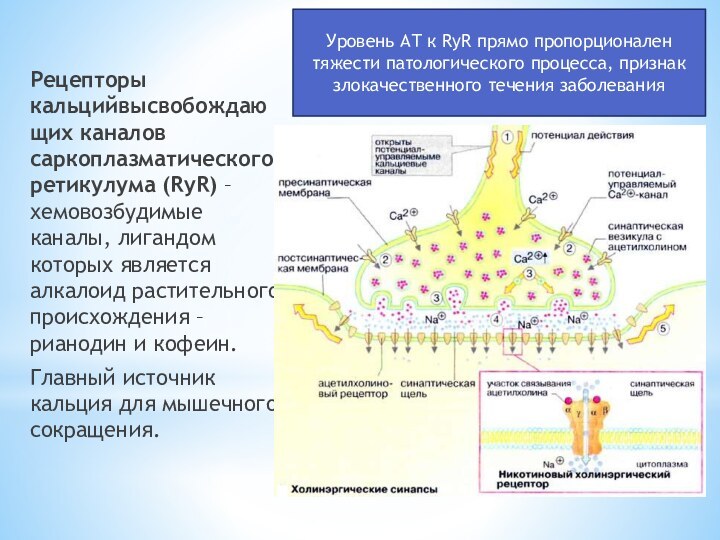
Слайд 12 Рецепторы кальцийвысвобождающих каналов саркоплазматического ретикулума (RyR) – хемовозбудимые
каналы, лигандом которых является алкалоид растительного происхождения – рианодин
и кофеин.Главный источник кальция для мышечного сокращения.
Уровень АТ к RyR прямо пропорционален тяжести патологического процесса, признак злокачественного течения заболевания
Слайд 13 Повышение уровня антител к титин-белку и рианодиновым рецепторам
у больных :
Миастенией, сочетающейся с тимомой
С поздним началом миастении
без тимомыУ больных с серонегативной миастенией
Слайд 14
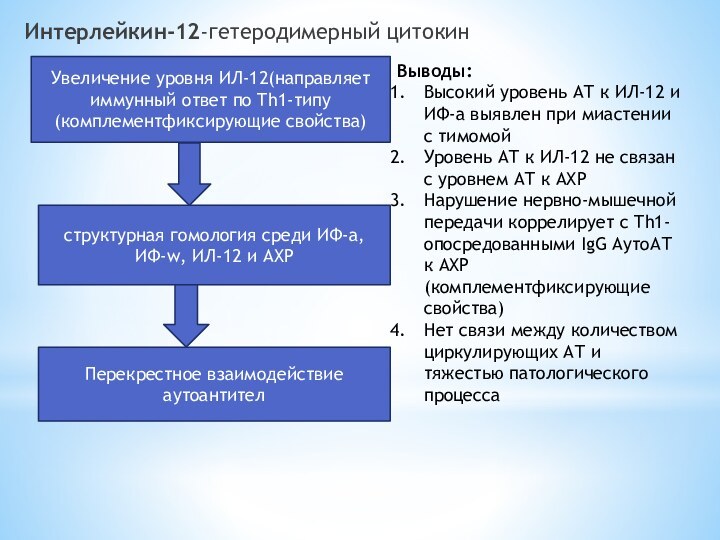
Интерлейкин-12-гетеродимерный цитокин
структурная гомология среди ИФ-а, ИФ-w, ИЛ-12 и
АХР
Перекрестное взаимодействие аутоантител
Увеличение уровня ИЛ-12(направляет иммунный ответ по
Th1-типу(комплементфиксирующие свойства)Выводы:
Высокий уровень АТ к ИЛ-12 и ИФ-а выявлен при миастении с тимомой
Уровень АТ к ИЛ-12 не связан с уровнем АТ к АХР
Нарушение нервно-мышечной передачи коррелирует с Th1-опосредованными IgG АутоАТ к АХР(комплементфиксирующие свойства)
Нет связи между количеством циркулирующих АТ и тяжестью патологического процесса
Слайд 15
Ганглиозиды обеспечивают стабильность клеточных мембран
Выявление АТ к ганглиозидам
миелиновой оболочки нервов
Слайд 16
«Миастенический синапс»
Стадии формирования:
Деструктивная - первые изменения происходят в
складках постсинаптической мембраны, далее происходит полное разрушение синаптических складок
и потивостоящих им терминалей аксонаДеструктивно - регенераторная-параллельно с деструктивными протекают регенераторные процессы(рост терминалей аксона, которые образуют новые синаптические контакты, расширение синаптической зоны, формирование новых синаптических складок, они неглубокие, немногочисленные)
Миастеническая – характерно формирование миастенического синапса
синаптическая щель расширена
синаптические складки неглубокие, в некоторых местах отсутствуют
длина постсинаптической мембраны в расчете на одну терминаль аксона уменьшена
количество синаптических везикул на одну терминаль аксона нормальное
уменьшение плотности холинорецепторов на постсинаптической мембране
Слайд 17
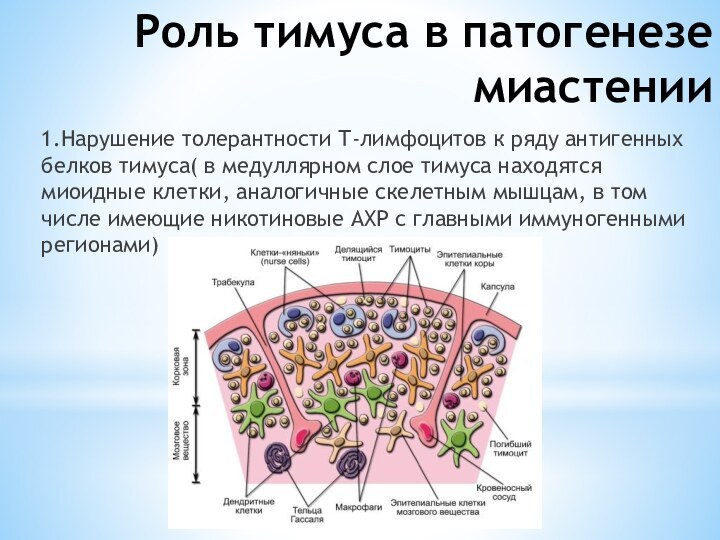
Роль тимуса в патогенезе миастении
1.Нарушение толерантности Т-лимфоцитов к
ряду антигенных белков тимуса( в медуллярном слое тимуса находятся
миоидные клетки, аналогичные скелетным мышцам, в том числе имеющие никотиновые АХР с главными иммуногенными регионами)
Слайд 18
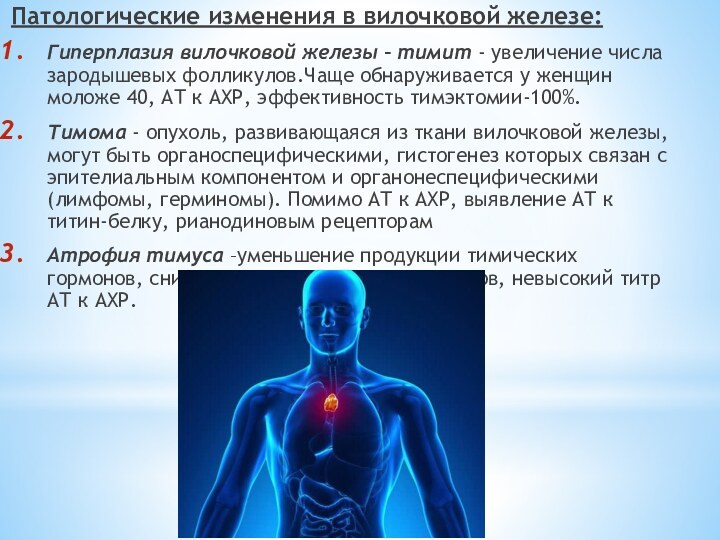
Патологические изменения в вилочковой железе:
Гиперплазия вилочковой железы –
тимит - увеличение числа зародышевых фолликулов.Чаще обнаруживается у женщин
моложе 40, АТ к АХР, эффективность тимэктомии-100%.Тимома - опухоль, развивающаяся из ткани вилочковой железы, могут быть органоспецифическими, гистогенез которых связан с эпителиальным компонентом и органонеспецифическими (лимфомы, герминомы). Помимо АТ к АХР, выявление АТ к титин-белку, рианодиновым рецепторам
Атрофия тимуса –уменьшение продукции тимических гормонов, снижение активности Т-супрессоров, невысокий титр АТ к АХР.
Слайд 19
Классификация по
Б.М. Гехту(1965)
1.По характеру течения болезни:
Миастенические эпизоды
– преходящие
двигательные нарушения с полным регрессом (10-12%).
Миастенические состояния
- стационарная непрогрессирующаяформа в течение многих лет (13%).
Прогрессирующую форму - неуклонное прогрессирование заболевания (50-48%).
Злокачественную форму - острое начало и быстрое нарастание нарушения функции мышц (25%).
2.По степени генерализации процесса
Локальные(ограниченные): глазная, бульбарная, лицевая, краниальная, туловищная
Генерализованные: без бульбарных нарушений, с бульбарными нарушениями, с нарушениями дыхания(периодическими дыхательными кризами)
3.По степени тяжести двигательных расстройств
Легкая
Средней тяжести
Тяжелая
4.По степени компенсации двигательных нарушений
Полная
Достаточная
плохая
Слайд 20
Глазная миастения -
Непрогрессирующая форма с поражением глазных
мышц и мышц век
Клинические проявления:
асимметричный птоз и офтальмопарез носят
динамичный характер и изменяются после отдыха и физической нагрузкидвоение в глазах
сложность в фокусировке взгляда
невозможность долго смотреть на объекты, расположенные очень далеко или очень близко
Диагностика:
Незначительно повышенные титры АТ к АХР(в отличии от генерализованной формы)
Наличие специфических аутоантител к
y-субъединице АХР – экспресс метод диагностики
Слайд 21
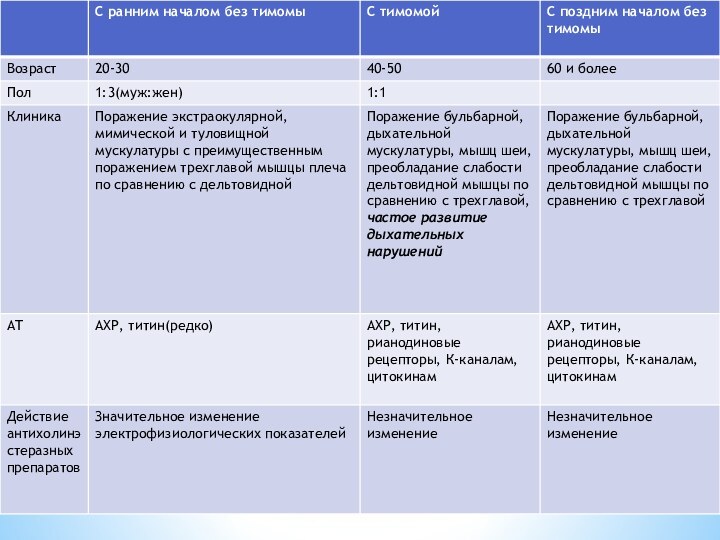
Миастения с ранним началом заболевания без тимомы
Большинство больных
с генерализованной формой миастении
Обычное для миастении соотношение мужчин и
женщин (1:3), возраст 20-30 летПоражение экстраокулярной, мимической и туловищной мускулатуры(слабость проксимальных отделов мышц конечностей- трудно подняться по лестнице, подняться со стула, поднимать руки вверх), с преимущественным поражением трехглавой мышцы плеча по сравнению с дельтовидной
Декремент амплитуды М-ответа и несколько сниженные параметры ПДЕ(потенциалов двигательных единиц) полностью приходят в норму после введения антихолинэстеразных препаротов
85%-АТ к АХР-рецепторам
40%-АТ к титин-белку
Нет никакой корреляции между тяжестью клинических проявлений и уровнем АТ к АХР и поперечно-полосатой мускулатуре
Слайд 22
Миастения, сочетающаяся с тимомой
Средний возраст у больных 40-50
лет, соотношение мужчин и женщин составляет 1:1
Клинические проявления определяются
не фактором наличия опухоли, а особенностями иммунного ответаПоражение бульбарной (изменение голоса, трудность жевания твердой пищи, дисфагия, то есть нарушение глотания, дизартрия, трудно выговаривать «Р», «Ш», «С») дыхательной мускулатуры, мышц шеи (трудности в удерживании головы), преобладание слабости дельтовидной мышцы по сравнению с трехглавой
Выявляется широкий спектр аутоантител:
АТ к АХР-100%
АТ к титину-80%
АТ к рианодиновым рецепторам-35%
АТ к нейрональным субъединицам АХР, потенциалзависимым калиевым каналам, цитокинам.Как следствие, возможность таких клинических проявлений, как миозит, миокардит, нейромиотония
Слайд 23
Миастения с поздним началом заболевания без тимомы
Возраст больных
старше 60 лет
Широкий спектр аутоантител(к АХР, титину, миазину, рианодиновым
рецептора)Поражение жевательной, дыхательной мускулатуры, мышц шеи, преобладание слабости дельтовидной мышцы по сравнению с трехглавой
Введение прозерина значительно не изменяет электрофизиологических показателей, т.к. есть поражение мышечного субстрата(миастеническая миопатия)
Слайд 25
Серонегативная миастения
У 15% больных с миастенией отсутстуют АТ
к АХР
У 1/3 больных СН миастенией выявлены АТ к
MuSK-рецепторам постсинаптической мембраны, играющих роль в образовании кластеров АХР и дифференцировке постсинаптических белков, это приводит к поражению АХР как ионного канала(нарушается натриевый ток), происходит фосфорилирование и десенситизация АХР, не происходит уменьшение плотности АХРТимома никогда не обнаруживается при СН-миастении
Преимущественное вовлечение в процесс мимической и бульбарной мускулатуры, мышц шеи, при редком поражении экстраокулярных и туловищных мышц
Отсутствие или небольшой декремент М-ответа
Негативный реакция на антихолинэстеразные препараты
Резистентность к традиционной патогенетической терапии: слабая или негативная реакция на АХЭП( выраженные проявления холинэргической интоксикации в виде фасцикуляций и миокимий), недостаточный эффект на глюкокортикоидную терапию, отсутствие ответа на тимэктомию
Слайд 26
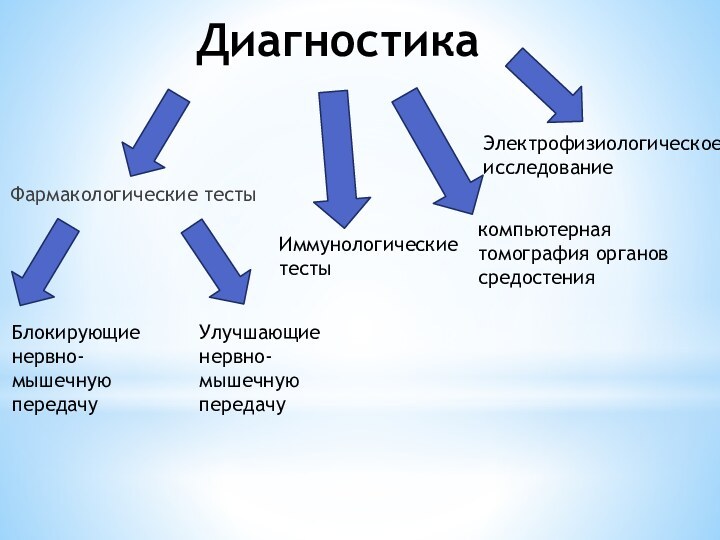
Диагностика
Фармакологические тесты
Электрофизиологическое исследование
Улучшающие нервно-мышечную передачу
Блокирующие нервно-мышечную передачу
Иммунологические тесты
компьютерная
томография органов средостения
Слайд 27
Блокирующие нервно-мышечную передачу
Генерализованная проба с d-тубокурарином: в/в введение
каждые 2 мин в количестве 1/80 от нормальной кураризирующей
дозы, непосредственно перед каждым следующим введением определяется сила мышцРегиональный кураре-тест: определяют силу кистей рук, накладывают манжету на поднятую вверх руку, в поверхностную вену кисти вводят 0,2 мг тубокурарина, ишемию поддерживают 5 минут, затем на 7, 11, 19 мин определяют силу кисти
Слайд 28
Улучшающие нервно-мышечную передачу
Проба с прозерином: прозерин в дозе
1,5 мл 0,05% или калимин-форте в дозе 10 мг
вводят подкожно при весе больного50-60 кг, в дозе 2,0 мл или 20 мг- при весе 60-80 кг, 2,5 мл или 30 мг при весе 80-100 кг. Оценка теста проводится через 40-1,5 часа после введение.Компенсация двигательных нарушений:
Полная (сила 5 баллов) – 15%
Неполная (увеличение на 2-3 балла) – 75%
Частичная( увеличение на 1 балл)
Оценка пробы:
Позитивная(при полной и неполной)
Сомнительная ( при частичной)
Негативная ( при отсутствии)
Слайд 30
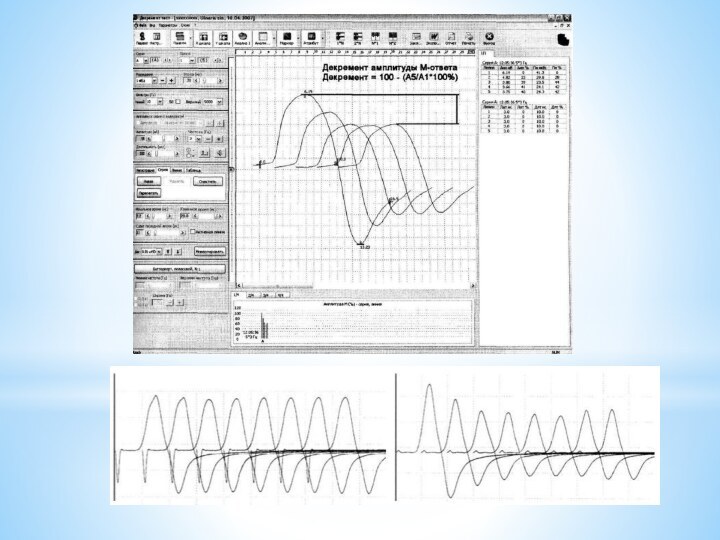
Электрофизиологическое исследование-
Исследование изменений, вызванных электрических ответов мышцы(М-ответов) при
ее непрямой супрамаксимальной стимуляции различными частотами, так называемый декремент-тест
Выбор
наиболее пораженной мышцыИммобилизация исследуемой конечности
Измерение негативной фазы амплитуды М-ответа в ответ на одиночный супрамаксимальный стимул в мВ( уменьшение амплитуды-снижение надежности нервно-мышечной передачи, преимущественное снижение в проксимальных мышцах, но в основном этот показатель в норме)
Измерение величины декремента амплитуды М-ответа при стимуляции мышцы частотой 3 имп/с в процентах по отношению пятого М-ответа к первому(величина декремента более 10% указывает на миастению)
Исследование изменения амплитуды М-ответа при стимуляции частотой 3 имп/с через 2 с после окончания тетанической серии(посттетаническое облегчение-следствие активации ранее не включенных в активность мышечных волокон, что связано с увеличением внутриклеточного кальция) Низкая амплитуда М-ответа-нарушение процессов выделения медиатора
Исследование амплитуды М-ответа и величины декремента при стимуляции частотой 3 имп/с через 3 мин после облегчения(посттетаническое истощение) в проценттах по отношению пятого М- ответа к первому. Наиболее выражено в дистальных мышцах
Слайд 32
Миастенический криз -
внезапно возникающий приступ слабости, сосредоточенный в
области глоточных и дыхательных мышц , сопровождающийся нарушением витальных
функцийПатогенез:
Появление блокирующих антител , приводящих к изменению функционального состояния оставшихся рецепторов и ионных каналов
Является смешанным, состоит из двух фаз:
миастеническая—проявляется усугублением бульбарных и дыхательных нарушений, генерализацией двигательных расстройств и адекватной реакцией на прием АХЭП
холинергическая характеризуется слюнотечением ,подергиванием мышц, диареей и резким снижением эффективности антихолинэстеразных препаратов, которые потенцируют клинические проявления холинергической интоксикации
Слайд 33
Причины развития
Несвоевременная постановка диагноза, назначенеие патогенетического лечения в
тяжелом состоянии
Начало иммуносупрессивной терапии с «пульсотерапии» преднизалоном, монотерапии циклофосфаном
Злокачественная
тимомаТимэктомия
Беременность, роды
Общий наркоз
ОРВИ
Обострение сопутствующих хронических аутоиммунных заболеваний
Обострение сопутствующих хронических инфекционных заболеваний
Обострение онкологических заболеваний
Назначение препаратов, противопоказанных при миастении: мерказолил, противотуберкулезные препараты, магнезия
На фоне отмены(уменьшения дозы) глюкокортикоидов
Без видимой причины
Слайд 34
Предвестники смешанного криза
Укорочение времени действия пролонгированных АХЭП(калимин, местинол)
менее 3ч
Увеличение однократной дозы приемв препарата на 100-200%
М
и Н-холинергические побочные эффекты
Слайд 36
Лечение кризов при миастении
ИВЛ(при нарушении ритма и глубины
дыхания, ЧД более 40 в 1 мин , цианоз,
отсутсвие реакции на АХЭП, изменения газового состава крови)Плазмафарез
Иммуноглобулины(если противопоказан плазмофорез)
Антихолинэстеразные препараты(только в качестве диагностической пробы, в период максимальной выраженности симптомов, при ИВЛ противопоказаны)
Хлорид калия
Верошпирон
Антиоксиданты(эспа-липон, тиогамма, берлитион)
Слайд 37
Схема поэтапного патогенетического лечения(Гехт)
1. Первый этап(компенсирующая терапия)
АХЭП(калимин(местинон) 60:
принимают перорально в максимальной суточной дозе 240-360 мг, или
однократно 30-120 мгХлорид калия(калий-нормин, калинор) в порошке по 1 г 3 р в сутки
Верошпирон(альдактон, спиронолактон)- т.к. задерживает калий в клетках по 0,025-0,05 г 3-4 р в день
Слайд 38
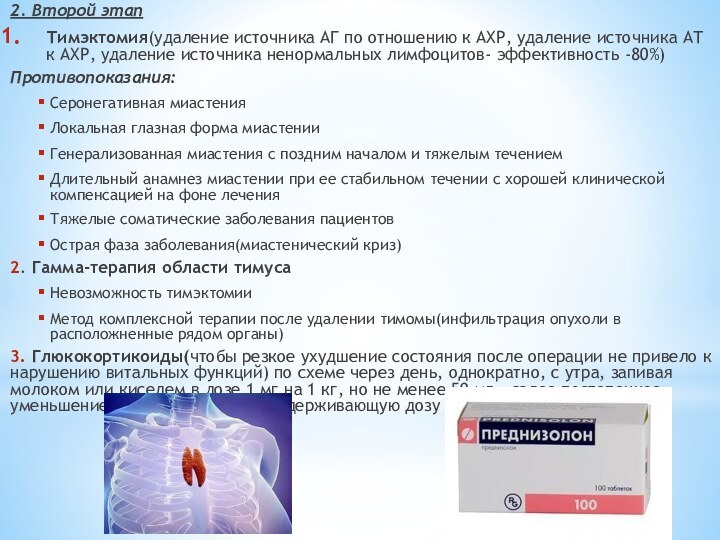
2. Второй этап
Тимэктомия(удаление источника АГ по отношению к
АХР, удаление источника АТ к АХР, удаление источника ненормальных
лимфоцитов- эффективность -80%)Противопоказания:
Серонегативная миастения
Локальная глазная форма миастении
Генерализованная миастения с поздним началом и тяжелым течением
Длительный анамнез миастении при ее стабильном течении с хорошей клинической компенсацией на фоне лечения
Тяжелые соматические заболевания пациентов
Острая фаза заболевания(миастенический криз)
2. Гамма-терапия области тимуса
Невозможность тимэктомии
Метод комплексной терапии после удалении тимомы(инфильтрация опухоли в расположненные рядом органы)
3. Глюкокортикоиды(чтобы резкое ухудшение состояния после операции не привело к нарушению витальных функций) по схеме через день, однократно, с утра, запивая молоком или киселем в дозе 1 мг на 1 кг, но не менее 50 мг , далее постепенное уменьшение дозы, переход на поддерживающую дозу
Слайд 39
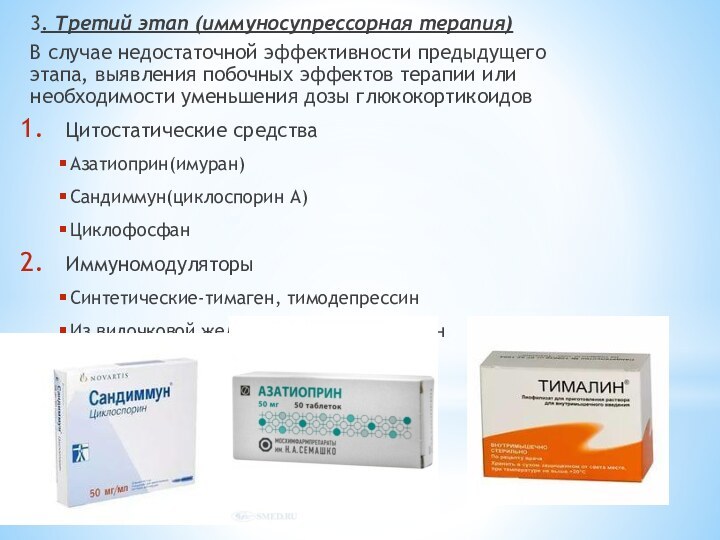
3. Третий этап (иммуносупрессорная терапия)
В случае недостаточной эффективности
предыдущего этапа, выявления побочных эффектов терапии или необходимости уменьшения
дозы глюкокортикоидовЦитостатические средства
Азатиоприн(имуран)
Сандиммун(циклоспорин А)
Циклофосфан
Иммуномодуляторы
Синтетические-тимаген, тимодепрессин
Из вилочковой железы-тималин, Т-активин