Слайд 2
Вопросы
Общая характеристика элементов побочной подгруппы V и
VΙ групп
Физические свойства и получение хрома
Химические свойства хрома
Оксиды и
гидроксиды хрома
Качественная реакция на дихромат – ион (Сr2O72-)
Качественная реакция на хромат –ион (CrO42-)
Физические свойства и получение марганца
Химические свойства марганца
Оксиды и гидроксиды марганца
Марганцевая кислота HMnO4
Применение калия перманганата КMnO4
Слайд 3
Общая характеристика элементов побочной подгруппы V и VΙ
групп
Хром относится к переходным d- элементам и находится в
побочной подгруппе VI группы периодической системы элементов. Его порядковый номер 24. Электронная конфигурация валентных подуровней хрома: 3d5 4s1
В соответствии с электронной структурой хром может проявлять степень окисления от +1 до +6. Наиболее устойчивы соединения хрома /III/ и хрома /VI/. При обычных температурах могут быть получены и соединения хрома /II/
В периодической системе Д.И.Менделеева хром находится в IV периоде 6 группе побочной подгруппы.
Сr - .. .3d5 4s1 степени окисления -0; +2; +3; +6
Слайд 4
Общая характеристика элементов побочной подгруппы V и VΙ
групп
Марганец /порядковый номер 25/ принадлежит к элементам побочной подгруппы
седьмой группы периодической системы. Конфигурация его валентных подуровней выражается формулой 3d54s2 Обладая семью валентными электронами, марганец может проявлять различные степени окисления: +2, +3, +4, +6, +7, которым соответствуют оксиды Mn2+O, Мn3+2O3, Mn4+O2, Mn6+O3, Mn7+2O7. Марганцовистый ангидрид MnO3 в виде индивидуального соединения не выделен
Слайд 5
Общая характеристика элементов побочной подгруппы V и VΙ
групп
С ростом степени окисления основные свойства гидроксидов марганца ослабевают,
а кислотные усиливаются. усиление основных свойств Mn(OH)2, Mn(OH)3, Mn(OH)4 H2MnO4, HMnO4 усиление кислотных свойств. Это связано с тем, что с возрастанием степени окисления положительный заряд атома марганца увеличивается, а его радиус уменьшается. В результате этого напряженность электрического поля вблизи атома марганца возрастает, что приводит к усилению связи марганец-кислород и к более сильному отталкиванию протонов гидроксидов
Слайд 6
Общая характеристика элементов побочной подгруппы V и VΙ
групп
Свободный марганец – довольно активный металл серебристого цвета. В
ряду напряжений он расположен между магнием и цинком, поэтому он легко растворяется в разбавленных кислотах /даже в сравнительно слабых, например, в уксусной/, вытесняя водород и образуя соли двухвалентного марганца. Концентрированные серная и азотная кислоты на холоду пассивируют марганец, но при нагревании взаимордействуют с ним. При этом серная кислота восстанавливается, в основном, до диоксида серы, а главным продуктом восстановления азотной кислоты является диоксид азота
Слайд 7
Общая характеристика элементов побочной подгруппы V и VΙ
групп
Порошковообразный марганец уже при обычной температуре медленно разлагает воду,
вытесняя из неё водород. Однако компактный металл устойчив к действию воды. Это объясняется тем, что на воздухе марганец покрывается тонкой пленкой оксида, предохраняющего металл от дальнейшего окисления. С галогенами марганец взаимодействует даже без нагревания, а с серой, азотом, фосфором – при повышенных температурах.
В природе марганец встречается в виде соединений; МnO2 - пиролюзит, Мn3O4 - гаусманий
Слайд 9
Физические свойства и получение хрома
Хром был обнаружен
в конце XVIII века.
В 1766 году петербургский профессор химии
И.Г.Леман описал новый минерал, найденный на Урале на Березовском руднике, в 15 километрах от Екатеринбурга. Обрабатывая камень соляной кислотой, Леман получил изумрудно-зеленый раствор, а в образовавшемся белом осадке обнаружил свинец
И.Г. Леман
Слайд 10
Физические свойства и получение хрома
В 1854 году
удалось получить чистый металлический хром электролизом водных растворов хлорида
хрома. В металлургии, где расход хрома для легирования сталей очень велик, используют не сам хром, а его сплав с железом - феррохром.
Впервые феррохром был получен в 1820 году восстановлением смеси оксидов железа и хрома древесным углем в тигле. В 1865 году был выдан первый патент на хромистую сталь
В природе хром встречается в виде соединений - Сr2О3 – хромовая охра; Fe(CrO2)2 - хромистый железняк
Слайд 11
Физические свойства и получение хрома
Хром – это
белый, блестящий , тяжелый, тугоплавкий, очень твердый металл.
На воздухе
поверхность хрома покрывается слоем оксидной пленки, которая не растворяется в воде и кислотах и предохраняет металл от коррозии. Благодаря этому свойству для защиты металлических изделий от коррозии применяют покрытие хромом. Образованием защитной оксидной пленки объясняется и тот факт, что хром не растворяется в растворах кислот, анион которых выступает как окислитель.
Металлический хром можно получить алюмотермическим способом:
tº
Cr2O3 + 2Al = 2Cr + Al2O3
Слайд 12
Химические свойства
Химические свойства хрома
1) С кислородом, только при
нагревании. В нормальных условиях хром устойчив к окислению
4Cr +
3O2 => 2Cr2O3
2) С хлором
2Cr + 3Cl2 => 2CrCl3
3) С кислотами:
На поверхности хрома содержится слой оксида Cr2O3, защищающий металл от дальнейшего окисления => не взаимодействуя с HNO3 при нормальных условиях. t
Cr + HNO3(к) => Cr(NO3)3 + NO2 + H2O
Слайд 13
Химические свойства
Химические свойства хрома
С разбавленными HСl и H2SO4
хром реагирует с выделением H2 и образованием солей.
Cr +2HCl
=> CrCl2 + H2
Cr +H2SO4р => CrSO4 + H2
Cr + H2SO4(к) => Cr2(SO4)3 + SO2 + H2O
S
H2S
Соли быстро Cr2+ окисляются и переходят в соли Cr3+
Слайд 14
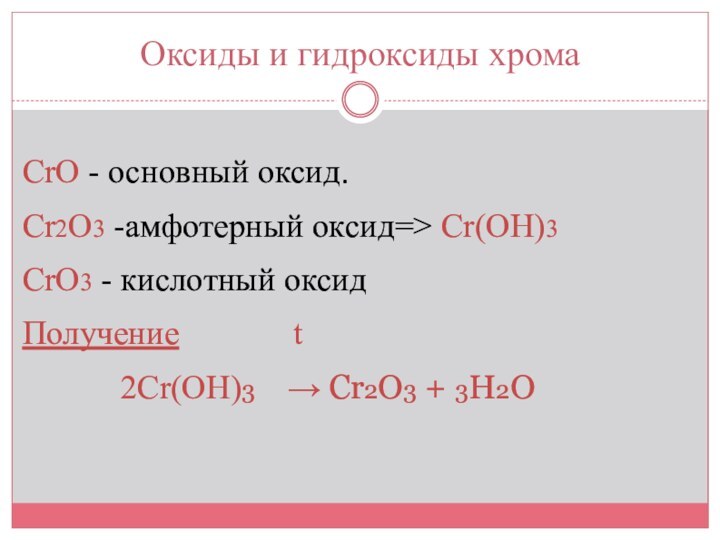
Оксиды и гидроксиды хрома
CrO - основный оксид.
Cr2O3 -амфотерный
оксид=> Cr(OH)3
CrO3 - кислотный оксид
Получение
t
2Сr(OH)3 → Cr2O3 + 3H2O
Слайд 15
Оксиды и гидроксиды хрома
Cr2O3 - порошок зеленого цвета
Амфотерность
Cr2O3:
1) Cr2O3 + 6HCl=> 2CrCl3+3H2O
сплавление
2) Cr2O3+ 2NaOH => 2NaCrO2
+H2O
соль метахромистой кислоты
Cr2O3 + 6NaOH => 2Na3CrO3 + 3H2O
соль ортохромистой кислоты
Слайд 16
Оксиды и гидроксиды хрома
Cr(OH)3
Получают действием щелочей на соли
хрома
CrCl3 + 3NaOH=> Cr(OH)3 ↓+ 3NaCl
синевато-серого
цвета
Обладает амфотерными свойствами
1) Cr(OH)3+ 3HCl => CrCl3+ 3H2O
2) Cr(OH)3+ NaOH => NaCrO2+ 2H2O
хромит натрия
(Соль метахромистой к-ты)
Слайд 17
Оксиды и гидроксиды хрома
СrO3 является кислотным оксидом.
Легко растворяется в воде с образованием растворов H2CrO4 —
хромовой кислоты и H2Cr2O7 — двуххромовой кислоты
Обе кислоты существуют только в водном растворе
Соли хромовой кислоты — хроматы, окрашены в желтый цвет.
Соли двуххромовой кислоты — дихроматы, окрашены в оранжевый цвет
Слайд 18
Оксиды и гидроксиды хрома
Хроматы и дихроматы способны переходить
друг в друга в разных средах.
Хромат- ион CrO42- устойчив
в щелочной среде
K2Cr2O7+ 2KOH=> 2K2CrO4+ H2O
оранж. Желтый
Дихромат — ион Cr2O72- устойчив в кислой среде.
2K2CrO4+ H2SO4=> K2SO4+K2Cr2O7 +H2O
желтый Оранж.
Слайд 19
Качественная реакция на дихромат – ион (Сr2O72-)
Диэтиловый
эфир
K2Cr2O7 + H2SO4(к)+ H2O2 => H2Cr2O8+ K2SO4+ H2O
Надхромовая к-та
окрашивает эфирный
слой в синий цвет
К смеси равных объемов H2SO4 и H2O2 добавить 2мл. диэтилового эфира и несколько капель раствора содержащего дихромат. При встряхивании эфирный слой окрашивается надхромовой кислотой в синий цвет
Слайд 20
Качественная реакция на хромат – ион (Сr2O42-)
K2CrO4 +
2AgNO3=> Ag2CrO4↓+2KNO3
кирпично-красного
цвета
Слайд 22
Физические свойства и получение марганца
Минералы Марганца известны издавна.
Древнеримский натуралист Плиний упоминает о черном камне, который использовали
для обесцвечивания Жидкой стеклянной массы; речь шла о минерале пиролюзите МnO2. В Грузии пиролюзит с древнейших времен служил присадочным материалом при получении железа
Слайд 23
Физические свойства и получение марганца
Долгое время пиролюзит называли
черной магнезией и считали разновидностью магнитного железняка (магнетита). В
1774 году К. Шееле показал, что это соединение неизвестного металла, а другой шведский ученый Ю. Ган, сильно нагревая смесь пиролюзита с углем, получил Марганец, загрязненный углеродом. Название Марганец традиционно производят от немецкого Marganerz - марганцевая руда
К. Шееле
Ю. Ган
Слайд 24
Физические свойства и получение марганца
Марганец в чистом виде
не встречается в природе. В рудах элемент присутствует в
форме карбонатов, окислов и гидроокисей. Основным минералом, содержащим марганец, является пиролюзит, представляющий собой относительно мягкий камень темно-серого цвета. Содержание марганца в нем составляет 63,2%. Существуют и другие руды марганца: манганит, псиломелан, браунит, гаусманит.
Все это силикаты и окислы марганца. В них валентность марганца составляет +2, +3, +4. Содержание марганца в земной коре равняется примерно 0,1 % по массе. Марганец является 14-м элементом по распространённости на нашей планете, и второй тяжёлый металл после железа
Слайд 25
Физические свойства и получение марганца
По внешнему виду напоминает
железо, но намного твёрже и более хрупкий. Серебристого цвета.
С металлами образует сплавы.
Получение:
Чистый Mn получают электролизом хлорида или сульфита или алюмотермией:
4Al + 3MnO2 → 2Al2O3 + 3Mn
Слайд 26
Химические свойства и получение марганца
Mn активный металл, обычно
покрыт оксидной плёнкой, но в мелко измельчённом состоянии легко
взаимодействует с кислородом
Mn + O2 => MnO2
3Mn + N2 => Mn3N2
t
Mn + 2H2O → Mn(OH)2 + H2↑
Mn + 2HCl → MnCl + H2 (кроме HNO3)
Mn + H2SO4(k) → MnSO4 + SO2 + H2O
Mn + CuSO4 → MnSO4 + Cu
Слайд 27
Оксиды и гидроксиды Mn
Mn+2О – основный оксид (порошок
серо- зеленого цвета)
Mn+32О3 – основный оксид (порошок коричнево0бурого цвета)
Mn+42О7 –
амфотерный оксид (зелено- бурое тяжелое масло)
Mn+7О2 – кислотный оксид (порошок черного цвета)
Слайд 28
Оксиды и гидроксиды Mn
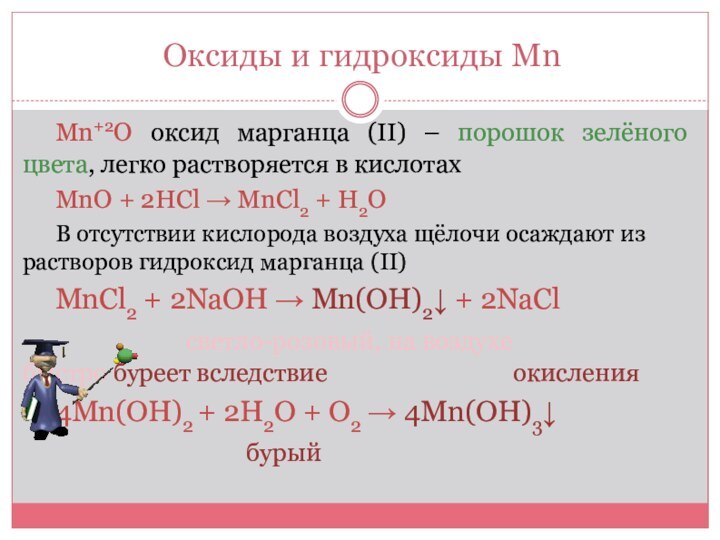
Mn+2О оксид марганца (ΙΙ) –
порошок зелёного цвета, легко растворяется в кислотах
MnO + 2HCl
→ MnCl2 + H2O
В отсутствии кислорода воздуха щёлочи осаждают из растворов гидроксид марганца (ΙΙ)
MnCl2 + 2NaOH → Mn(OH)2↓ + 2NaCl
светло-розовый, на воздухе быстро буреет вследствие окисления
4Mn(OH)2 + 2H2O + O2 → 4Mn(OH)3↓
бурый
Слайд 29
Марганцевая кислота НMnО4
Оксид марганца (VΙΙ) Mn2О7, которой является
кислотным соответствует марганцевая кислота НMnО4. Её соли называются перманганатами,
они окрашены в фиолетовый цвет
Все перманганаты являются окислителями
степень восстановления перманганата калия зависит от реакции среды
Слайд 30
Марганцевая кислота НMnО4
В кислой среде
2KMn+7O4 + 3H2SO4 +
5Na2SO3 → 2Mn+2SO4↓+ 3Na2SO4+K2SO4+3Н2О
фиолетовый обесцвечивание
В
нейтральной среде
2KMn+7O4 + H2O + 3Na2SO3 → 2Mn+4O2↓ + 3Na2SO4 +2KOH
фиолетовый бурые хлопья
В щелочной среде
2KMn+7O4 + 2KOH + Na2SO3 → 2K2Mn+6O4 + Na2SO4 + H2O
фиолетовый зелёный
Слайд 31
Примение КMnО4
КMnО4 фармакопейный препарат применяют как антисептическое средство
наружно в водных растворах для промывания ран(0,1-0,5%), для полоскания
рта и горла(0,01-0,1%), для смазывания ожогов (2-5%). Внутрь для промывания желудка(0,02-0,1%) при отравлениях алколоидами, цианидами, фосфором