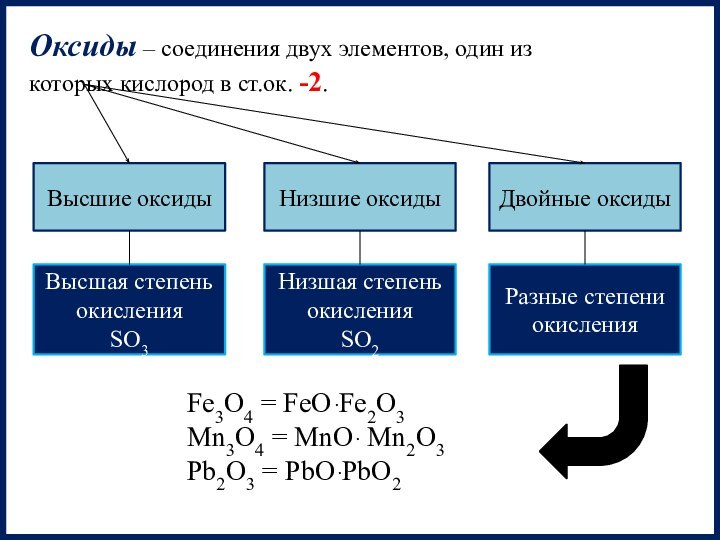
которых кислород в ст.ок. -2.
Высшие
оксидыНизшие оксиды
Двойные оксиды
Высшая степень окисления
SO3
Низшая степень окисления
SO2
Разные степени окисления
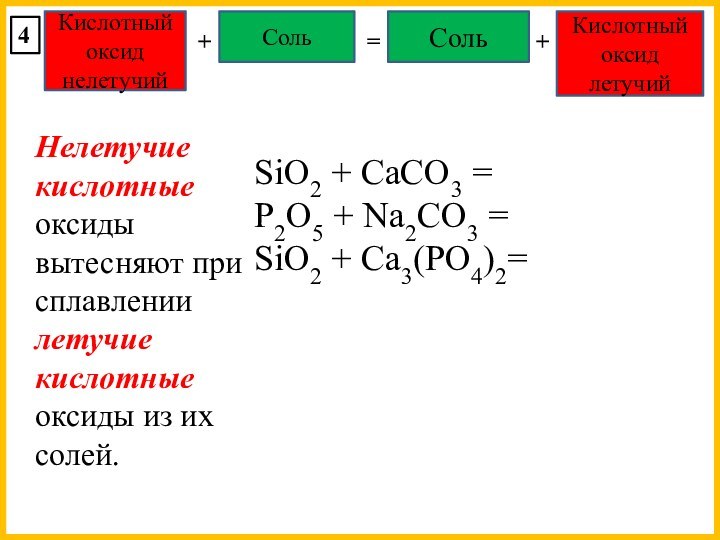
Fe3O4 = FeOּ Fe2O3
Mn3O4 = MnOּ Mn2O3
Pb2O3 = PbOּ PbO2
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

















Низшие оксиды
Двойные оксиды
Высшая степень окисления
SO3
Низшая степень окисления
SO2
Разные степени окисления
Fe3O4 = FeOּ Fe2O3
Mn3O4 = MnOּ Mn2O3
Pb2O3 = PbOּ PbO2
остальные
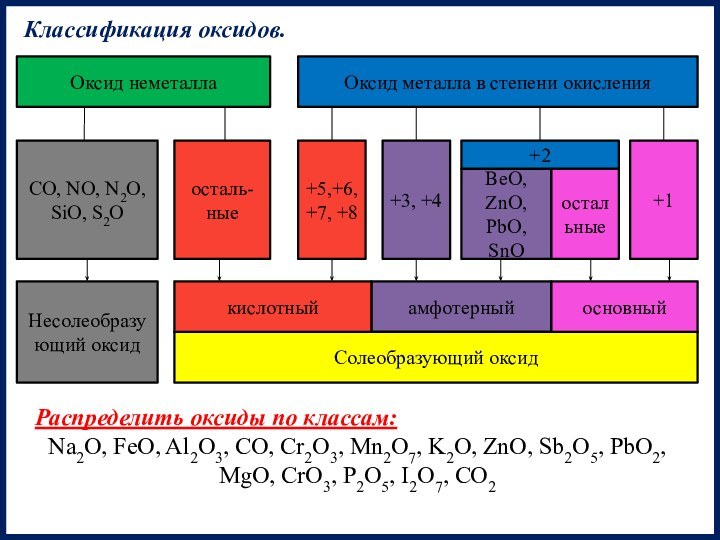
Распределить оксиды по классам:
Na2O, FeO, Al2O3, CO, Cr2O3, Mn2O7, K2O, ZnO, Sb2O5, PbO2, MgO, CrO3, P2O5, I2O7, CO2
Классификация оксидов.
2. Составить формулы оксидов, указать их характер:
Углекислый газ, угарный газ, веселящий газ, негашеная известь, глинозем, жженая магнезия, кремнезем, сернистый газ.
3. Составь формулы и укажи их характер высших оксидов всех элементов:
А) VIА группы
Б) 3 периода
Какая существует закономерность в изменении свойств высших оксидов элементов одного периода?
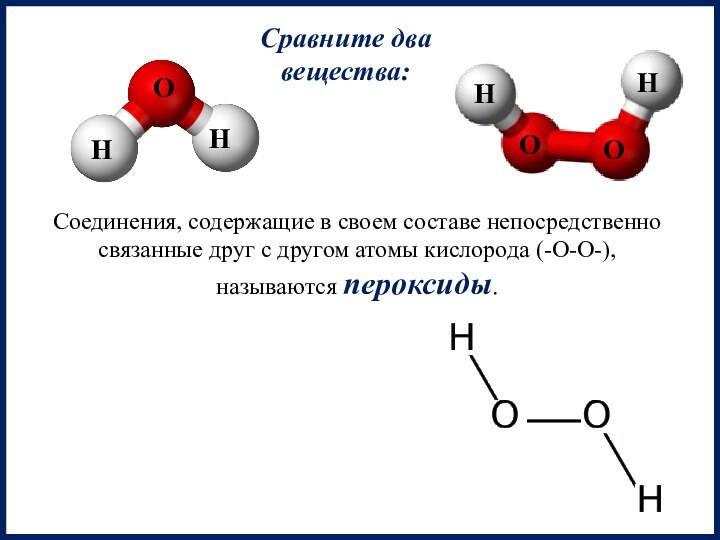
Надпероксиды — неорганические соединения,
содержащие анион О2− (атомы О в степени окисления −1/2)
P
С
Fe Cr
N
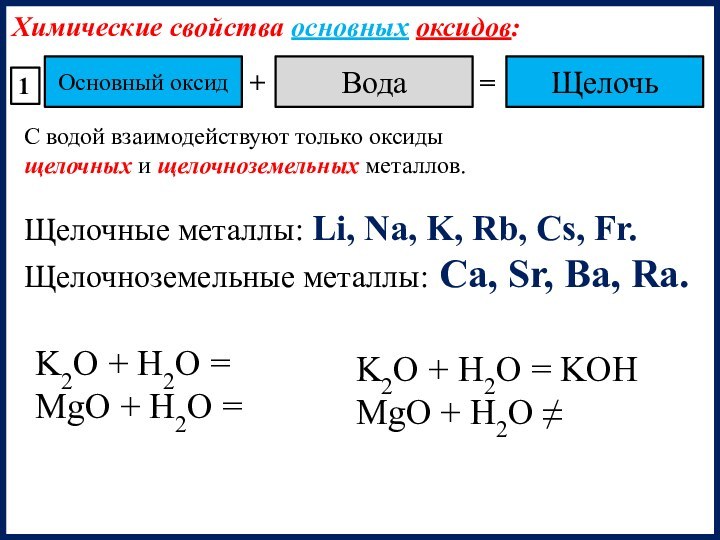
Щелочные металлы: Li, Na, K, Rb, Cs, Fr.
Щелочноземельные металлы: Ca, Sr, Ba, Ra.
K2O + H2O =
MgO + H2O =
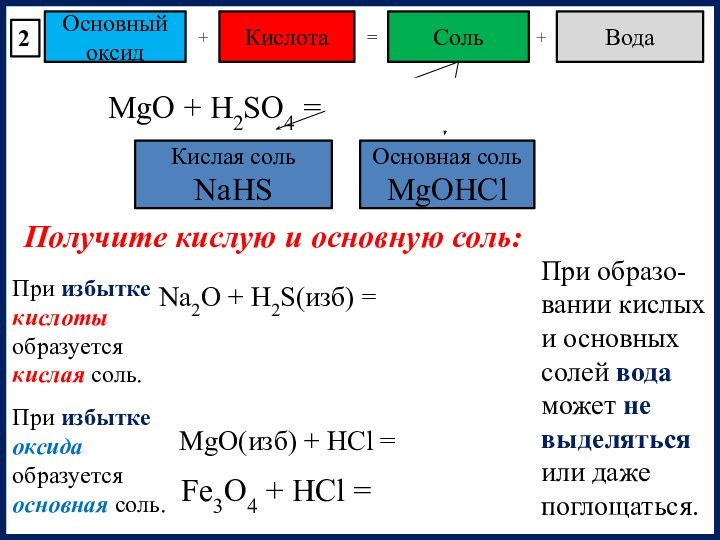
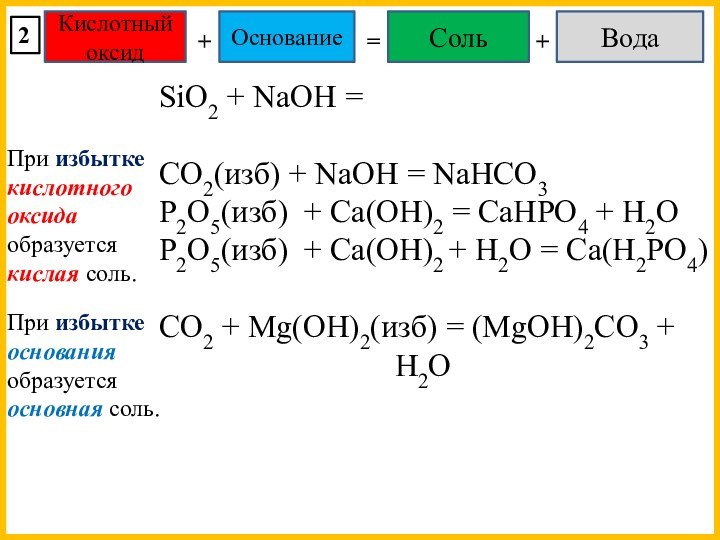
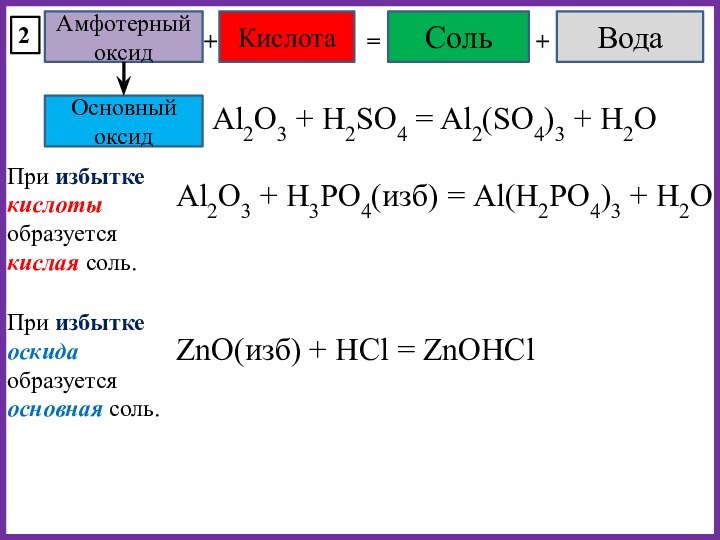
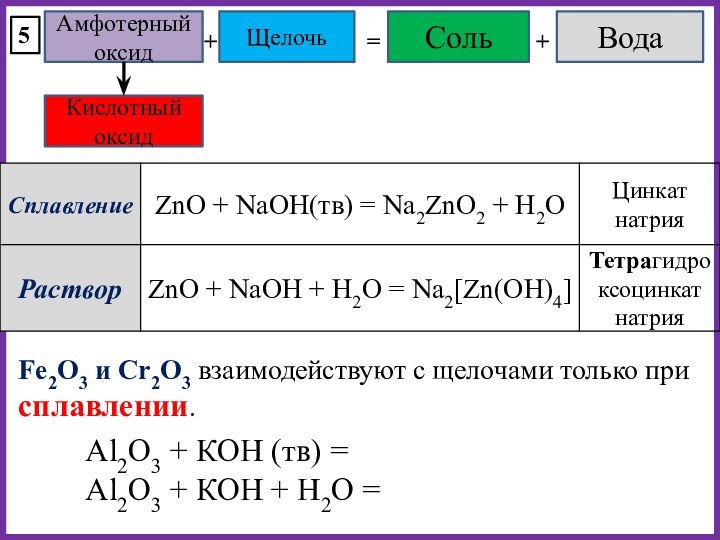
При избытке оксида образуется основная соль.
Na2O + H2S(изб) = NaHS + H2O
MgO(изб) + HCl = MgOHCl
При образо-вании кислых и основных солей вода может не выделяться или даже поглощаться.
Fe3O4 + HCl =
2
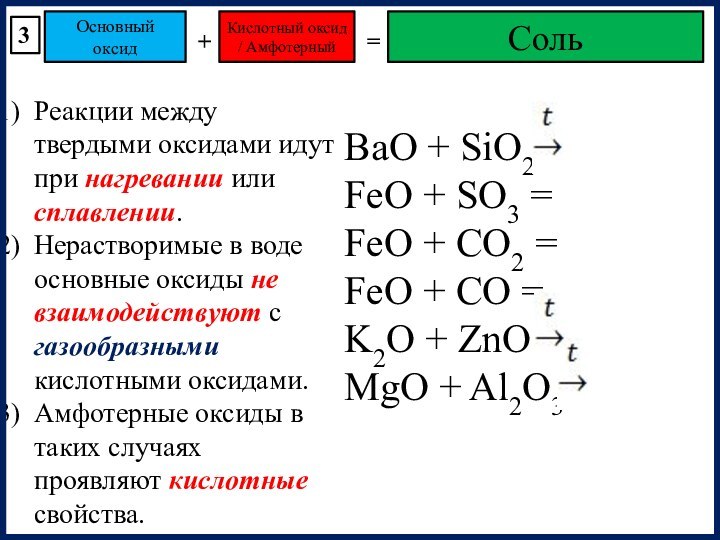
BaO + SiO2
FeO + SO3 =
FeO + CO2 =
FeO + CO =
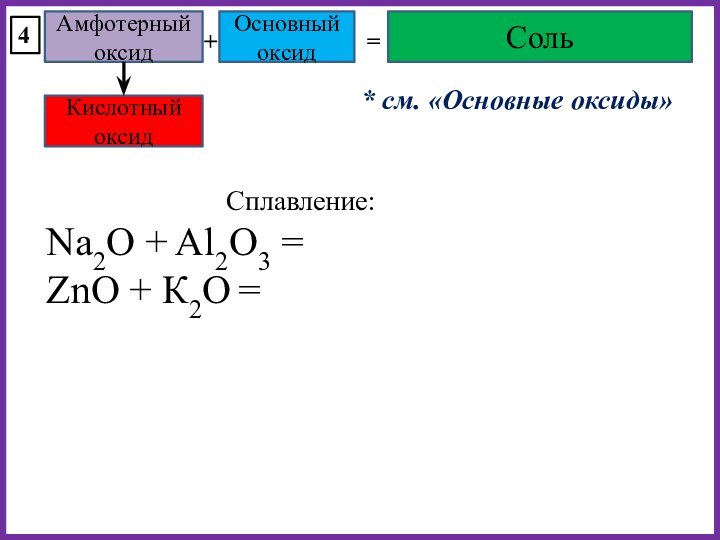
K2O + ZnO
MgO + Al2O3
3
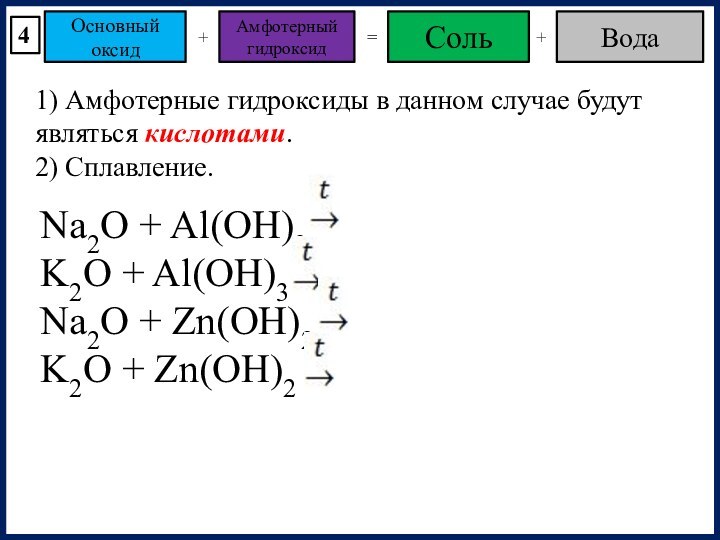
4
Ag2O =
HgO =
Fe2O3 + C =
FeO + C =
CaO + C =
Al2O3 + C =
CaO + H2 =
Cr2O3 + H2 =
Fe3O4 + Al =
CuO + Zn =
WO3 + Al =
FeO + O2 =
BaO + O2 =
Na2O + O2 =
5
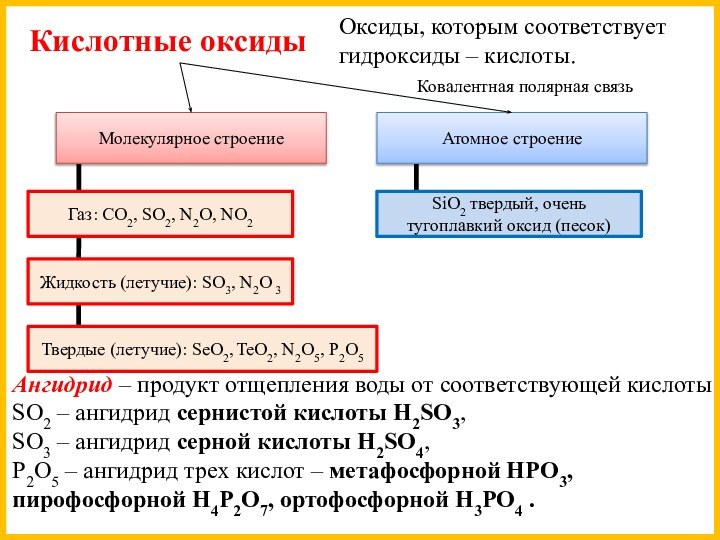
Твердые (летучие): SeO2, TeO2, N2O5, P2O5
SiO2 твердый, очень тугоплавкий оксид (песок)
Ангидрид – продукт отщепления воды от соответствующей кислоты.
SO2 – ангидрид сернистой кислоты H2SO3,
SO3 – ангидрид серной кислоты H2SO4,
P2O5 – ангидрид трех кислот – метафосфорной HPO3, пирофосфорной H4P2O7, ортофосфорной H3PO4 .
SO3 + H2O=
SiO2 + H2O =
NO2 + H2O = HNO3 + HNO2
NO2 + H2O = HNO3 + NO↑
ClO2 + H2O = HClO3 + HClO2
ClO2 + H2O = HClO3 + HCl
P2O5 + H2O = HPO3
P2O5 + H2O = H4P2O7
P2O5 + H2O = H3PO4
CrO3 + H2O = H2CrO4
CrO3 + H2O = H2Cr2O7
Метафосфорная
Пирофосфорная
Ортофосфорная
Хромовая
Дихромовая
1
При избытке кислотного оксида образуется кислая соль.
При избытке основания образуется основная соль.
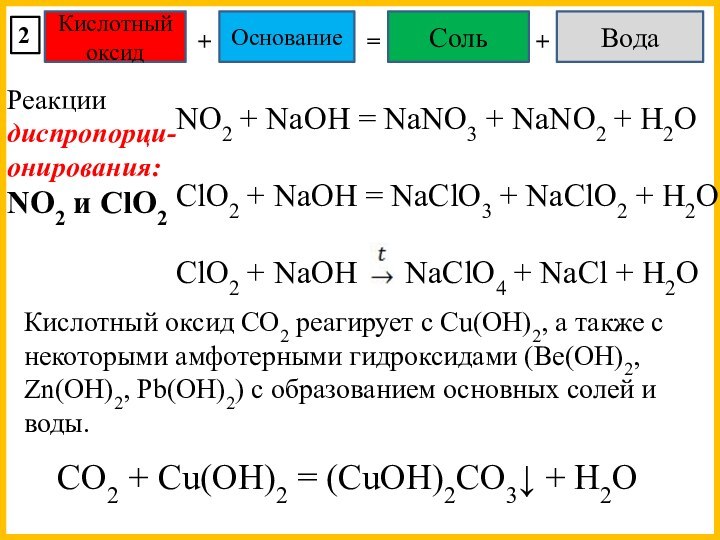
Реакции диспропорци- онирования:
NO2 и ClO2
Кислотный оксид CO2 реагирует с Cu(OH)2, а также с некоторыми амфотерными гидроксидами (Be(OH)2, Zn(OH)2, Pb(OH)2) с образованием основных солей и воды.
CO2 + Cu(OH)2 = (CuOH)2CO3↓ + H2O
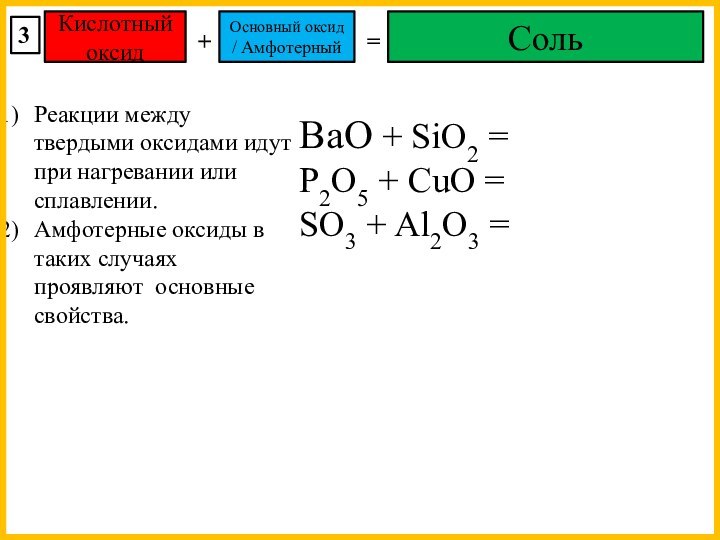
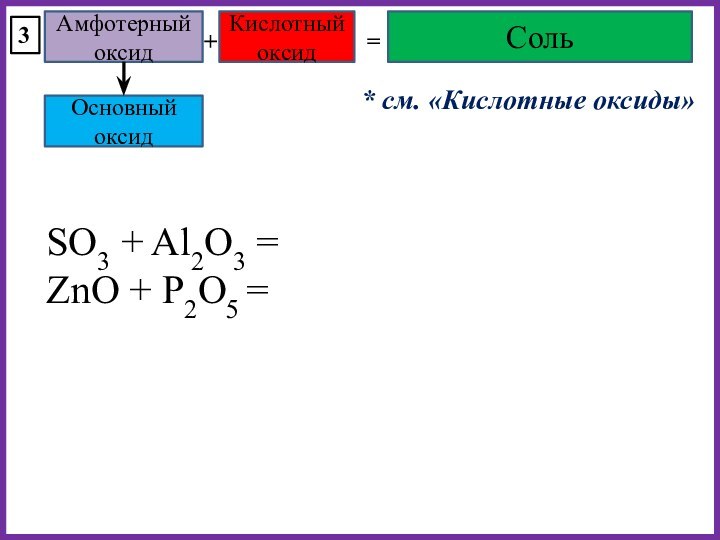
BaO + SiO2 =
P2O5 + CuO =
SO3 + Al2O3 =
3
СO2 + C = CO↑
SiO2 + C = SiO + CO↑
SO3 + C = SO2 + CO↑
SO2 + C = S + CO2↑
N2O + C = N2 + CO2↑
NO + C = N2 + CO2↑
NO2 + C = N2 + CO2↑
P2O5 + C = P + CO↑
H2O + C = H2 + CO↑
N2O + H2 = N2 + H2O
NO + H2 = N2 + H2O
CO2 + H2 = CH4 + H2O
5
CO2 + Mg = C + MgO
SiO2 + Mg = Si + MgO
N2O + Mg = N2 + MgO
CO2 + Ca = CaC2 + CaO
NO + O3 = NO2 + O2
SO2 + O3 = SO3 + O2
NO2 + O3 = N2O5 + O2
CO + O2 = CO2
SO2 + O2 = SO3
P2O3 + O2 = P2O5
NO + O2 = NO2
N2O3 + O2 = N2O4
5
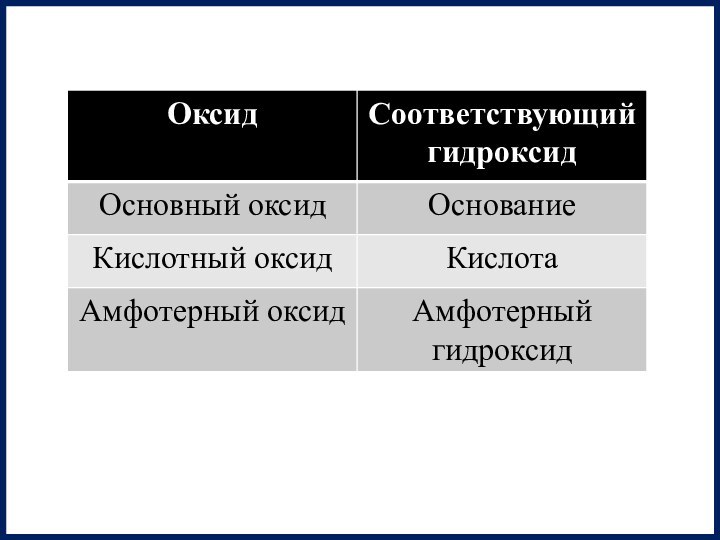
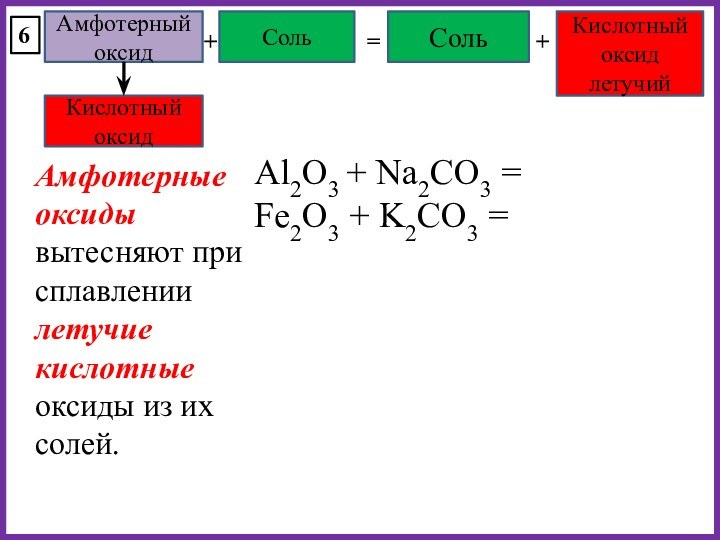
Основный оксид
Амфотерный оксид
Кислотный оксид