- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему План лекции
Содержание
- 2. План лекцииАзеотропные смеси. Диаграммы состояния. Второй закон КоноваловаЗаконы Вревского;3. Разделение неограниченно растворимых жидкостей. Перегонка.
- 3. Азеотропные растворы Азеотропные растворы - это растворы неограниченно
- 4. Система с «+» отклонением от закона Рауля с максимумом давления пара или минимумом температуры кипения12231223
- 5. Система с «-» отклонением от закона Рауля с минимумом давления пара или максимумом температуры кипения12231223
- 6. Второй закон Коновалова Максимум на кривой общего давления
- 7. ПримерыАзеотропные смеси с tкипminЭтанол – водаИзобутанол –
- 8. Свойства азеотропных растворов1. Состав пара равен составу
- 9. Сравнение азеотропной смеси с чистыми веществами1. Как
- 10. Разделение неограниченно растворимых жидкостей. Перегонка
- 11. Перегонка (дистилляция) процесс очистки жидкостей от растворённых
- 12. Основная закономерность В основе метода лежит различие составов
- 13. Разновидности перегонки1. Простая – однократная;2. Фракционная – многократная;3. Ректификация - непрерывная.
- 14. Простая перегонка заключается в непрерывном нагревании жидкости с отводом образующегося из нее пара.
- 15. Простая перегонкаИспарение жидкостиКонденсация пара
- 16. Выводы: 1) При простой перегонке нельзя полностью
- 17. Дробная (фракционная перегонка) 1. Более эффективна чем
- 18. Этапы фракционной перегонки:1) нагревание исходной жидкой смеси
- 19. Фракционная перегонка
- 20. Ректификация - непрерывная фракционная перегонка. Проводится в ректификационных колоннах в автоматическом режиме.
- 21. 1 – нагреватель;2 – трубы для стекания
- 22. Полнота разделения смеси зависит от:разности составов жидкости и пара;от числа отдельных перегонок (числа тарелок);конструкции колонны.
- 23. Оптимальные условия ректификации:Различие tкип компонентов смеси.Коэффициент разделения
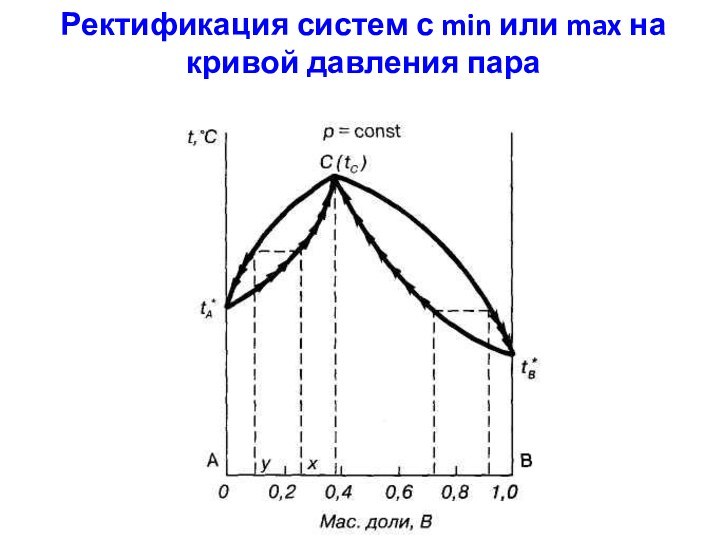
- 24. Ректификация систем с min или max на кривой давления пара
- 25. Выводы: 1. Полного разделения на компоненты провести
- 26. Методы разделения азеотропных смесейХимическое связывание одного из
- 27. Скачать презентацию
- 28. Похожие презентации
План лекцииАзеотропные смеси. Диаграммы состояния. Второй закон КоноваловаЗаконы Вревского;3. Разделение неограниченно растворимых жидкостей. Перегонка.





















Слайд 3
Азеотропные растворы
Азеотропные растворы - это растворы неограниченно растворяющихся
друг в друге жидкостей, при испарении которых образуется пар
такого же состава, что и исходная жидкая смесь. На диаграммах состояния p – f(состав) и Т – f(состав) со значительными отклонениями от законов Рауля на линиях жидкости имеются экстремальные точки, где они касаются линии пара. Это – азеотропные смеси.
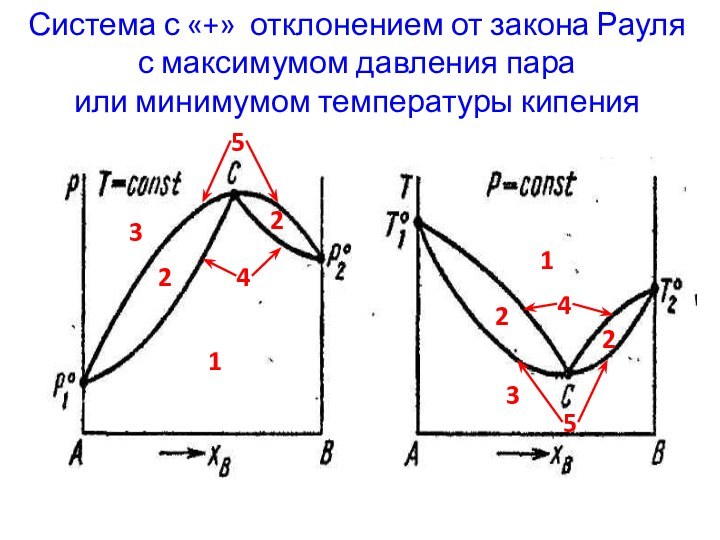
Слайд 4 Система с «+» отклонением от закона Рауля с
максимумом давления пара
или минимумом температуры кипения
1
2
2
3
1
2
2
3
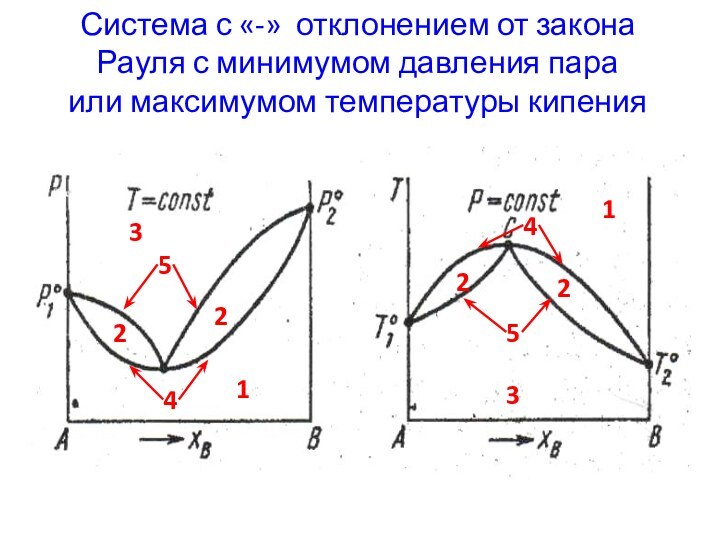
Слайд 5 Система с «-» отклонением от закона Рауля с
минимумом давления пара
или максимумом температуры кипения
1
2
2
3
1
2
2
3
Слайд 6
Второй закон Коновалова
Максимум на кривой общего давления соответствует
минимуму на кривой температур кипения и отвечает такому равновесию
раствора и его насыщенного пара, при котором составы обеих фаз одинаковы.
Слайд 7
Примеры
Азеотропные смеси с tкипmin
Этанол – вода
Изобутанол – вода
Ацетон
- сероуглерод
Азеотропные смеси с tкипmax
HCl – H2O
H2SO4 – H2O
Ацетон
– хлороформУсловия образования азеотропов:
Значительное отклонение свойств растворов от идеальных.
Незначительное отклонение от идеальности при близком значении р0
Слайд 8
Свойства азеотропных растворов
1. Состав пара равен составу жидкости.
2.
Кипят при постоянной температуре.
3. Являются условно однокомпонентными.
4. Инвариантны (С
= 0).5. Имеют max или min по сравнению с чистыми компонентами или раствором иного состава.
6. Не подвергаются разделению на чистые компоненты при перегонке.
Слайд 9
Сравнение азеотропной смеси с чистыми веществами
1. Как у
чистых веществ состав азеотропного раствора не изменяется при кипении
при заданном внешнем давлении и постоянной температуре.При изменении внешнего давления меняется не только tкип, но и состав азеотропного раствора, отсюда следует, что
азеотропная смесь не является химическим соединением: ее состав зависит от температуры, давления и природы веществ.
Слайд 11
Перегонка (дистилляция)
процесс очистки жидкостей от растворённых в
них нелетучих примесей или разделение смеси на фракции, отличающиеся
по составу, путём испарения и последующей конденсации паров.
Слайд 12
Основная закономерность
В основе метода лежит различие составов жидкости
и образующегося из неё пара, т. е. I закон
Коновалова.Перегонка
Использование перегонки
очистка жидкостей (например, получение дистиллированной воды );
разделение на фракции, которые отличаются по составу;
разделение смеси веществ на чистые компоненты.
Слайд 13
Разновидности перегонки
1. Простая – однократная;
2. Фракционная – многократная;
3.
Ректификация - непрерывная.
Слайд 14
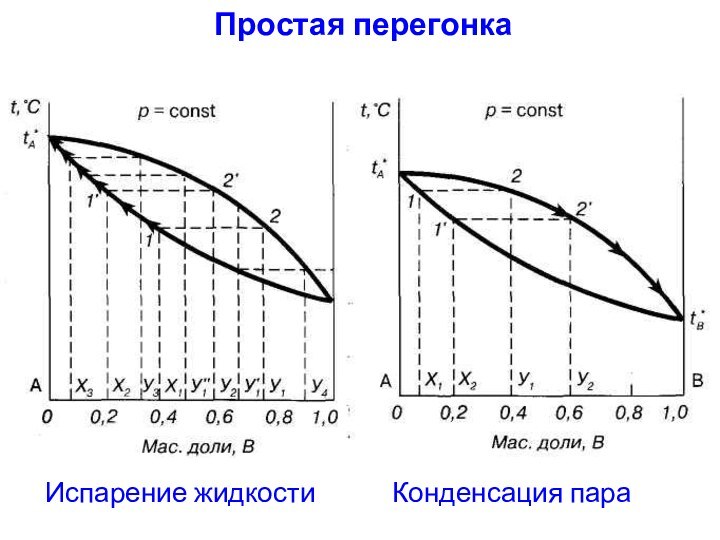
Простая перегонка
заключается в непрерывном нагревании жидкости с отводом
образующегося из нее пара.
Слайд 16
Выводы:
1) При простой перегонке нельзя полностью разделить
смесь, состоящую из двух летучих компонентов, можно лишь получить
небольшое количество одного компонента в практически чистом виде.2) Хорошо испаряющийся компонент в результате простой перегонки в чистом виде не выделяется. В конденсате будут оба компонента.
3) Эффективна при резком различии температур кипения .
4) Применение простой перегонки – простая перегонка применяется лишь тогда, когда не требуется тщательного разделения смеси.
Слайд 17
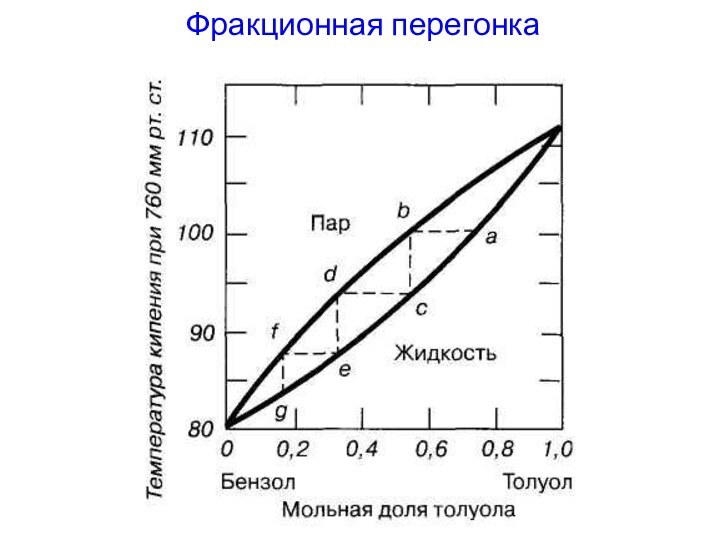
Дробная (фракционная перегонка)
1. Более эффективна чем однократная перегонка.
Применяется
для разделения смесей с получением чистых компонентов.
Проводится
обычно при постоянном давлении.
Слайд 18
Этапы фракционной перегонки:
1) нагревание исходной жидкой смеси до
кипения для получения некоторого количества пара;
2) конденсация полученного пара;
3)
испарение конденсата для получения пара нового состава.
Слайд 20
Ректификация
- непрерывная фракционная перегонка. Проводится в ректификационных
колоннах в автоматическом режиме.
Слайд 21
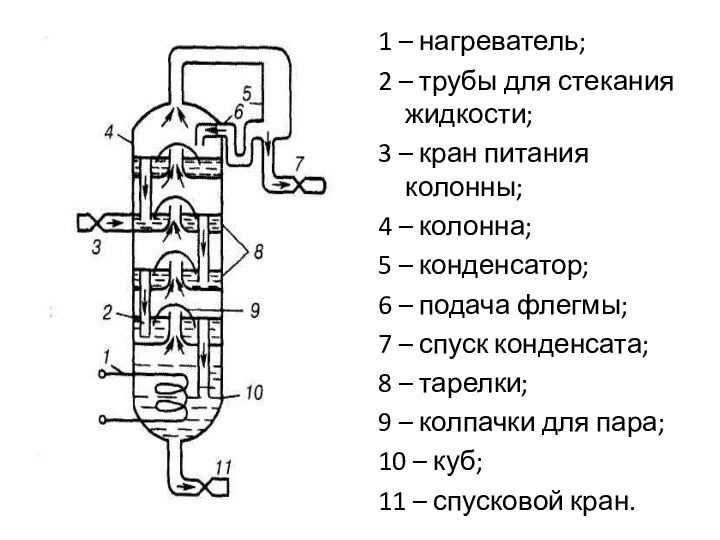
1 – нагреватель;
2 – трубы для стекания жидкости;
3
– кран питания колонны;
4 – колонна;
5 – конденсатор;
6 –
подача флегмы;7 – спуск конденсата;
8 – тарелки;
9 – колпачки для пара;
10 – куб;
11 – спусковой кран.
Слайд 22
Полнота разделения смеси зависит от:
разности составов жидкости и
пара;
от числа отдельных перегонок (числа тарелок);
конструкции колонны.
Слайд 23
Оптимальные условия ректификации:
Различие tкип компонентов смеси.
Коэффициент разделения 1.
Обеспечение
полного равновесного распределения компонентов между паром и жидкостью.
Оптимальная высота
колонны.Оптимальное соотношение интенсивности нагрева и охлаждения.
Слайд 25
Выводы:
1. Полного разделения на компоненты провести невозможно:
для
систем с tкипmin в остатке - один из компонентов
в чистом виде, в дистилляте – азеотроп;для систем с tкипmax в остатке – азеотроп, в дистилляте – один из компонентов в чистом виде.
2. В чистом виде получают компоненты, содержание которых в разделяемой смеси больше, чем в азеотропе.





























