Слайд 2
Классификация редких металлов
К этой группе относятся:
тугоплавкие металлы—
молибден, вольфрам, ванадий, титан, ниобий, тантал и цирконий;
легкие
— стронций, скандий, рубидий и цезий;
радиоактивные — уран, радий, торий, актиний и протактиний;
рассеянные и редкоземельные — германий, галлий, гафний, индий, лантан, таллий, церий и рений.
Слайд 3
Производство
Редкие металлы содержатся в небольших концентрациях в рудах
сложного состава (например, Ti-Nb-Ta-редкоземельные, молибдено-риниевые).
В технологии получения редких
металлов можно выделить следующие стадии:
Разложение рудных концентратов (растворами кислот, щелочей, и др.)
Получение чистых соединений (оксиды, хлориды, фториды)
Получение металлов технической чистоты
Рафинирование металлов
Получение слитков, заготовок, изделий
Слайд 4
Легкие металлы
Лёгкие металлы, металлы, обладающие малой плотностью. К
ним относятся Li, Be, Na, Mg, Al, K, Ca,
Ti, Rb, Sr, Cs, Ba и др. Лёгкие металлы широко распространены в природе (более 20% по массе). Вследствие высокой химической активности они встречаются только в виде весьма прочных соединений.
Основные способы получения легких металлов — электролиз расплавленных солей, металлотермия и электротермия.
Лёгкие металлы применяются главным образом для производства лёгких сплавов.
Важнейшие лёгкие металлы — алюминий, магний, титан, бериллий, литий.
Слайд 5
Бериллий
Бериллий — простое вещество бериллий относительно твёрдый металл
светло-серого цвета. Плотность 1,848 г/см³, Тпл 1551 K
Распространенные бериллиевые
минералы: берилл, хризоберилл, бертрандит, фенакит, гельвин, даналит.
В настоящее время бериллий получают, восстанавливая его фторид магнием: BeF2 + Mg = Be + MgF2, либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды.
Применение: легирование сплавов, рентгенотехника, ядерная энергетика, аэрокосмическая техника, ракетное топливо, огнеупорные материалы
Ядовит!
Слайд 6
Тугоплавкие металлы
Тугоплавкие металлы — класс химических элементов (металлов),
имеющих очень высокую температуру плавления и стойкость к изнашиванию.
Все они имеют температуру плавления выше 2000 °C, химически относительно инертны и обладают повышенным показателем плотности.
Тугоплавкие металлы и их сплавы используются в качестве конструкционных материалов также в машиностроении, морском судостроении, электронной, электротехнической, химической, атомной промышленности и в др. отраслях техники.
Слайд 7
Металлургия вольфрама
Вольфрам (англ. Tungsten) — твёрдый серый переходный
металл. Главное применение — как основа тугоплавких материалов в
металлургии. Крайне тугоплавок, при стандартных условиях химически стоек.
Плотность 19,3 г/см3
Температура плавления 3380 °С
Процесс получения вольфрама имеет несколько стадий. Исходным сырьем являются два минерала - вольфрамит (Fe, Mn)WO4 и шеелит CaWO4. Богатые вольфрамовые руды обычно имеют в своем составе 0,2 - 2 % вольфрама.
Слайд 8
Порошковая металлургия
Порошковая металлургия — технология получения металлических порошков и
изготовления изделий из них (или их композиций с неметаллическими
порошками). В общем виде технологический процесс порошковой металлургии состоит из четырех основных этапов: (1) производство порошков, (2) смешивание порошков, (3) уплотнение (прессование, брикетирование), (4) спекание.
Слайд 10
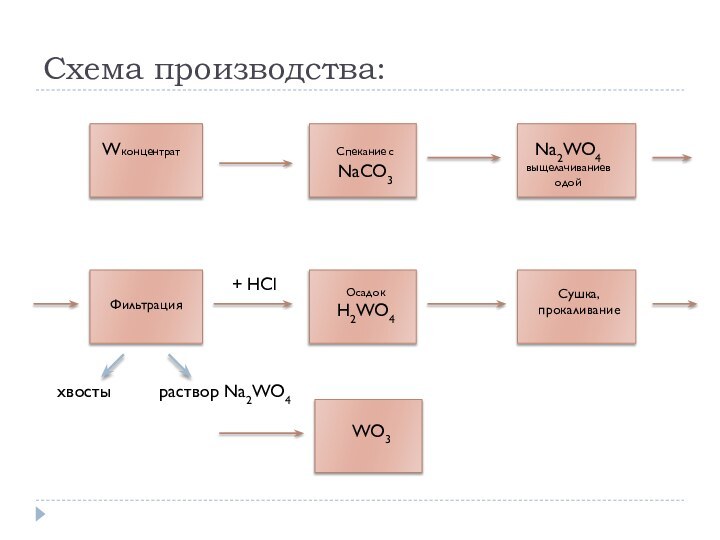
Этапы производства вольфрама:
Обогащение вольфрамовой руды. Оно производится с

помощью гравитации, флотации, магнитной или электростатической сепарации. В результате
обогащения получают вольфрамовый концентрат, содержащий 55 - 65 % ангидрида (трехокиси) вольфрама WO3. В вольфрамовых концентратах контролируется содержание примесей - фосфора, серы, мышьяка, олова, меди, сурьмы и висмута.
Получение трехокиси (ангидрида) вольфрама WO3, который служит исходным сырьем для производства металлического вольфрама или его карбида. Для этого необходимо выполнить ряд действий, таких, как разложение концентратов, выщелачивание сплава или спекая, получение технической вольфрамовой кислоты и др. В итоге должен получиться продукт, содержащий 99,90 - 99,95 % WO3
Получение вольфрамового порошка. Чистый металл в виде порошка может быть получен из ангидрида вольфрама WO3. Для этого проводят процесс восстановления ангидрида водородом или углеродом. Восстановление углеродом применяется реже, так как при данном процессе WO3 насыщается карбидами, что делает металл более хрупким и ухудшает обрабатываемость.
Получение компактного вольфрама. Компактный вольфрам, как правило, в виде слитков является заготовкой для производства полуфабрикатов, таких, как проволока, пруток, лента и так далее.
Слайд 11
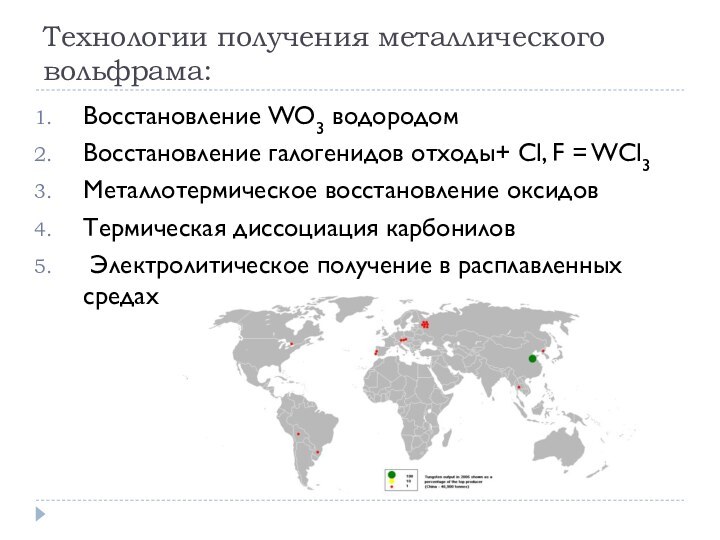
Технологии получения металлического вольфрама:
Восстановление WO3 водородом
Восстановление галогенидов отходы+
Cl, F = WCl3
Металлотермическое восстановление оксидов
Термическая диссоциация карбонилов
Электролитическое
получение в расплавленных средах
Слайд 12
Основные направления применения вольфрама:
Специальные стали
Твердые сплавы на основе
карбида вольфрама
Жаропрочные и износостойкие сплавы
Контактные сплавы и “тяжелые сплавы”
Электровакуумная
и электроосветительная техника
Сварочные электроды
Слайд 13
Молибден
Молибден - ковкий переходный металл серо-стального цвета в
компактном состоянии и черно-серого - в диспергированном.
Плотность при
20°С, г/cм3 10,2
Температура плавления, °С 2610
Содержание в земной коре 3·10-4% по массе. В свободном виде молибден не встречается. Известно около 20 минералов молибдена. Важнейшие из них: молибденит МоS2, повеллит СаМоО4, молибдит Fe(MoO4)3·nH2O и вульфенит PbMoO4.
Слайд 14
Молибден
Молибден применяют в качестве легирующей добавки к различным
сплавам, в том числе к высококачественным сталям.
Молибден и
молибденовые сплавы используются в деталях, длительно работающих в вакууме до 1800°С (в соплах ракет и в электровакуумных приборах), как конструкционный материал в энергетических ядерных реакторах, для изготовления оборудования, работающего в агрессивных средах, для обшивки головных частей ракет и самолетов.
В чистом виде молибден применяют в виде ленты или проволоки, в качестве нагревательных элементов электропечей, работающих в атмосфере водорода при температурах до 1600°С.
Соединения молибдена — сульфид, оксиды, молибдаты — являются катализаторами химических реакций, пигментами красителей, компонентами глазурей.