- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Сплави
Содержание
- 2. У техніці використовують переважно не чисті метали,
- 3. Метали у сплавах можуть:а) розчинятися один в одному,
- 4. Сплав, що складається з Міді (99%) і
- 5. Широко застосовуються сплави на основі міді –
- 6. Чавун – це сплав заліза, в якому міститься
- 7. Сталь на відміну від чавуну легко піддається
- 8. Вироби зі сталі
- 9. 1) дюралюміни (від французького слова dur –
- 10. Припій – відомий радіолюбителям сплавЛегкоплавкий сплав,складається з
- 11. Амальгами Сплав ртуті з іншим металом. Більшість
- 12. Ювелірні сплави— сплави благородних і кольорових металів,
- 13. Ювелірні сплавиСплав золота і палладіяПаладій підвищує температуру
- 15. Ювелірні сплави
- 16. Корозія металівБоротьба з корозією
- 17. Одну з найважливіших проблем, яку покликана розв’язувати хімія, - руйнування металевих конструкцій унаслідок корозії
- 18. Корозійне руйнування може охоплювати всю поверхню металу
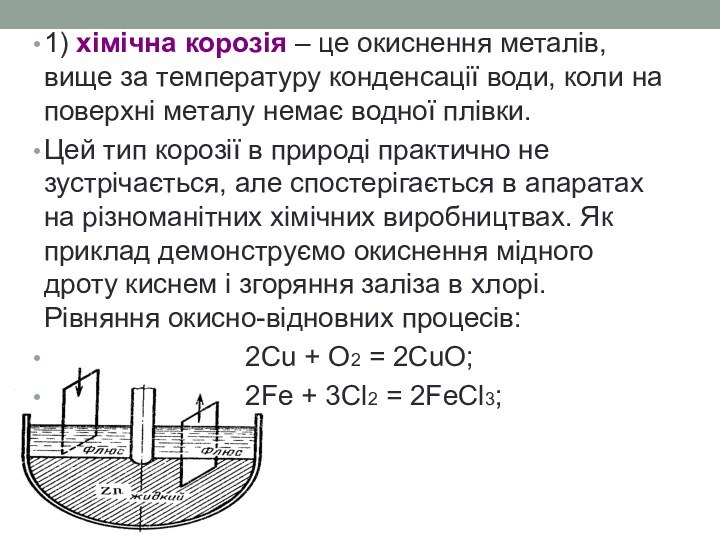
- 19. 1) хімічна корозія – це окиснення металів,
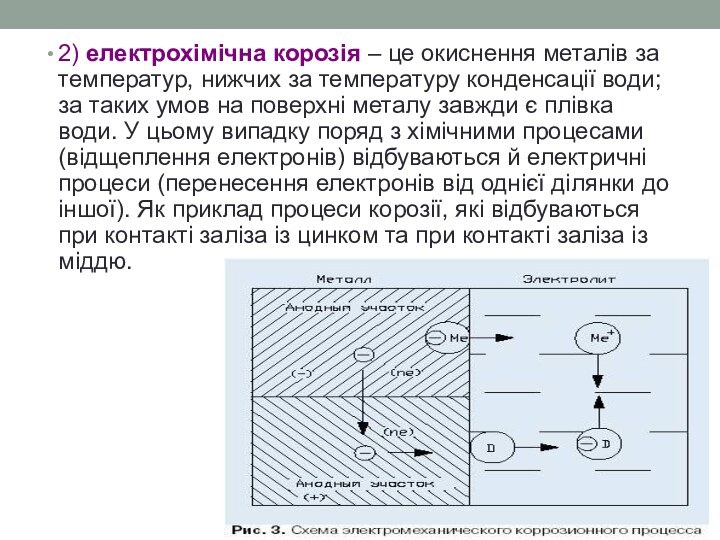
- 20. 2) електрохімічна корозія – це окиснення металів
- 21. Хімічна корозія має місце при безпосередній взаємодії
- 22. У кислому середовищі:
- 23. Біологічна корозія – це окиснення металу під
- 24. Захист від корозіїДля уповільнення корозії металевих виробів
- 25. Протекторний захист і електрозахист.Протекторний захист застосовують у
- 26. Скачать презентацию
- 27. Похожие презентации
У техніці використовують переважно не чисті метали, а сплави, бо чисті метали здебільшого не мають усіх властивостей, необхідних для практичного застосування. Алюміній – легкий, але неміцний метал, який не має достатньої твердості. Щоб підвищити твердість і
























Слайд 3
Метали у сплавах можуть:
а) розчинятися один в одному, якщо
сплавляються близькі за властивостями метали, то у вузлах їхніх
кристалічних ґраток містяться атоми різних металів, такий сплав називають твердим розчином; б) утворювати механічні суміші, якщо сплавляються метали, які відрізняються за хімічними властивостями, то при твердінні утворюється маса, що складається з найдрібніших кристаликів кожного з металів; в) реагувати один з одним з утворенням сполук – інтерметалідів. Здатність металів у розплавленому стані не тільки механічно змішуватися, а й утворювати між собою і з атомами неметалів різні сполуки – одна з причин, яка пояснює, чому фізичні властивості сплавів різко відрізняються від фізичних властивостей металів, що утворюють сплав.Слайд 4 Сплав, що складається з Міді (99%) і берилію
(1%) твердіший за мідь у сім разів. Відомо, що
цинк, мідь і алюміній за звичайних умов не взаємодіють з водою.Сплав, який містить мідь (50%), алюміній (45%) і цинк (5%), за таких умов вступає в реакцію з водою з виділенням водню.
Домішки металів заважають переміщенню вільних електронів внаслідок чого знижується електропровідність металів.
Сплави бувають тверді та м’які, тугоплавкі, легкоплавкі, жаростійкі, кислотостійкі, стійкі до дій лугів.
Широко застосовуються сплави на основі міді – латуні і бронзи. Латунь містить до 45% цинку (проста латунь). Спеціальні латуні крім міді і цинку містять залізо, алміній, олово, кремній. З неї виготовляють труби для конденсаторів і радіаторів, деталі механізмів, в суднобудуванні завдяки високій корозійній стійкості. Латунь з високим вмістом міді через свою подібність до золота використовують для ювелірних і декоративних виробів.
Слайд 5 Широко застосовуються сплави на основі міді – латуні
і бронзи. Латунь містить до 45-50 % цинку та
такої ж кількості міді . (проста латунь). Спеціальні латуні крім міді і цинку містять залізо, алміній, олово, кремній. З неї виготовляють труби для конденсаторів і радіаторів, деталі механізмів, в суднобудуванні завдяки високій корозійній стійкості. Латунь з високим вмістом міді через свою подібність до золота використовують для ювелірних і декоративних виробів.Слайд 6 Чавун – це сплав заліза, в якому міститься більше
1,7 % Карбону, а також домішки Силіцію, Мангану, Сульфуру,
Фосфору. Він твердіший за залізо, крихкий, не піддається куванню і прокатуванню і розбивається внаслідок удару.Розрізняють два види чавуну: сірий і білий.
Сталь – це сплав заліза, вміст Карбону в якому від 0,3 до 1,7%.
Слайд 7 Сталь на відміну від чавуну легко піддається куванню
і прокатуванню. При швидкому охолодженні вона виходить дуже твердою,
при повільному – м’якою. М’яку сталь легко обробляти. Конструкційні сталі мають високу міцність і пластичність, добре обробляються тиском, різанням, зварюються. Інструментальні сталі мають високу міцність, твердість, стійкі до корозії. З них виготовлять деталі газових турбін, реактивних двигунів, ракетних установок. З магнітних сталей роблять магнітне обладнання.Real steel
Слайд 9 1) дюралюміни (від французького слова dur – твердий
і aluminium – твердий алюміній). Дюралюміни в своєму складі
можуть містити: а) 1,4–13% Cu; б) 0,4–2,8% Mg; в) 0,2–1% Mn; г) 5–7% Zn; д) 0,8–1,8%Fe; е) 0,02–0,35% Ti, іноді 0,5–6% Si. Дюралюміни міцні і легкі, теплопровідні, корозійно стійкі використовують в авіабудуванні для виготовлення деталей турбореактивних двигунів;
Слайд 10
Припій – відомий радіолюбителям сплав
Легкоплавкий сплав,складається з двох
частин олова та однієї частини свинцю.В розплавленому стані припій
легко прилипає до добре зачищеної металевої поверхні ,його використовують для паяння металів
Слайд 11
Амальгами
Сплав ртуті з іншим металом. Більшість металів,
крім заліза і платини, можуть бути частиною амальґами.
Застосовують у
техніці, наприклад, для металізації поверхні матеріалу (позолочення, посріблення). Також використовується в виробництві дзеркал. Амальгами натрію, цинку і деяких інших металів застосовують у лабораторній практиці як відновники.Залежно від співвідношення кількості ртуті і металу амальгами можуть бути при кімнатній температурі рідкими, напіврідкими або твердими. При сильному нагріванні амальгами ртуть випаровується. Ця властивість використовується при добуванні золота, срібла та платини з руд і концентратів.
Слайд 12
Ювелірні сплави
— сплави благородних і кольорових металів, що
вирізняються гарним зовнішнім виглядом, високою стійкістю до впливу кислот,
солей та довкілля. Початок застосування сплавів відноситься до 2-3 тисячоріч до н. е.Розрізняють ювелірні сплави на основі благородних металів і сплави-замінники на основі міді.
До сплавів-замінників відносяться бронза, мельхіор, нейзильбер та ин. Зазвичай їх піддають в подальшому срібленню, емалюванню чи иншим обробкам. Такі сплави використовують переважно для виготовлення біжутерії.
Слайд 13
Ювелірні сплави
Сплав золота і палладія
Паладій підвищує температуру плавлення
золотого сплаву і різко змінює його колір - при
вміщенні в сплаві 10% паладію сплав забарвлюється в білий колір. Пластичність і ковкість сплава зберігаються.Сплав золота і нікель
Нікель змінює колір сплаву в блідо-жовтий, підвищує міцність. Вміст нікелю підвищує текучість розплаву, а відповідно, розливні якості.
Сплав золота і платини
Платина окрашує золотий сплав у білий колір інтенсивніше за паладій. Жовтизна втрачається при вмісті 8,4% платини в сплаві. Різко підвищується температура плавлення сплаву. При підвищенні вмісту платини до 20% збільшується пружність золотого сплаву. Сплав золота з платиною і паладієм володіє дуже високими антикорозійними властивостями.
Сплав золота і кадмію
Кадмий у складі золотого сплаву різко знижує температуру плавки, але зберігає ковкість і пластичність сплаву.
Сплав золота і цинка
Цинк різко знижує температуру плавлення сплаву з золотом, підвищує його текучість, придає сплаву крихкість та зеленуватий відтінок.
:http://gold.ru/news/splavy-zolota.html
Слайд 17 Одну з найважливіших проблем, яку покликана розв’язувати хімія,
- руйнування металевих конструкцій унаслідок корозії
Слайд 18 Корозійне руйнування може охоплювати всю поверхню металу -
суцільна (загальна) корозія або окремі ділянки - місцева (локальна)
корозія.Залежно від механізму процесу розрізняють хімічну й електрохімічну корозію
Слайд 19 1) хімічна корозія – це окиснення металів, вище
за температуру конденсації води, коли на поверхні металу немає
водної плівки.Цей тип корозії в природі практично не зустрічається, але спостерігається в апаратах на різноманітних хімічних виробництвах. Як приклад демонструємо окиснення мідного дроту киснем і згоряння заліза в хлорі. Рівняння окисно-відновних процесів:
2Cu + O2 = 2CuO;
2Fe + 3Cl2 = 2FeCl3;
Слайд 20 2) електрохімічна корозія – це окиснення металів за
температур, нижчих за температуру конденсації води; за таких умов
на поверхні металу завжди є плівка води. У цьому випадку поряд з хімічними процесами (відщеплення електронів) відбуваються й електричні процеси (перенесення електронів від однієї ділянки до іншої). Як приклад процеси корозії, які відбуваються при контакті заліза із цинком та при контакті заліза із міддю.Слайд 21 Хімічна корозія має місце при безпосередній взаємодії металу
з агресивними газами і рідинами:
2Fe + 3Cl2 = 2FeCl3;
Zn + 2 HCl = ZnCl2 + H2;
3Fe + 2O2 = Fe3O4;
Fe + H2SO4 = FeSO4 + H2.
Слайд 22
У кислому середовищі:
2HCl = H2 + Cl2
A: Zn – 2e = Zn.K: 2H + 2e = H2.
У розчині нагромаджуються іони
Zn+2, Cl-.
У нейтральному середовищі на катоді відбувається відновлення молекули води за схемою:
O2 + 2H2O + 4e = 4OH-.
Слайд 23
Біологічна корозія – це окиснення металу під впливом
мікроорганізмів або продуктів їх метаболізму. Цей вид корозії відбувається
в ґрунті, застійній та гнилісний воді. Її механізм зводиться до того, що самі мікроорганізми та продукти їх метаболізму провокують електрохімічну корозію.
Слайд 24
Захист від корозії
Для уповільнення корозії металевих виробів до
електроліту вводять речовини інгібітори, які називають уповільнювачами корозії, їх
застосовують у тих випадках, коли метал необхідно захищати від роз'їдання кислотами.Інгібітори широко застосовують при хімічному очищенні від накипу парових котлів, зніманні окалини з оброблених деталей, а також при зберіганні та перевезенні хлоридної кислоти у стальній тарі.
Слайд 25
Протекторний захист і електрозахист.
Протекторний захист застосовують у тому
разі, коли захищається конструкція (підземний трубопровід, корпус судна), яка
перебуває в середовищі електроліту (морська вода, підземні ґрунтові води та ін.).Суть такого захисту полягає в тому, що конструкцію сполучають з протектором — більш активним металом, ніж метал конструкції, яку захищають.
Як протектор для захисту стальних виробів звичайно використовують магній, алюміній, цинк та їх сплави. У процесі корозії протектор є анодом і руйнується, запобігаючи тим самим руйнуванню конструкції. У міру руйнування протекторів їх замінюють новими.
Електрозахист являє собою процес, при якому металева конструкція підключається до зовнішнього джерела постійного електричного струму. В результаті цього на її поверхні формується поляризація електродів катодного типу, і всі анодні області починають перетворюватися в катодні.
Електрозахист має перевагу над протекторним захистом: радіус дії першого близько 2 000 м, другого — близько 50 м.