Слайд 2
Определение
БЕЛКИ-высокомол. прир. полимеры, построенные из остатков аминокислот, соединенных
амидной (пептидной) связью —СО—NH—. Каждый белок характеризуется специфич. аминокислотной
последовательностью и индивидуальной пространств, структурой (конформацией).
Состоят из двадцати разных аминокислот.
Слайд 3
Структура белков
Первичная структура
Представляет собой линейную цепь аминокислот, расположенных в
определенной последовательности и соединенных между собой пептидными связями. Пептидная связь образуется за счет α-карбоксильной
группы одной аминокислоты и α-аминной группы другой.
Слайд 4
Аминокислоты могут объединяться в длинные цепи, образуя между

собой пептидные связи. Две аминокислоты при этом образуют дипептид; если к нему добавить еще
одну, то возникнет трипептид и т.д. Пептиды, содержащие до 10 аминокислот, называют олигопептидами, а до 50 —полипептидами. Полипептиды, содержащие более 50 аминокислот, уже называют белками, хотя это название чаще используют для соединений, содержащих более 100 аминокислот.
Аминокислотные звенья, входящие в состав пептида, обычно называют аминокислотными остатками. Они уже не являются аминокислотами, так как в результате образования пептидных связей у каждой из них не хватает одного атома водорода в аминной группе и одного гидроксильного аниона в карбоксильной. Аминокислотный остаток, находящийся на том конце пептида, где имеется свободная α-аминная группа, называется аминоконцевым или N-концевым остатком; остаток же на противоположном конце молекулы, имеющем свободную карбоксильную группу,— карбоксиконцевым или С-концевым. Название пептидов образуется из названия входящих в них аминокислотных остатков в соответствии с их последовательностью, начиная с N-конца.
Слайд 5
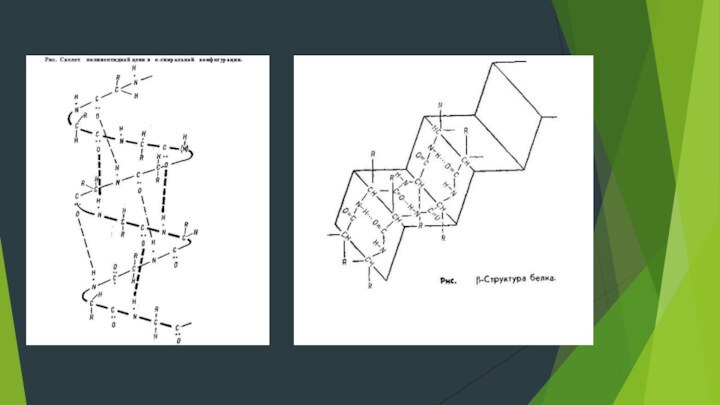
Вторичная структура.
Представляет собой упорядоченную и компактную упаковку полипептидной
цепи. По конфигурации она бывает в виде спирали и
складчатой структуры.
Основу α-спирали составляет пептидная цепь, а радикалы аминокислот направлены кнаружи, располагаясь по спирали. Внешне α-спираль похожа на слегка растянутую спираль электроплитки. Такая форма характерна для белков, имеющих одну полипептидную цепь (альбуминов, глобулинов и др.).
Складчатая β-структура представляет собой плоскую форму и похожа на меха гармошки. Она характерна для белков, имеющих несколько полипептидных цепей, расположенных параллельно, β-структура встречается в таких белках, как трипсин, рибонуклеаза, кератин волос, коллаген сухожилий.
Слайд 7
.
Образование вторичной структуры обеспечивается водородной связью. Она образуется
при участии атома водорода, находящегося между двумя сильноотрицательными атомами,
к одному из которых он (водород) имеет большее сродство.
Водородная связь является слабой, она легко образуется и так же легко разрывается. В молекуле белка этот вид связи образуется между водородом α-аминной группы одной пептидной связи и кислородом β-карбоксильной группы другой.
В α-спирали водородная связь образуется таким образом, что каждая NH-группа пептидной связи соединяется с четвертой по счету вдоль цепи СО-группой другой связи. Именно благодаря такому соединению обеспечивается спирализация цепи. В β-структуре водородная связь образуется между теми же группировками, но принадлежащими разным полипептидным цепям. Таким образом, все СО- и NH-группы полипептидных цепей оказываются связанными между собой водородными связями.
Слайд 8
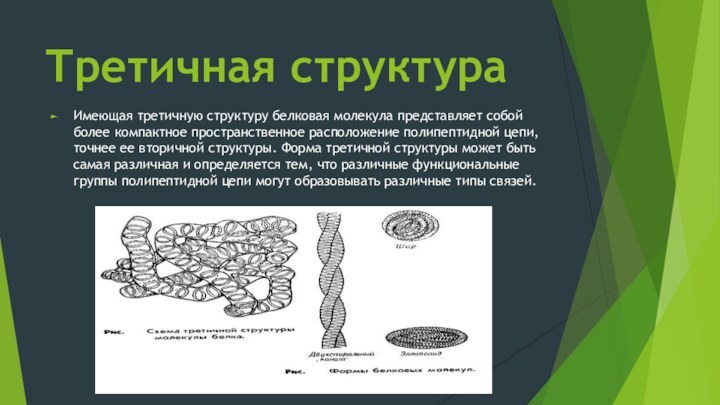
Третичная структура
Имеющая третичную структуру белковая молекула представляет собой
более компактное пространственное расположение полипептидной цепи, точнее ее вторичной
структуры. Форма третичной структуры может быть самая различная и определяется тем, что различные функциональные группы полипептидной цепи могут образовывать различные типы связей.
Слайд 9
.
Этот тип структуры является довольно жестким, что обусловлено
наличием дисульфидных (—S...S—) связей (дисульфидных мостиков), которые образуются между атомами серы двух молекул
цистеина, расположенных в разных участках полипептидной цепи.
Именно третичная структура обеспечивает выполнение белком его основных функций и в зависимости от этого третичная структура может быть представлена или в виде шарика (глобулы) у глобулярных белков, или и виде нитей (фибрилл) у фибриллярных белков. Глобулярные белкиобнаружены в крови и многих органах. Их представителями являются альбумины и глобулины. Фибриллярные белки составляют основу мышечной ткани.