Слайд 2
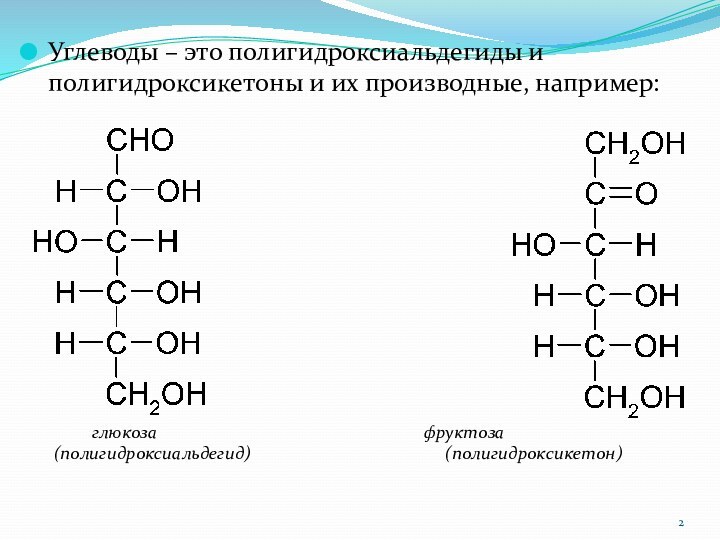
Углеводы – это полигидроксиальдегиды и полигидроксикетоны и их
производные, например:
глюкоза
фруктоза
(полигидроксиальдегид) (полигидроксикетон)
Слайд 3
Общая формула простых моносахаридов может быть представлена как
Cn(H2O)m и поэтому ранее сахара считали гидратированными формами углерода,
что объясняет этимологию слова “углевод”.
Молекулярная формула глюкозы C6H12O6 может быть представлена как C6(H2O)6
англ. Carbohydrate происходит от carbon (углерод) и гидрат – продукт присоединения воды – от греческого udor - вода
Слайд 4
Классификация углеводов
Моносахариды (простые сахара, например, глюкоза)
Олигосахариды (углеводы, содержащие
2-10 остатков моносахаридов, например сахароза).
Полисахариды (углеводы, содержащие более 10
остатков моносахаридов, но обычно – тысячи и миллионы).
Слайд 5
1. Моносахариды
Моносахариды – простейшие углеводы, не гидролизующиеся на
более простые углеводы (греч. mono – один)
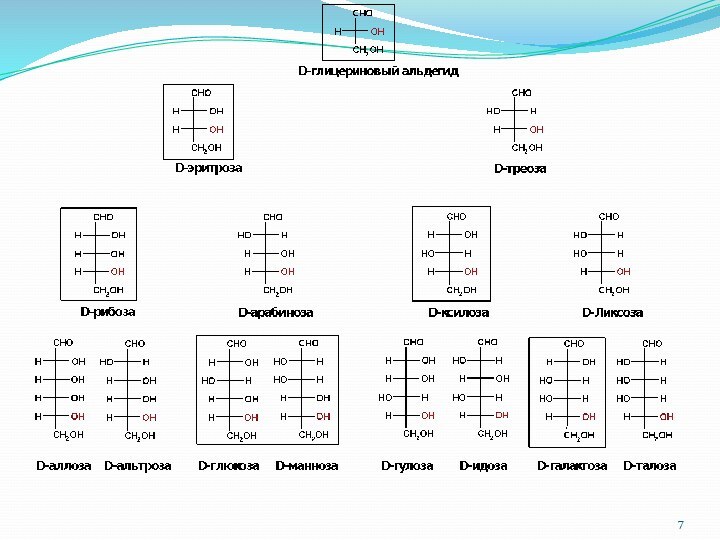
1.1. Классификация моносахаридов
a)
по числу атомов углерода в молекуле
Триозы, тетрозы, пентозы, гексозы, гептозы, октозы, нонозы, декозы.
б) по функциональной группе
Альдозы – содержат альдегидную группу
Кетозы – содержат кетонную группу.
Используется также совмещённая классификация, например:
альдопентоза – альдоза и пентоза (напр. рибоза)
кетогексоза – кетоза и гексоза (напр. фруктоза)
Слайд 6
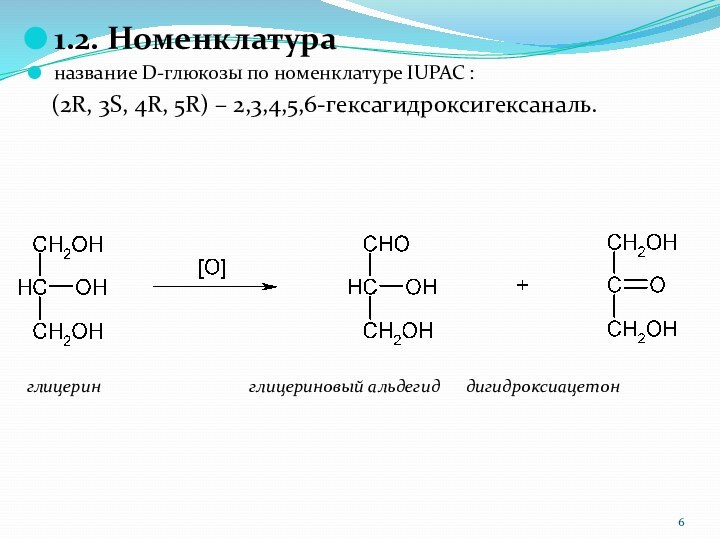
1.2. Номенклатура
название D-глюкозы по номенклатуре IUPAC :
(2R, 3S, 4R, 5R) – 2,3,4,5,6-гексагидроксигексаналь.
глицерин
глицериновый альдегид дигидроксиацетон
Слайд 9
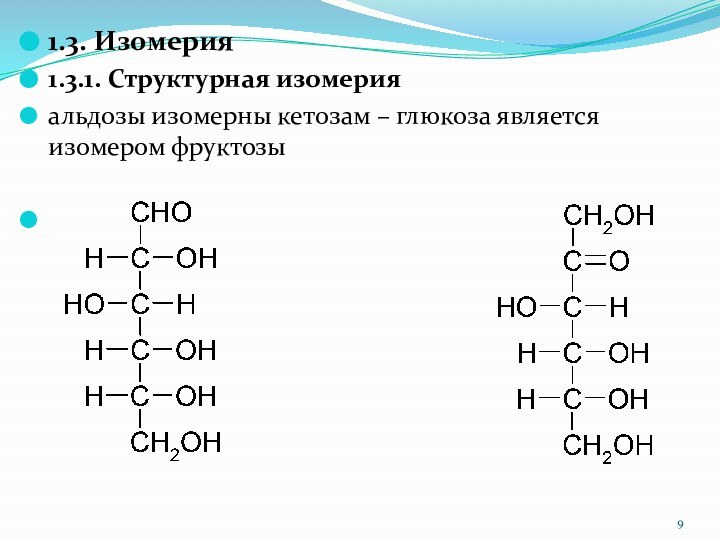
1.3. Изомерия
1.3.1. Структурная изомерия
альдозы изомерны кетозам – глюкоза
является изомером фруктозы
Слайд 10
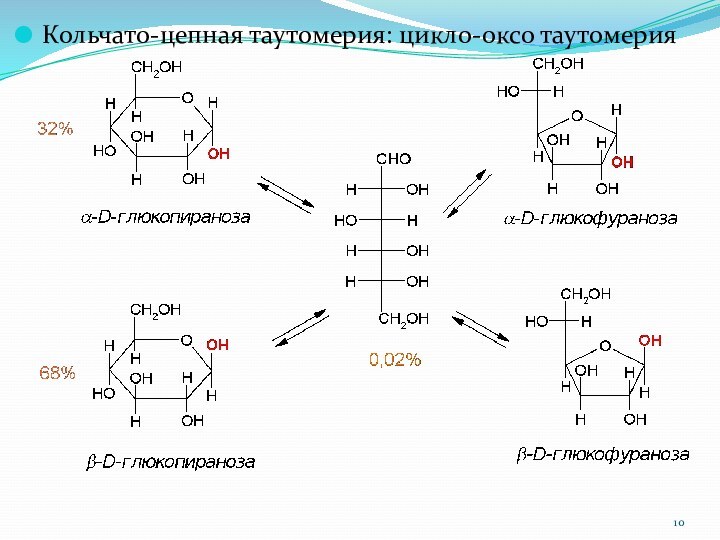
Кольчато-цепная таутомерия: цикло-оксо таутомерия
Слайд 11
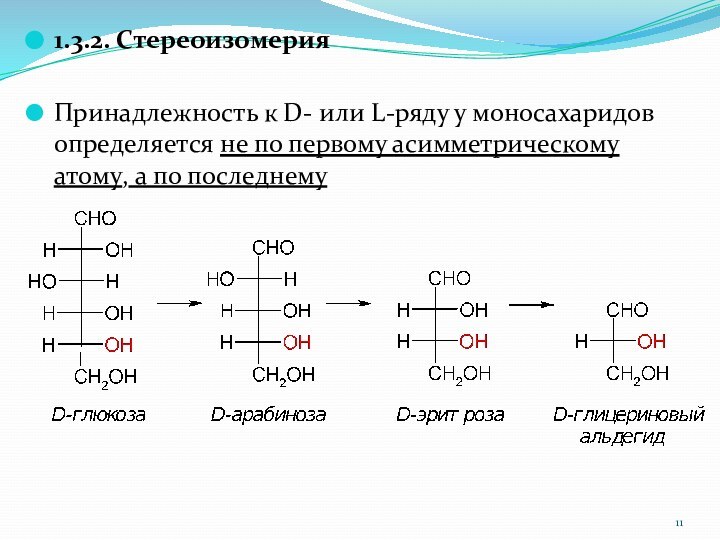
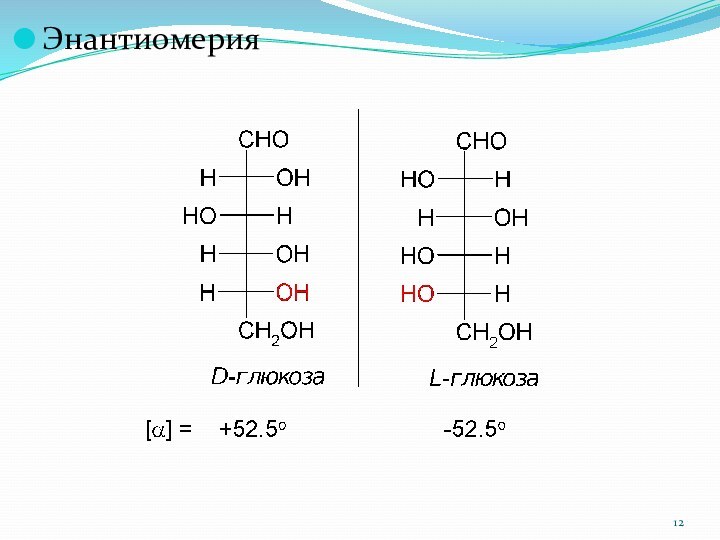
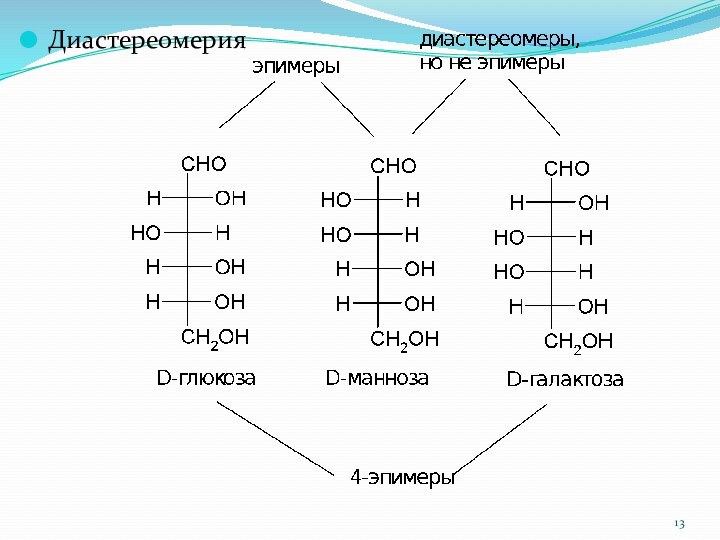
1.3.2. Стереоизомерия
Принадлежность к D- или L-ряду у моносахаридов
определяется не по первому асимметрическому атому, а по последнему
Слайд 14
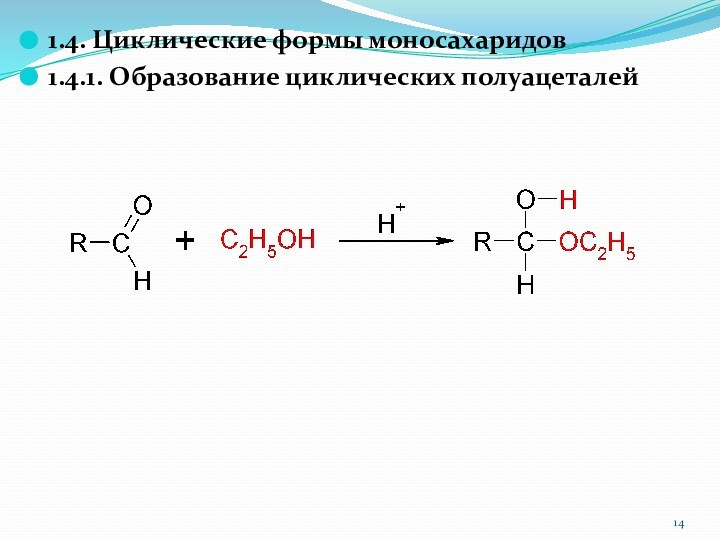
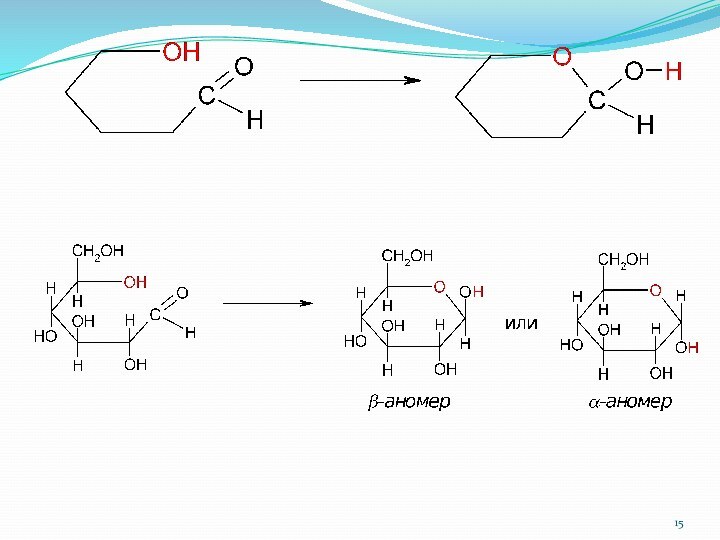
1.4. Циклические формы моносахаридов
1.4.1. Образование циклических полуацеталей
Слайд 16
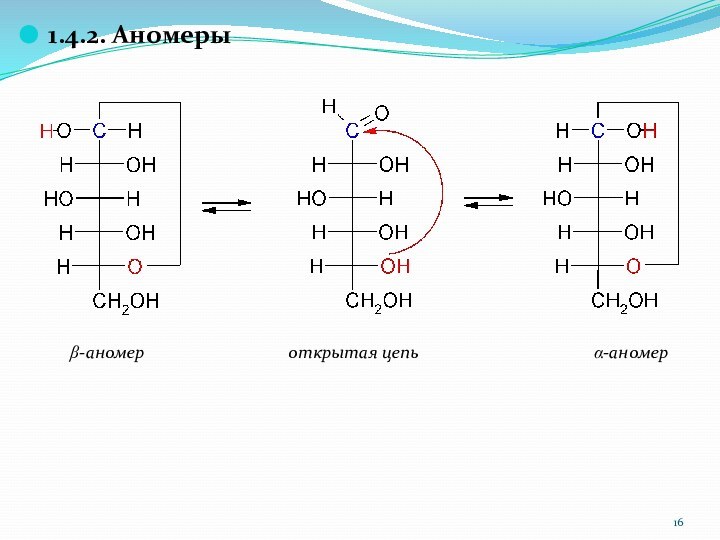
1.4.2. Аномеры
b-аномер
открытая цепь a-аномер
Слайд 17
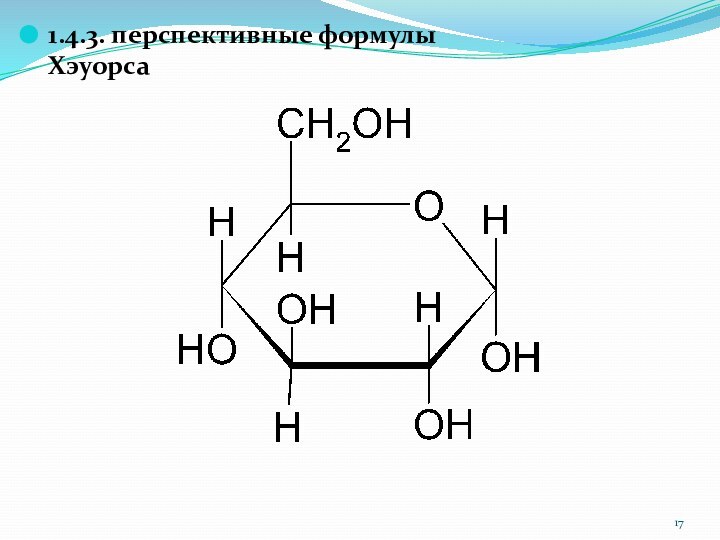
1.4.3. перспективные формулы Хэуорса
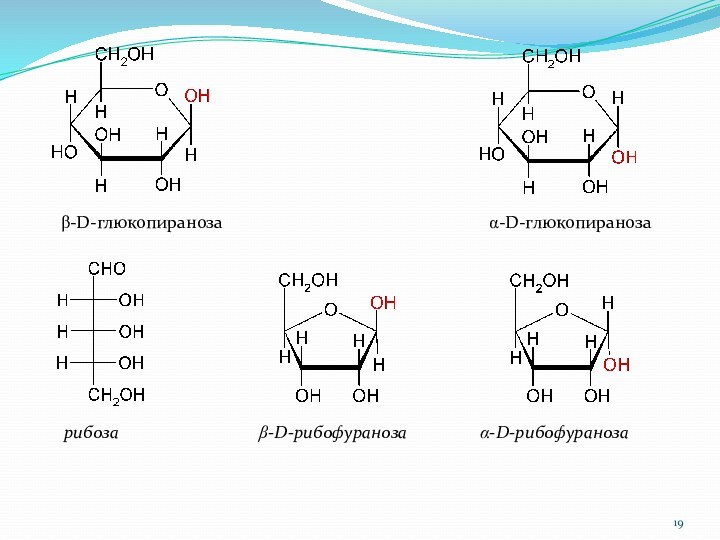
Слайд 19
b-D-глюкопираноза
a-D-глюкопираноза
рибоза b-D-рибофураноза a-D-рибофураноза
Слайд 20
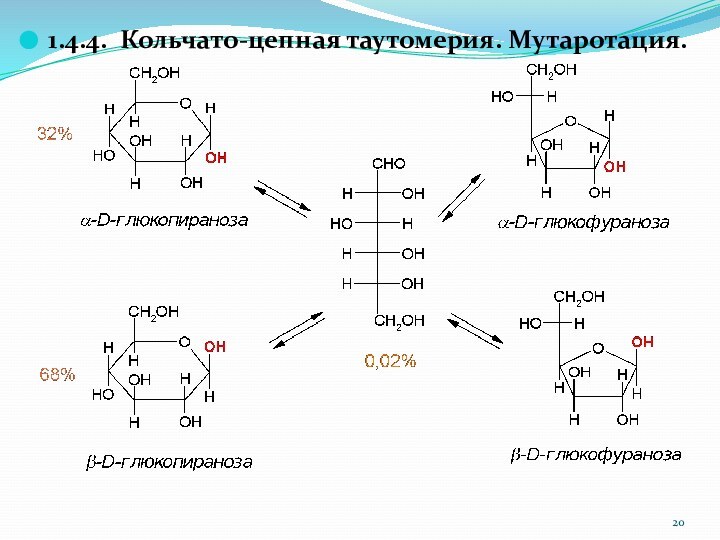
1.4.4. Кольчато-цепная таутомерия. Мутаротация.
Слайд 21
Кольчато-цепная таутомерия сопровождается закономерным явлением – мутаротацией.
Мутаротация (лат.
mutare – изменять, rotatio – вращение) в данном случае
это изменение вращения плоскости поляризации света свежеприготовленными растворами разных аномеров.
Например, a-D-глюкопираноза имеет удельное вращение [a] = +112o, а b-D-глюкопираноза имеет [a] = +19o. При стоянии свежеприготовленных растворов каждого из аномеров удельное вращение изменяется и достигает значения +52,5o, соответствующего равновесию.
Слайд 22
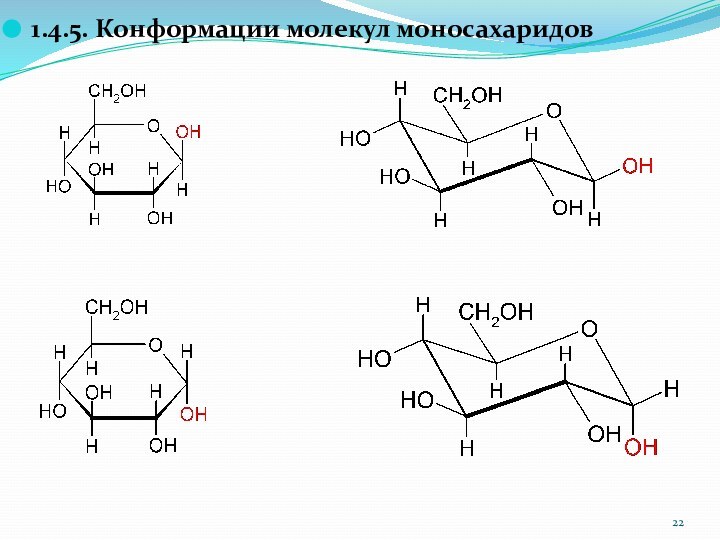
1.4.5. Конформации молекул моносахаридов
Слайд 23
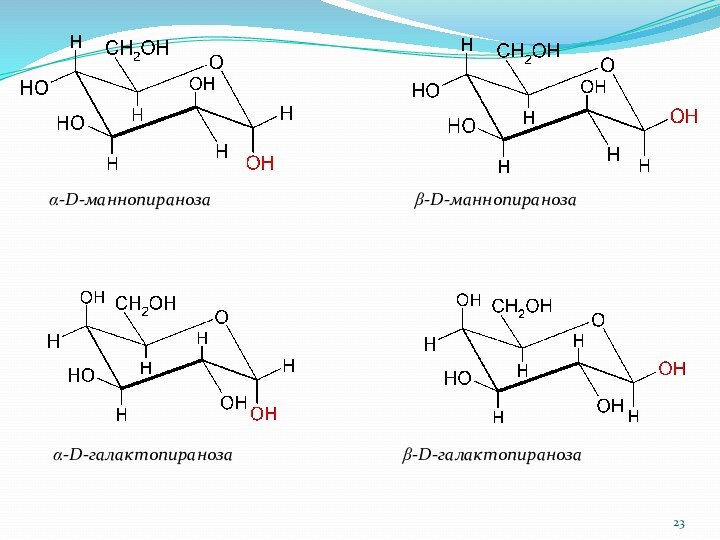
a-D-маннопираноза
b-D-маннопираноза
a-D-галактопираноза b-D-галактопираноза
Слайд 24
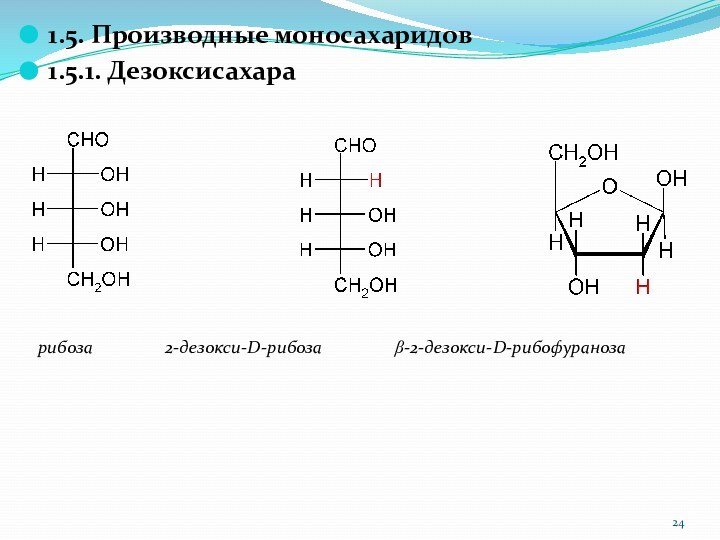
1.5. Производные моносахаридов
1.5.1. Дезоксисахара
рибоза
2-дезокси-D-рибоза
b-2-дезокси-D-рибофураноза
Слайд 25
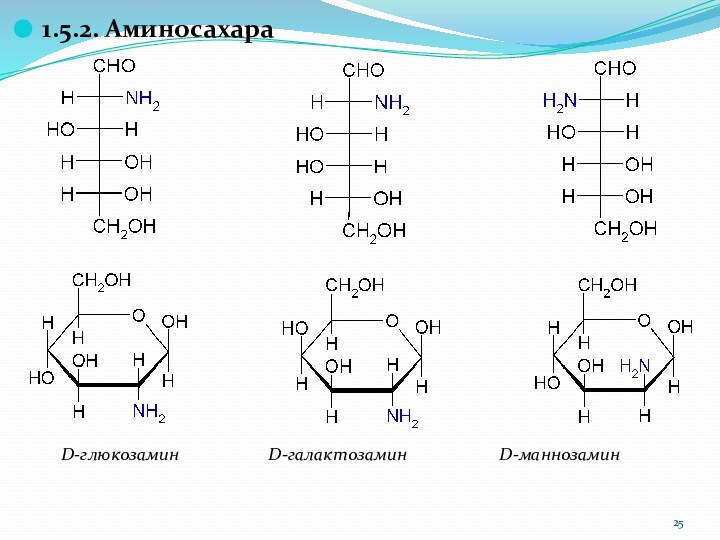
1.5.2. Аминосахара
D-глюкозамин
D-галактозамин
D-маннозамин
Слайд 26
1.6. Физические свойства
Моносахариды представляют собой бесцветные кристаллические вещества
очень хорошо растворимые в воде. Моносахариды трудно растворяются в
спирте, очень плохо в гидрофобных растворителях.
Концентрированные растворы сахаров в воде называются сиропами.
Слайд 27
1.7. Биологические свойства и значение
1.7.1 Метаболическое значение и
энергетическая функция
1.7.2. Структурная функция
1.7.3. Сладкий вкус
Слайд 28
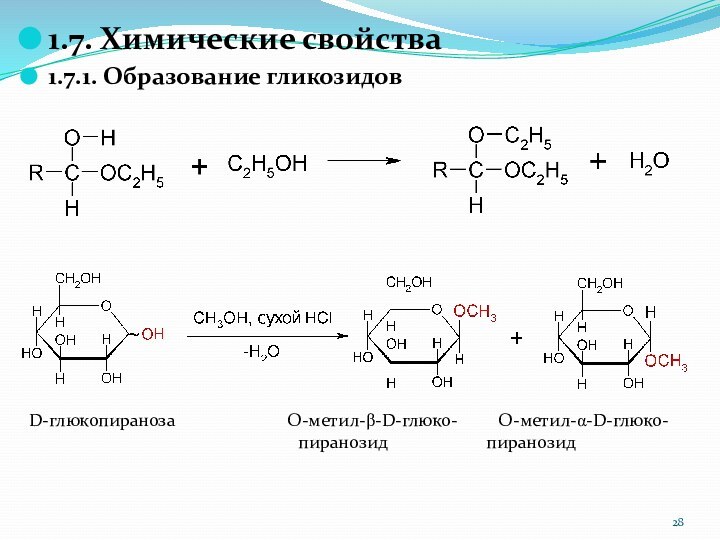
1.7. Химические свойства
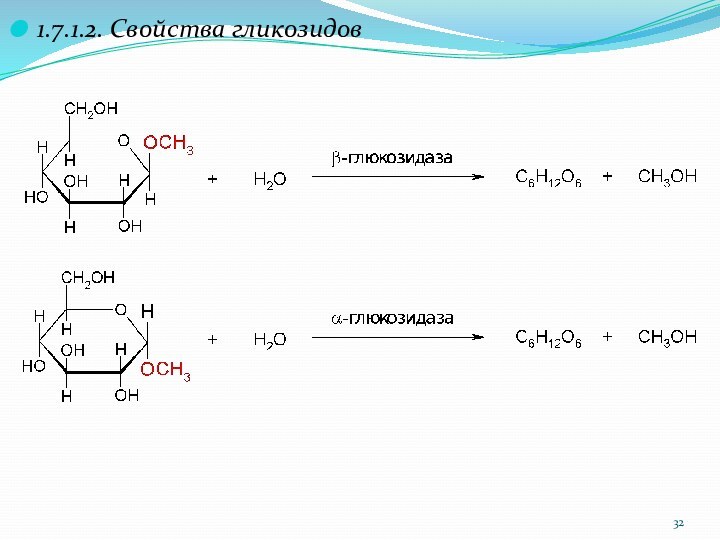
1.7.1. Образование гликозидов
D-глюкопираноза
O-метил-b-D-глюко- O-метил-a-D-глюко-
пиранозид пиранозид
Слайд 29
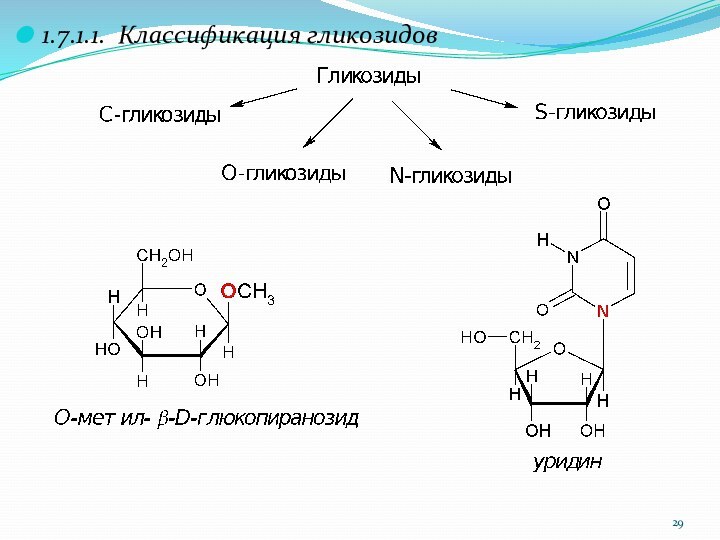
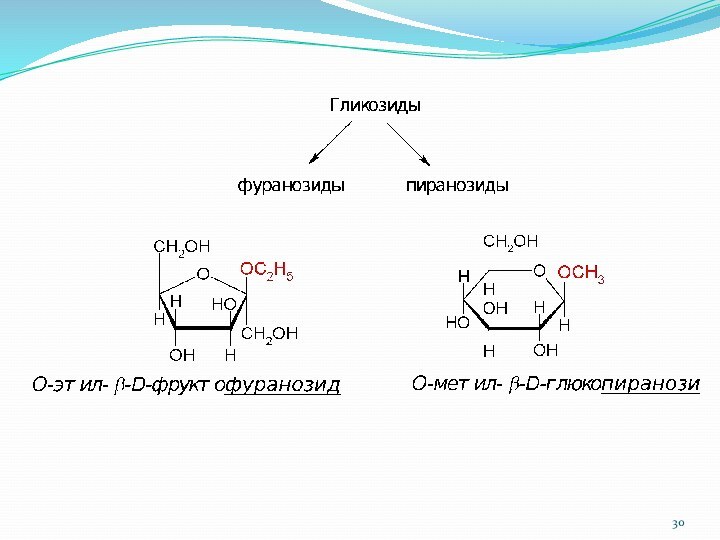
1.7.1.1. Классификация гликозидов
Слайд 33
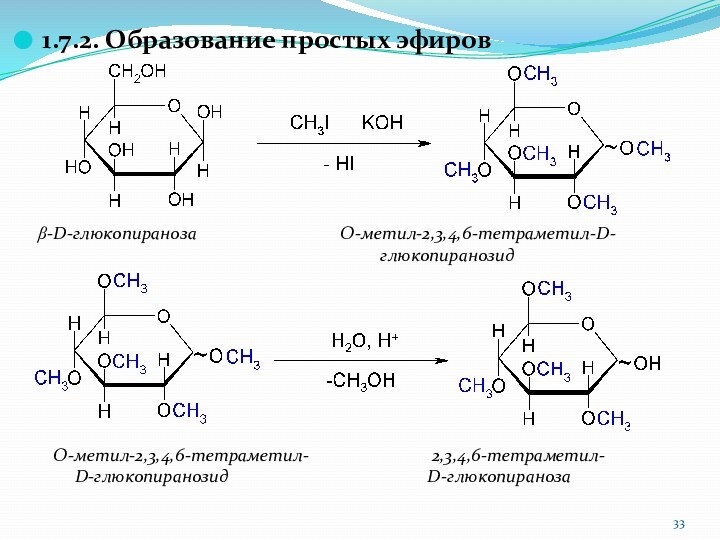
1.7.2. Образование простых эфиров
b-D-глюкопираноза
O-метил-2,3,4,6-тетраметил-D-
глюкопиранозид
O-метил-2,3,4,6-тетраметил- 2,3,4,6-тетраметил-
D-глюкопиранозид D-глюкопираноза
Слайд 34
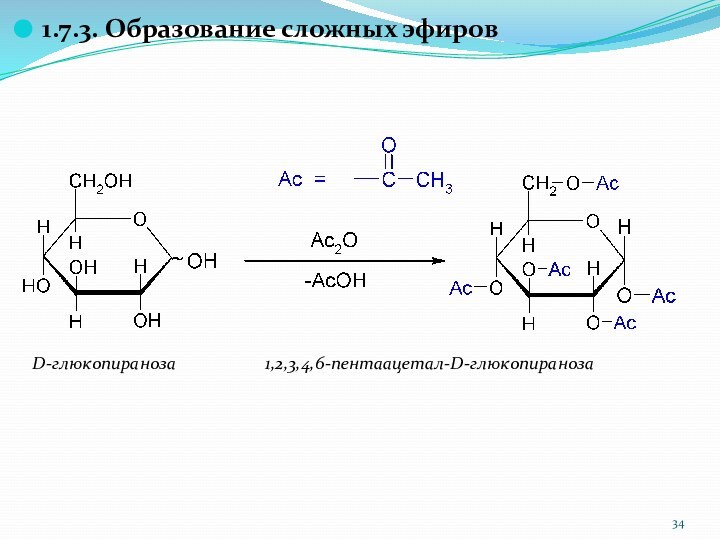
1.7.3. Образование сложных эфиров
D-глюкопираноза 1,2,3,4,6-пентаацетал-D-глюкопираноза
Слайд 35
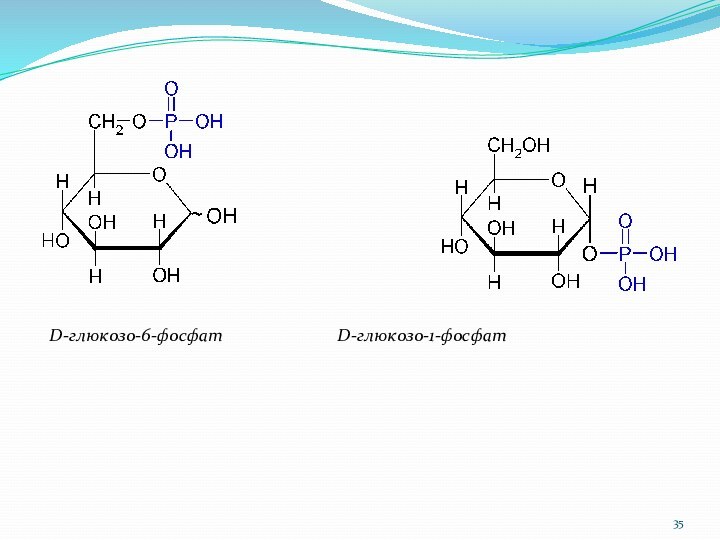
D-глюкозо-6-фосфат D-глюкозо-1-фосфат
Слайд 36
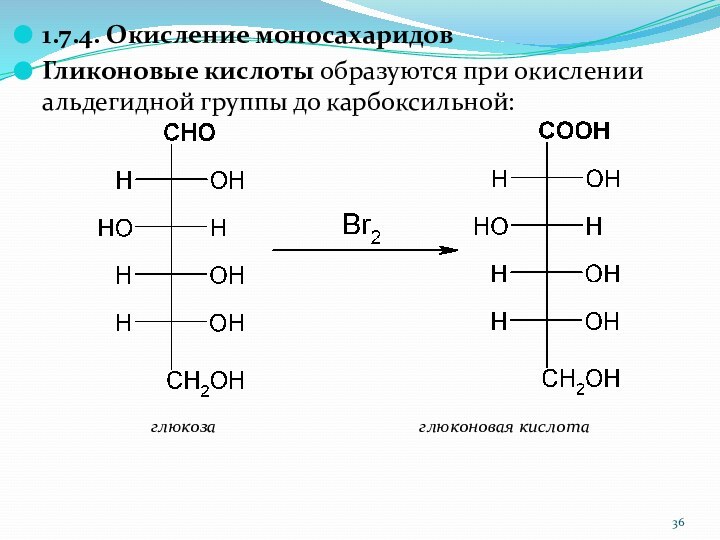
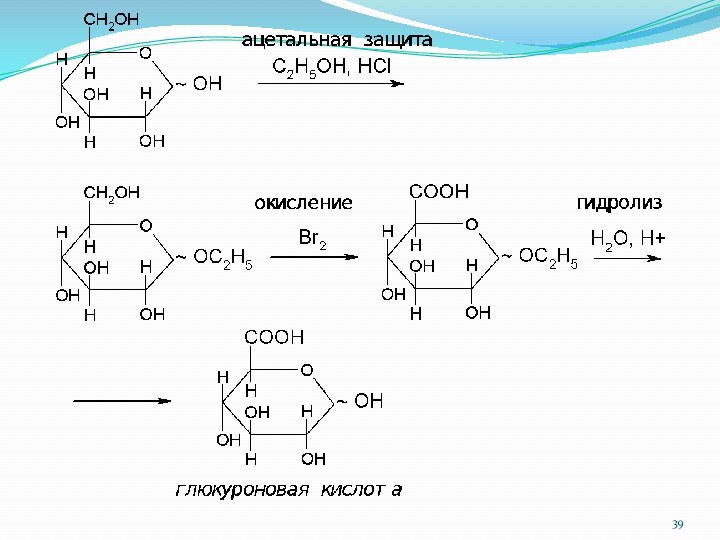
1.7.4. Окисление моносахаридов
Гликоновые кислоты образуются при окислении альдегидной
группы до карбоксильной:
глюкоза
глюконовая кислота
Слайд 37
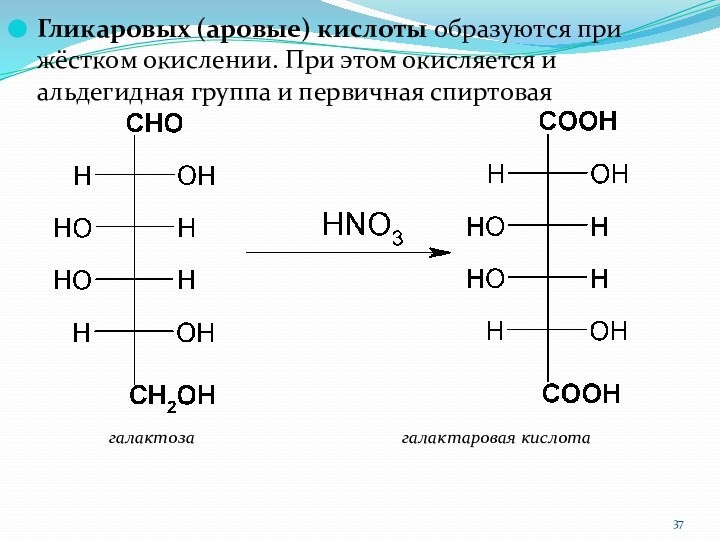
Гликаровых (аровые) кислоты образуются при жёстком окислении. При
этом окисляется и альдегидная группа и первичная спиртовая
галактоза галактаровая кислота
Слайд 38
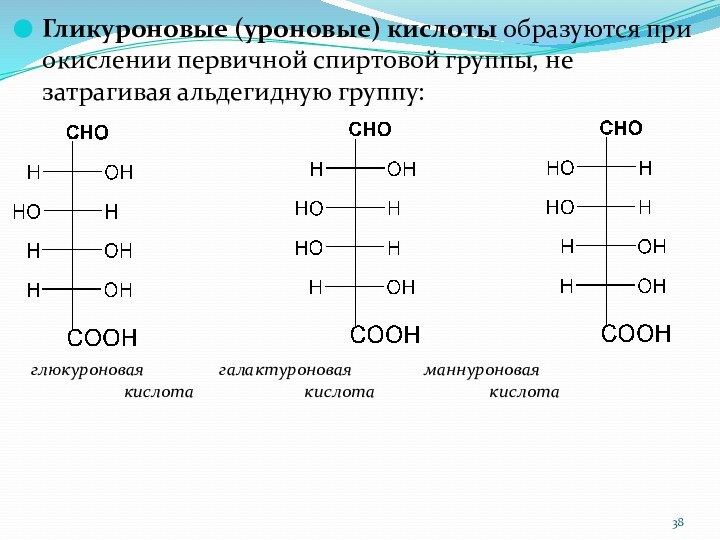
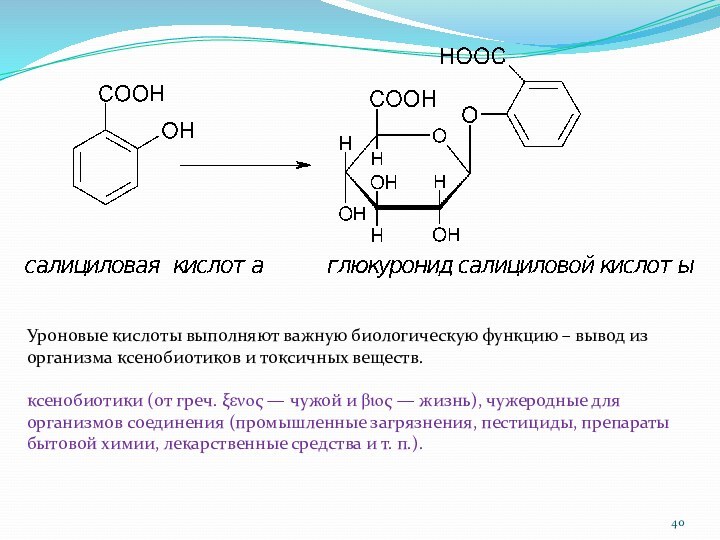
Гликуроновые (уроновые) кислоты образуются при окислении первичной спиртовой
группы, не затрагивая альдегидную группу:
глюкуроновая галактуроновая
маннуроновая
кислота кислота кислота
Слайд 40
Уроновые кислоты выполняют важную биологическую функцию – вывод
из организма ксенобиотиков и токсичных веществ.
ксенобиотики (от греч. eno
— чужой и bio — жизнь), чужеродные для организмов соединения (промышленные загрязнения, пестициды, препараты бытовой химии, лекарственные средства и т. п.).
Слайд 41
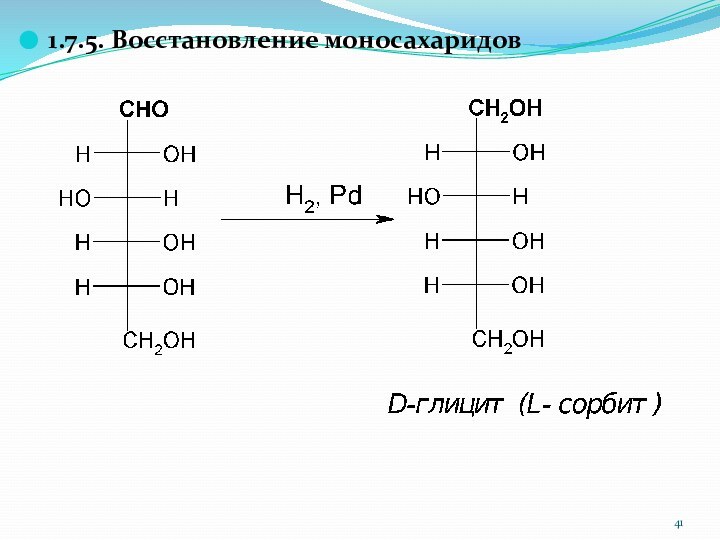
1.7.5. Восстановление моносахаридов
Слайд 42
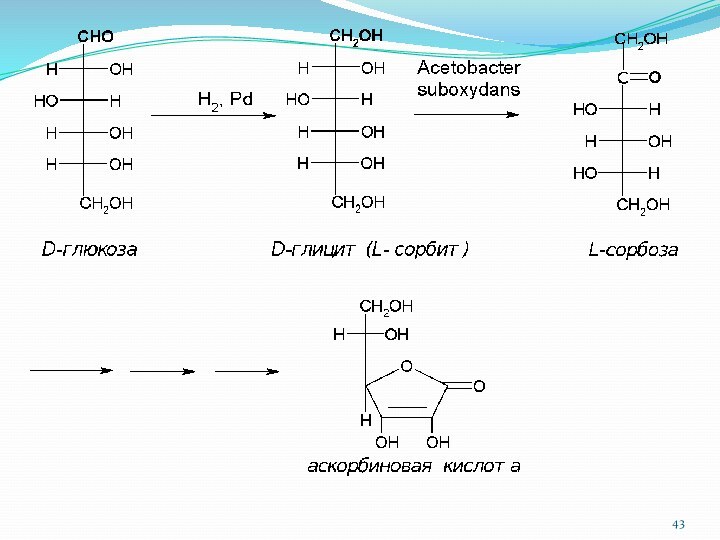
Ксилоза → ксилит (E967)
Манноза → маннит
Глюкоза → глицит(сорбит) E420
http://www.sorbit.ru/
Слайд 44
Аскорбиновая кислота (витамин С), С6Н8О6, водорастворимый витамин. Отсутствие
аскорбиновой кислоты в пище человека понижает сопротивляемость к заболеваниям,
вызывает цингу, заболевание, ранее уносившее десятки тысяч жизней.
Слово “аскорбиновая” происходит от а – отрицающая частица и scorbutus – цинга. То есть аскорбиновая кислота означает “противоцинготная” кислота
Аскорбиновая кислота также используется в аналитической химии в аскорбинометрии, которую применяют для определения Fe(III), Hg(II), Au(III), Pt(IV), Ag(I), Ce(IV), Mo(VI), W(VI), I2, Br2, хлоратов, броматов, иодатов, ваданатов, дихроматов, а также нитро- нитрозо-, азо- и иминогрупп в органических соединениях.
Слайд 45
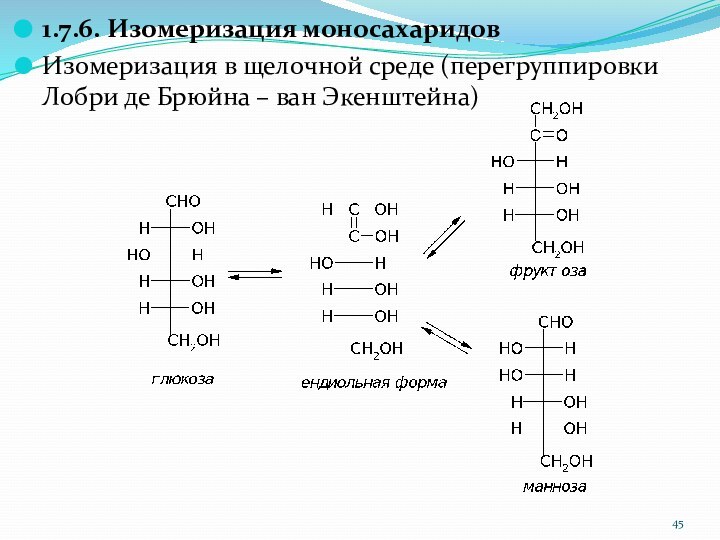
1.7.6. Изомеризация моносахаридов
Изомеризация в щелочной среде (перегруппировки Лобри
де Брюйна – ван Экенштейна)
Слайд 46
1.8. Получение моносахаридов
1.8.1. Природные источники
6 CO2 + 6
H2O → C6H12O6 + 6 O2
http://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B9%D0%BB:Plagiomnium_affine_laminazellen.jpeg
Слайд 47
1.8.2. Гидролиз дисахаридов, олигосахаридов и полисахаридов
Сахароза + H2O
→ глюкоза + фруктоза
Мальтоза + H2O → глюкоза +
глюкоза
Лактоза + H2O → глюкоза + галактоза