положения в
Периодической системе Д.И.Менделеева.
§ 2.
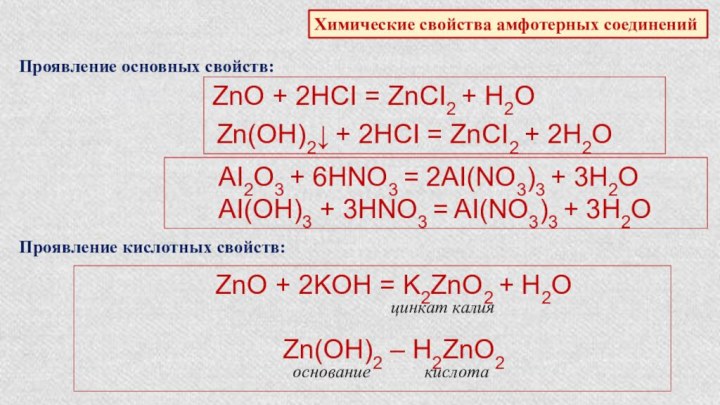
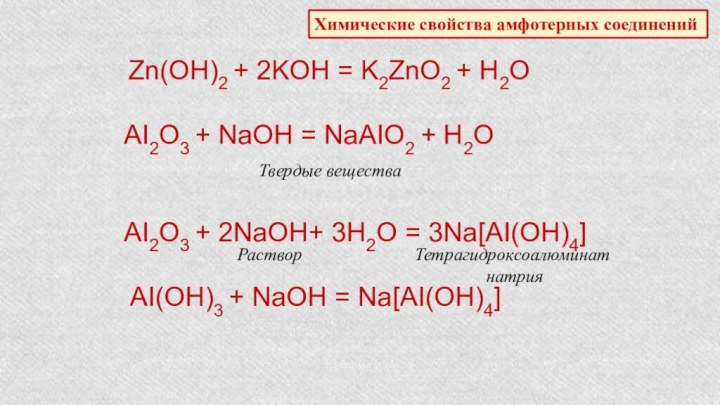
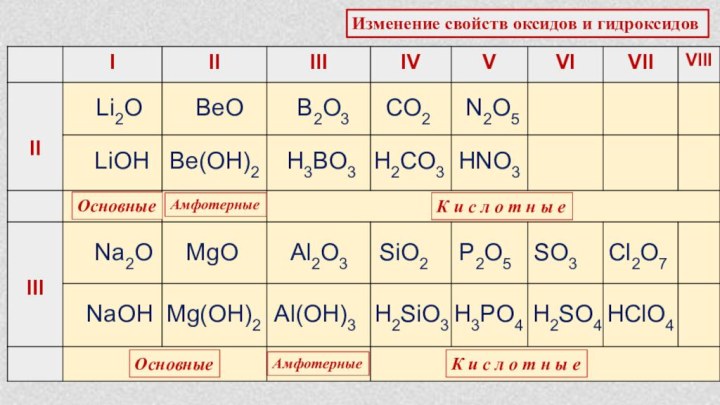
Характеристика химического элемента по кислотно-основным свойствамобразуемых им соединений. Амфотерные оксиды и гидроксиды.
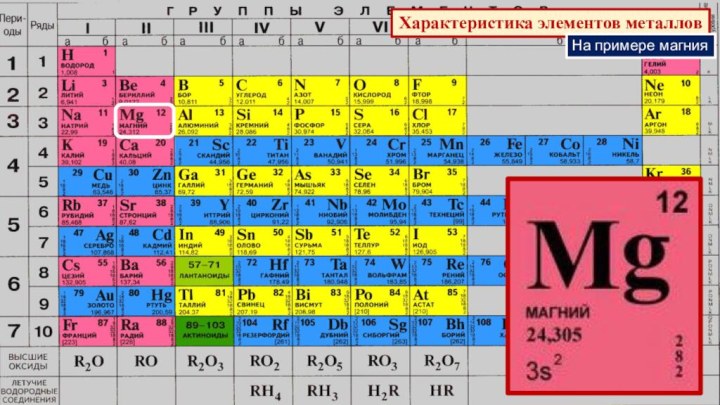
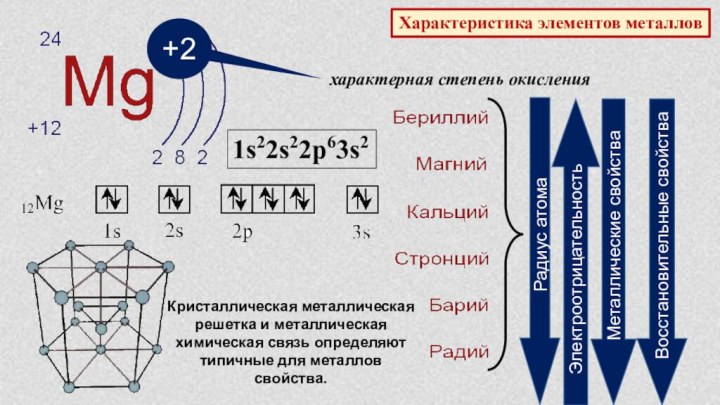
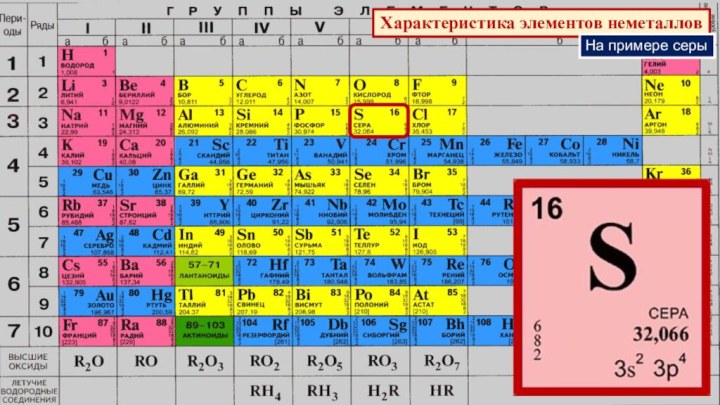
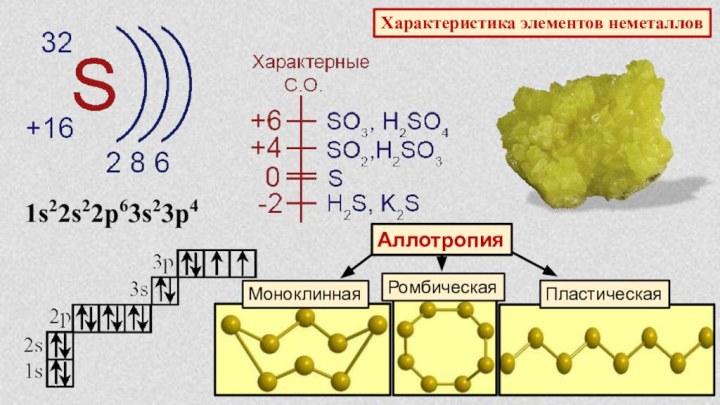
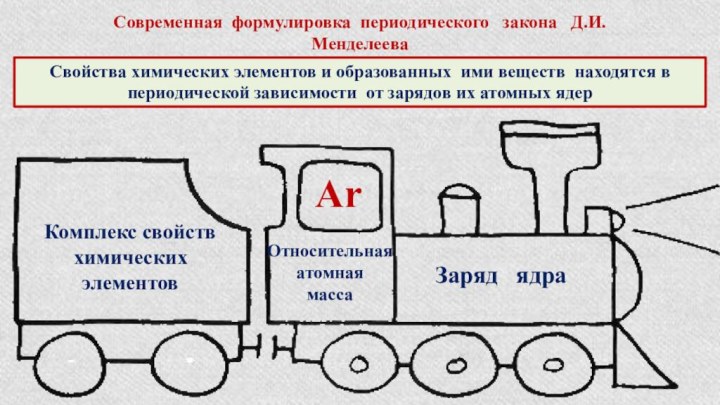
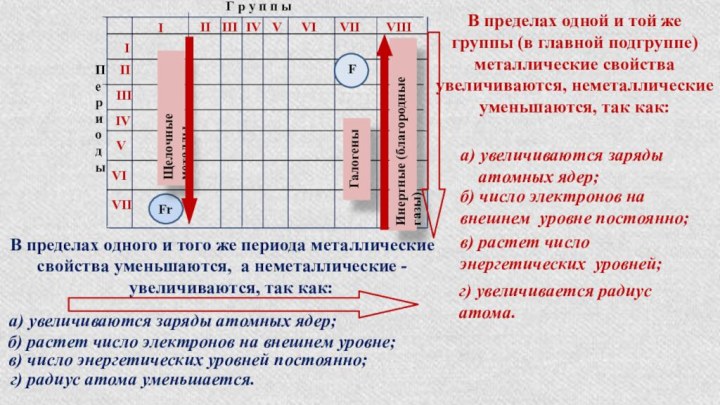
§ 3. Периодический закон и Периодическая система химических элементов
Д.И.Менделеева.
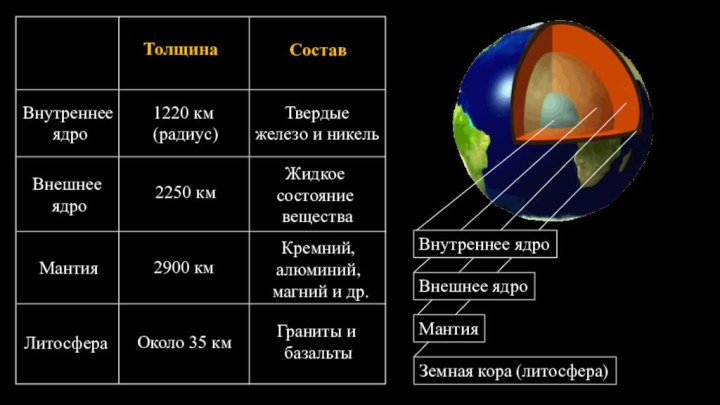
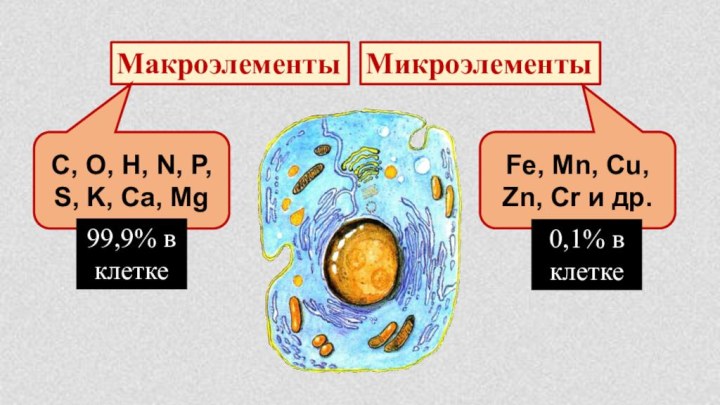
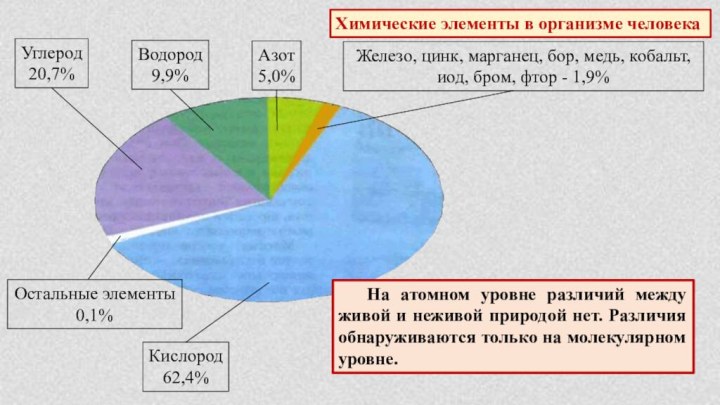
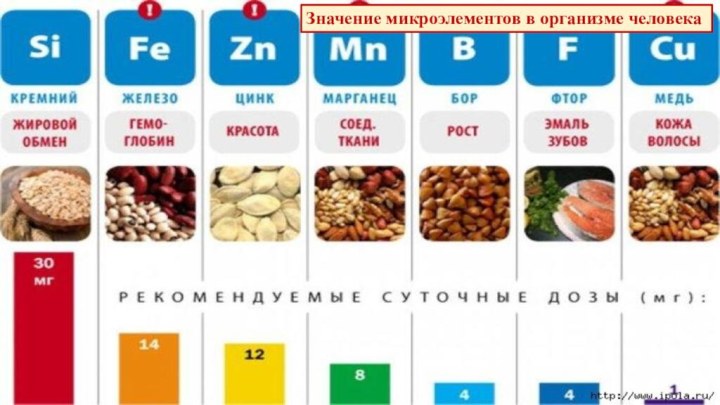
§ 4. Химическая организация природы.
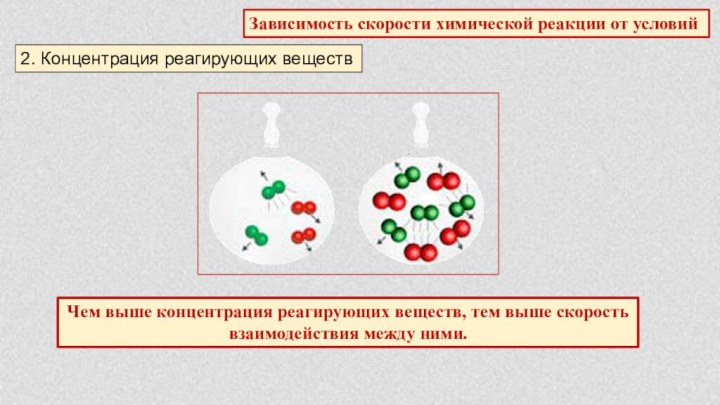
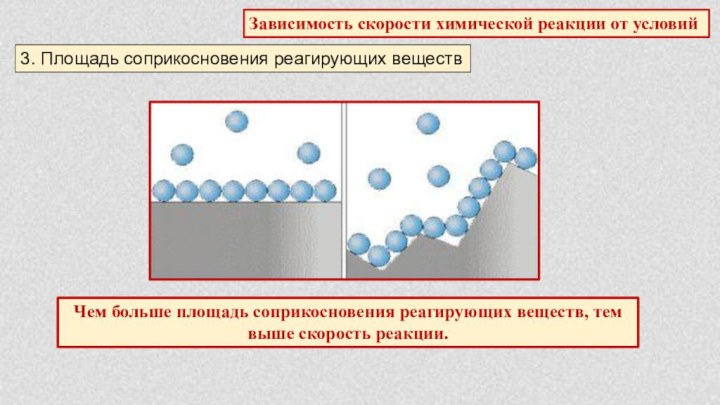
§ 5. Химические реакции. Скорость химической реакции.
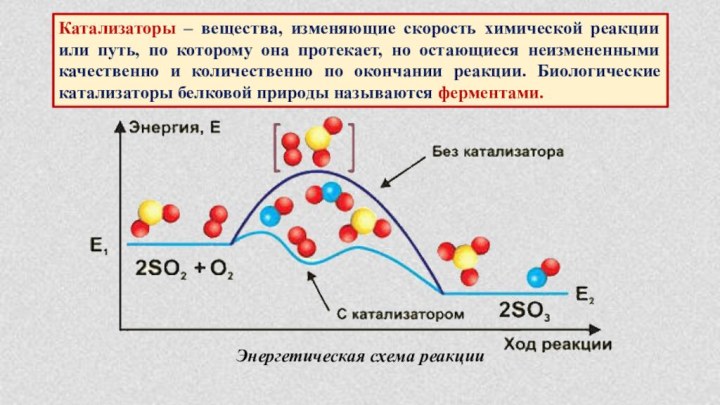
§ 6. Катализаторы и катализ.