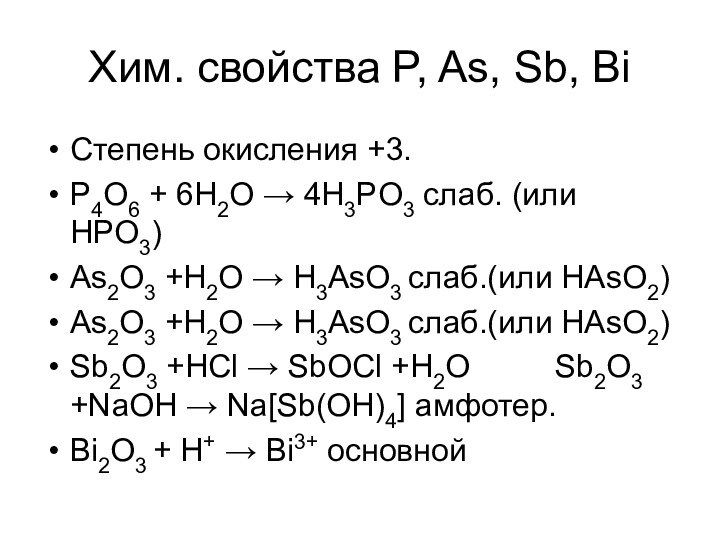
богата на количество соединений с различными степенями окисления.
9
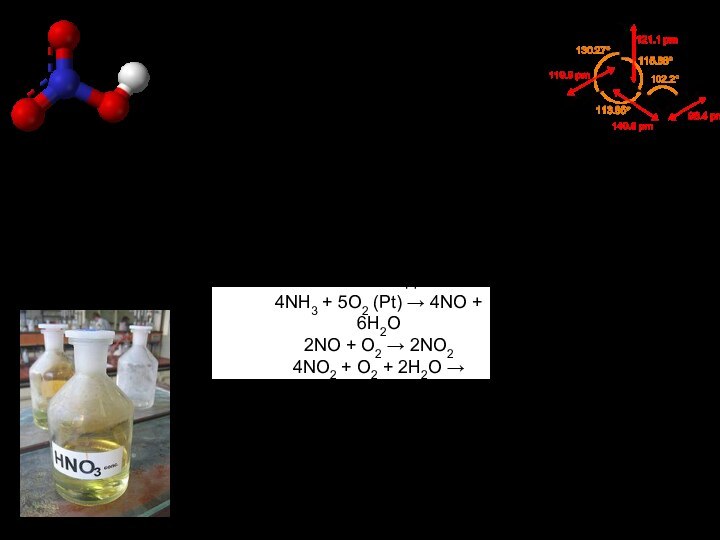
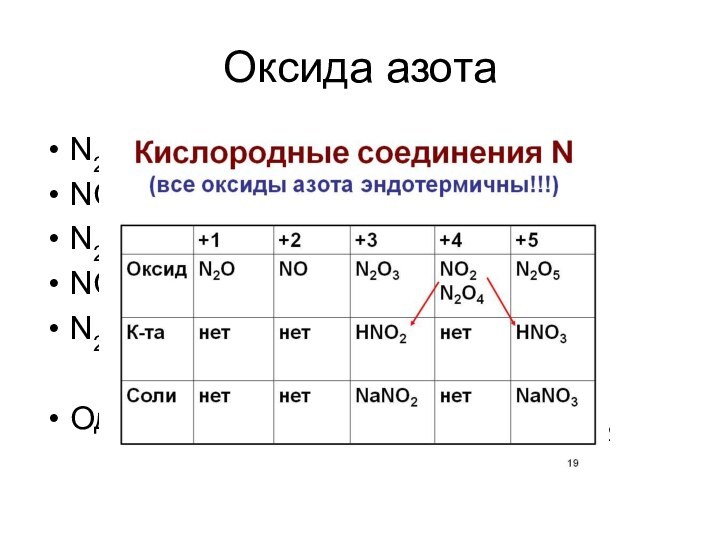
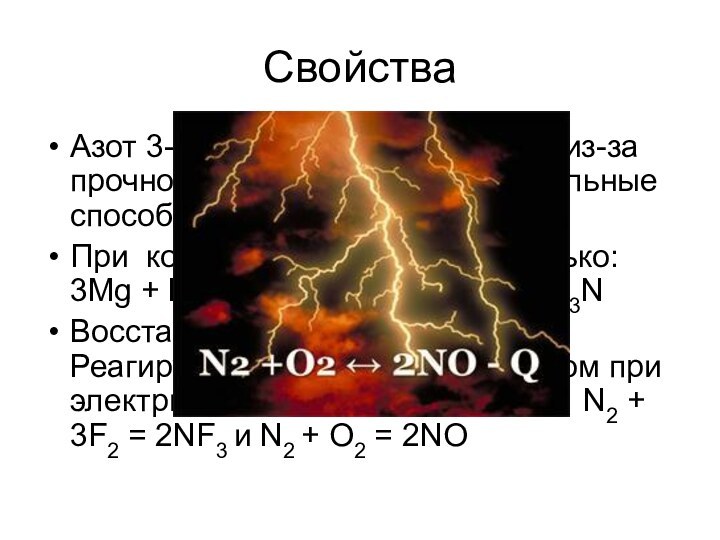
степеней окисления! От – 3 до +5.Основные: +5 (нитраты – NO3-)
+4 (NO2)
+3 (нитриты – NO2-)
+2 (NO)
+1 (N2O)
0 (N2)
-3 (NH3)
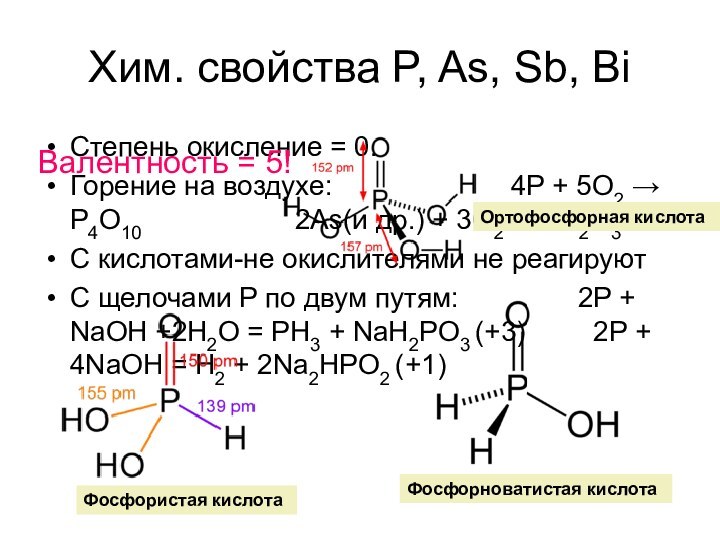
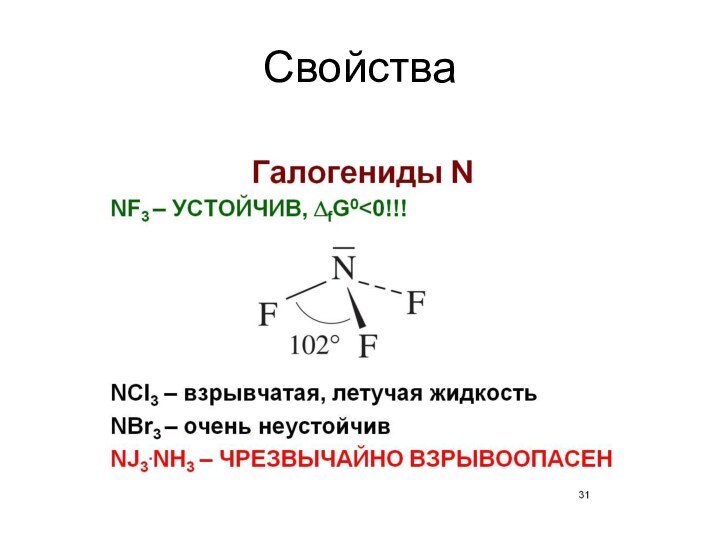
Для азота нет валентности - ?
5 не бывает! Потому что, валентность это количество обобществленных заполненных орбиталей.
А у азота их только 4! Максимальная валентность 4!
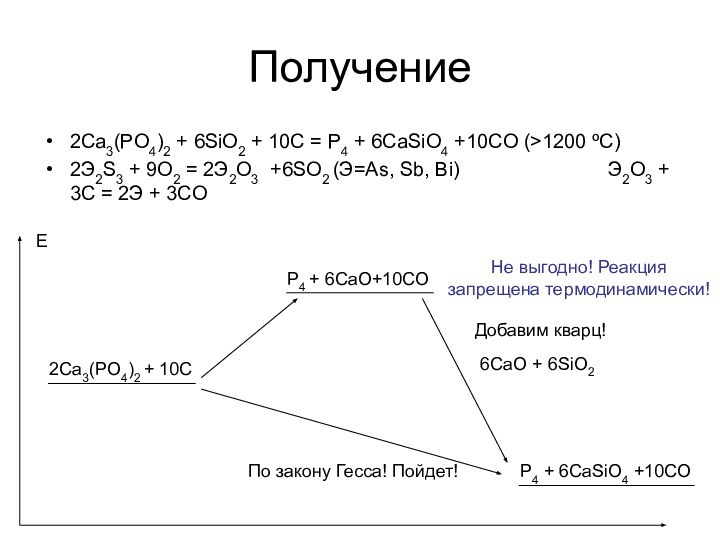
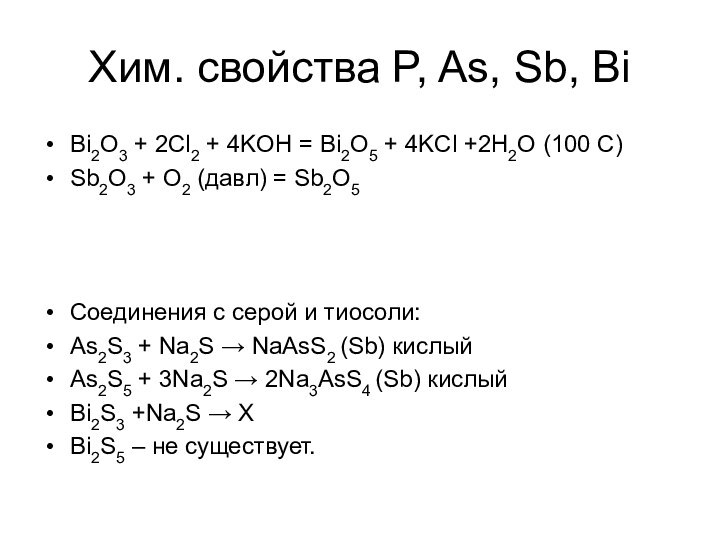
P4 – белый фосфор (куб./ромб.), пары.
Pn – красный фосфор, черный фосфор.
Металлический фосфор
При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Здесь нет металлического фосфора. Есть «желтый» - смесь красного и белого!









![Химия элементов VA группы АммиакКомплексообразованиеCuSO4 + 4NH3 → [Cu(NH3)4]SO4Ni(NO3)2 + 6NH3 → [Ni(NH3)6](NO3)2Соли аммония – б.ц., хорошо раств., термически нестойкие.Кисл-основн.:NH4Cl](/img/tmb/15/1476084/e1fc22c008cb66709bd036876d551778-720x.jpg)