- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Сера и ее соединения
Содержание
- 2. Сера и ее соединения.Учитель химии Яценко А.Э.МБОУ СОШ №1, ЗАТО Озерный
- 3. 1. Положение в ПСХЭ Д.И.Менделеева. Особенности строения
- 5. Строение внешнего электронного слоя атома серы аналогично
- 6. Антуан Лоран Лавуазье 1743–1794 гг. Установил элементарную природу
- 7. Самородная сераСульфидная сераСульфатная сераКиноварьHgSPbSГаленитCuFeS2ХалькопиритГипсCaSO4•2H2O2. Нахождение серы в природе.Халькогены от греч. «рождающие руды»
- 9. Если организму недостаточно серы, то наблюдается хрупкость и ломкость костей, а также выпадение волос.
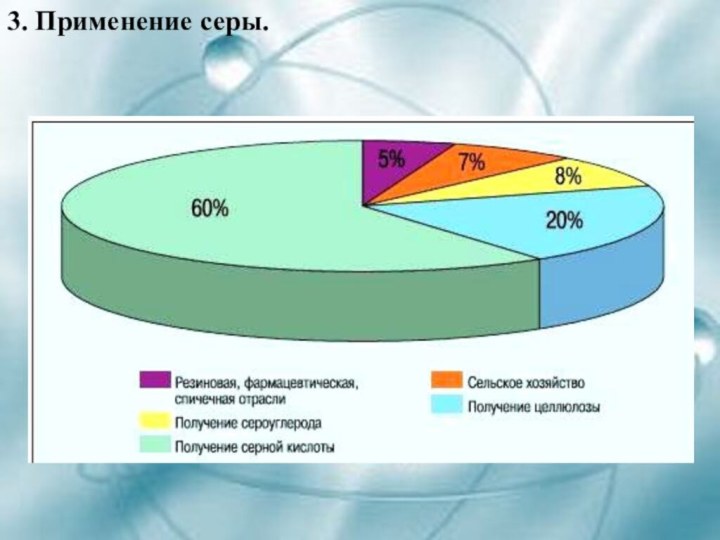
- 11. 3. Применение серы.
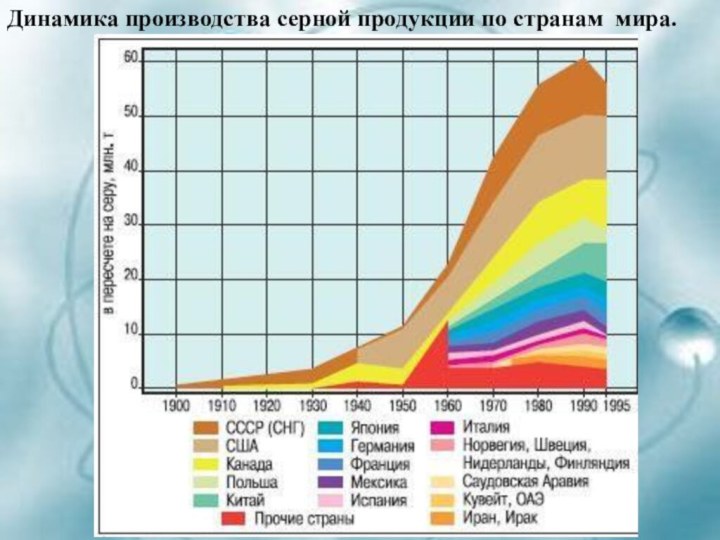
- 12. Динамика производства серной продукции по странам мира.
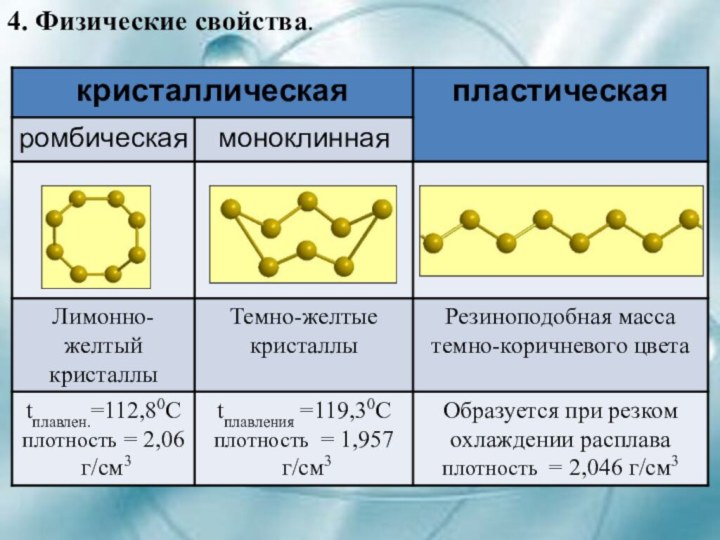
- 13. 4. Физические свойства.
- 15. 5. Химические свойства.Взаимодействие с металлами:а) щелочными/щелочноземельнымиб) с
- 16. Химические свойства серыMg + S = MgS2Al
- 17. Химические свойства серыZn + S = ZnSС
- 18. Химические свойства серыS + O2 = SO2Из
- 19. Взаимодействие с концентр. азотной кислотойS+HNO3→SO2+NO2+H2O Взаимодействие
- 20. Вставьте пропущенные слова1. Сера- элемент… группы, …
- 21. Домашнее задание:1. П.22 (читать), учить свойства серы
- 22. Серная кислотаH2SO4
- 23. Характеристика:По основности: двухосновнаяПо наличию кислорода: кислородосодержащаяПо силе:
- 24. Агрегатное состояние – жидкостьТяжелая маслянистая жидкость ("купоросное
- 25. С металлами (в ряду активности металлов до
- 26. ОСОБОЕ СВОЙСТВО КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ – ВЗАИМОДЕЙСТВИЕ
- 27. Автоцистерна для перевозки серной кислоты
- 28. Соли H2SO4Они могут быть как растворимыми, так
- 29. В природе встречается 180 минералов сульфатов, и
- 30. 2Н2О)(CaSO4В Мексике не так давно обнаружили пещеру
- 31. Применение H2SO41. В производстве минеральных удобрений2. Как
- 32. S SO2 SO3 H2SO4 S+O2=SO2 2SO2+O2=2SO3 SO3+H2O=H2SO4
- 33. Серная кислота в природеКислые озёра
- 34. Скачать презентацию
- 35. Похожие презентации




























Слайд 3
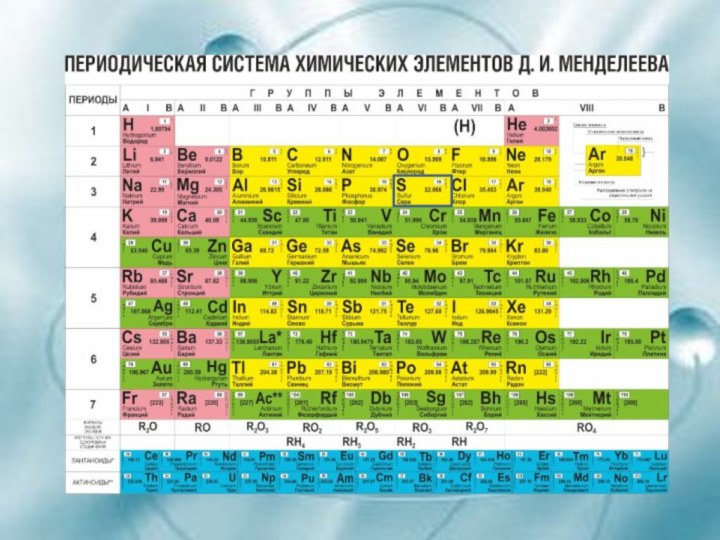
1. Положение в ПСХЭ Д.И.Менделеева. Особенности строения атома.
1.
Где находится в таблице Д.И. Менделеева?
2. Из чего
состоит атом?3. Как расположены электроны в атоме?
4. Тип орбитали?
5. Какие реализуются степени окисления?
Слайд 5 Строение внешнего электронного слоя атома серы аналогично атому
кислорода, то есть на внешнем энергетическом уровне расположено шесть
электронов, из которых четыре спаренных и два неспаренных.Атомы серы обладают меньшим значением электроотрицательности и большим радиусом атома. В соединениях сера проявляет степени окисления -2, +2, +4, +6.
Слайд 6
Антуан Лоран Лавуазье
1743–1794 гг.
Установил элементарную природу серы
1 ноября 1772 г. в опытах по сжиганию.
Название
«сера» восходит к лат. sera — «воск» или лат. serum — «сыворотка». Лат. «sulphur» предположительно восходит к индоевропейскому корню «swelp» — «гореть».
Слайд 7
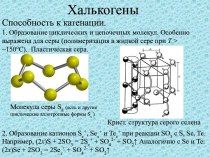
Самородная
сера
Сульфидная сера
Сульфатная сера
Киноварь
HgS
PbS
Галенит
CuFeS2
Халькопирит
Гипс
CaSO4•2H2O
2. Нахождение серы в природе.
Халькогены
от греч. «рождающие руды»
Слайд 9
Если организму недостаточно серы,
то наблюдается хрупкость и
ломкость костей, а также выпадение волос.
Слайд 15
5. Химические свойства.
Взаимодействие с металлами:
а) щелочными/щелочноземельными
б) с тяжелыми
в)
со ртутью (демеркуризация)
2. Взаимодействие с неметаллами:
а) с кислородом
б) с
водородомв) с хлором
3. Взаимодействие со сложными веществами:
KClO3, HNO3, H2SO4.
Слайд 16
Химические свойства серы
Mg + S = MgS
2Al +
3S = Al2S3
Взаимодействует со многими металлами, кроме золота и
платины:Взаимодействует со всеми щелочными, щёлочноземельными металлами, а также медью, ртутью и серебром при обычных условиях:
Cu + S = CuS
Hg + S = HgS
Слайд 17
Химические свойства серы
Zn + S = ZnS
С остальными
металлами сера реагирует при нагревании:
Окислительные свойства сера проявляет при
взаимодействии с некоторыми неметаллами:H2 + S = H2S
Слайд 18
Химические свойства серы
S + O2 = SO2
Из неметаллов
с серой не реагируют только азот, йод и благородные
газы. При взаимодействии с кислородом сера проявляет восстановительные свойства:
Слайд 19
Взаимодействие с концентр. азотной кислотой
S
+
HNO3
→
SO2
+
NO2
+
H2O
Взаимодействие с
углем и нитратом калия
Взаимодействие с бертолетовой солью
S +
KNO3 + С → K2S+ N2+ СО2S + KClO3 → KCl + SО2
Слайд 20
Вставьте пропущенные слова
1. Сера- элемент… группы, … подгруппы.
2.
В атоме серы …электронов.
3. На внешнем уровне в атоме
…электронов.4. Какие степени окисления проявляет сера:
а) +2, +3, +4. б) –2, 0, +4, +6. в) –1, –2, 0, +6.
5. При горении серы образуется:
а) сероводород; б) сульфид; в) сернистый газ.
6. В какой форме сера встречается в природе:
а) сульфатная; б) гидросульфидная; в) сульфитная.
7. С какой целью серу применяют в сельском хозяйстве:
а) как удобрение; б) для борьбы с вредителями; в) для подкормки скота
8. Составьте формулы сульфидов натрия, магния, алюминия.
Проверь себя
Слайд 21
Домашнее задание:
1. П.22 (читать), учить свойства серы в
конспекте.
2. Осуществите превращения. Назовите полученные вещества.
S – SO2 -
SO3 – H2SO4l
Na2S
3.Вычислите объем серной кислоты, который можно получить взаимодействием 120 литров оксида серы VI с водой.
Слайд 23
Характеристика:
По основности: двухосновная
По наличию кислорода: кислородосодержащая
По силе: сильный
электролит
Это тяжёлая жидкость, которая в любом соотношении смешивается с
водой, имеет молекулярную решётку и ковалентную полярную связь
Слайд 24
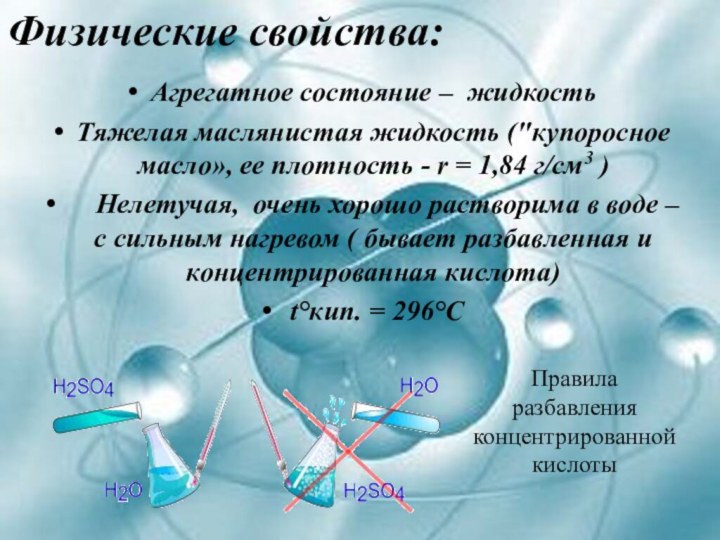
Агрегатное состояние – жидкость
Тяжелая маслянистая жидкость ("купоросное масло»,
ее плотность - r = 1,84 г/см3 )
Нелетучая, очень хорошо растворима в воде – с сильным нагревом ( бывает разбавленная и концентрированная кислота)t°кип. = 296°С
Правила
разбавления
концентрированной
кислоты
Физические свойства:
Слайд 25
С металлами (в ряду активности металлов до водорода):
H2SO4+Zn=ZnSO4
+ H2
2. С оксидами металлов:
H2SO4+K2O=K2SO4+H2O
3. С гидроксидами металлов:
H2SO4+2NaOH=Na2SO4+2H2O
4. С
солями:H2SO4+MgCO3=MgSO4+H2O+CO2
Химические свойства:
Слайд 26
ОСОБОЕ СВОЙСТВО КОНЦЕНТРИРОВАННОЙ
СЕРНОЙ КИСЛОТЫ –
ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
При
взаимодействии концентрированной серной кислоты с металлами до водорода возможно
образование газа-сероводорода или серы.Концентрированная серная кислота при нагревании может взаимодействовать с металлами, расположенными в ряду напряжений металлов правее водорода.
При этом продуктом реакции является сернистый газ:
Cu + H2SO4 ----CuSO4 + SO2 + H2O
Zn + H2SO4 ---ZnSO4 + S + H2O
В этих реакциях серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления.
Слайд 28
Соли H2SO4
Они могут быть как растворимыми, так и
нерастворимыми
Химические свойства сульфатов:
1. С металлами (прибавляемый металл должен быть
активнее металла в соли):CuSO4+Fe=FeSO4+Cu
2. С щелочами:
FeSO4+2NaOH=Na2SO4+Fe(OH)2
3. С другими солями:
К2SO4+BaСl2=2КСl+BaSO4
Сульфаты (SO4) – средние соли
Гидросульфаты (НSO4) – кислые соли
Слайд 29 В природе встречается 180 минералов сульфатов, и на
их долю приходится ~0,5 % массы земной коры.
Их даже
много и в морской воде, особенно в лагунах по берегам морей. Много сульфатов и в горячих водных растворах, просачивающихся из глубин Земли.
Слайд 31
Применение H2SO4
1. В производстве минеральных удобрений
2. Как электролит
в свинцовых аккумуляторах
3. Для получения различных минеральных кислот и
солей4. В нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности
5. В пищевой промышленности (пищевая добавка Е513)