- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Сероводород. Сульфиды
Содержание
- 2. молекулярная формула Н2S степень окисления серы (-2) Ковалентная полярная связь
- 3. Строение
- 4. Молекула сероводорода имеет угловую форму,
- 5. Нахождение в природе в свободном состоянии
- 6. в растворенном и отчасти в свободном состоянии
- 7. в небольших количествах он образуется всюду, где происходит разложение или гниение органических веществ
- 8. в небольших количествах он образуется всюду, где
- 9. Д воздух -?М(Воздух)= 29 г/мольМ(H2S)= 34 г/мольД
- 10. Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да)
- 11. 1. В лаборатории сероводород получают взаимодействием сульфида
- 12. 1 ступень H2S →
- 13. Взаимодействуют:- меняют окраску индикаторов-с основаниями-основными и амфотерными оксидамиметалламисолямиОбщие свойства кислот
- 14. H2S + NaOH → NaHS +
- 15. Сероводород горит на воздухе голубым
- 16. Сероводород обладает свойствами восстановителя: если
- 17. Влияние сероводорода на окружающую среду и здоровье
- 18. Сероводород из-за своей токсичности находит
- 20. Сульфиды калия, стронция и
- 23. Скачать презентацию
- 24. Похожие презентации
молекулярная формула Н2S степень окисления серы (-2) Ковалентная полярная связь

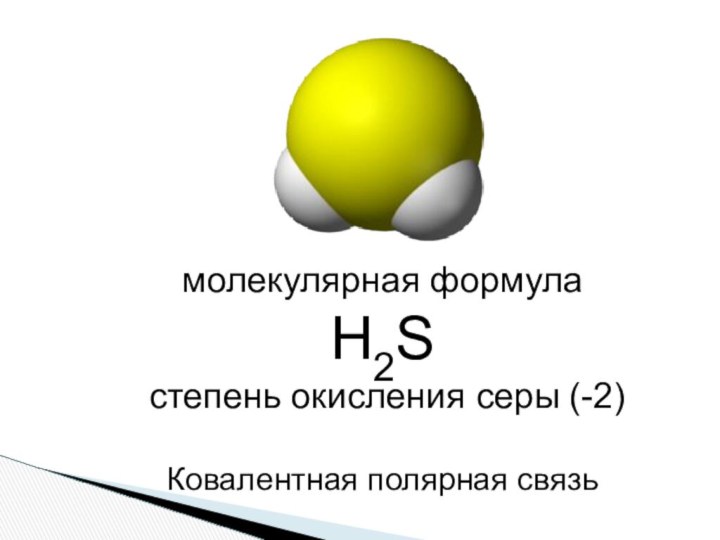
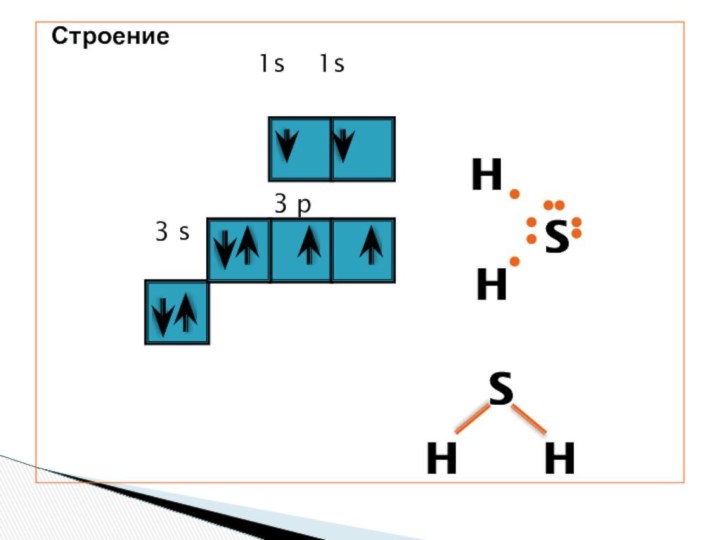




















Слайд 4 Молекула сероводорода имеет угловую форму, поэтому
она полярна. В отличие от молекул воды, атомы водорода
в молекуле не образуют прочных водородных связей, поэтому сероводород является газом.
Слайд 5
Нахождение в природе
в свободном состоянии встречается
в составе вулканических газов, во многих источниках вулканических местностей,
входит в состав вулканического пеплаСлайд 6 в растворенном и отчасти в свободном состоянии сероводород
содержится в Черном море, начиная с глубины 200 и
более метровСлайд 7 в небольших количествах он образуется всюду, где происходит
разложение или гниение органических веществ
Слайд 8
в небольших количествах он образуется всюду, где происходит
разложение или гниение органических веществ: она присутствует в минеральных
грязях, образующихся на дне неглубоких соляных озер
Слайд 9
Д воздух -?
М(Воздух)= 29 г/моль
М(H2S)= 34 г/моль
Д воздух
= 34:29=1,17
Д воздух =1,17
Вывод: Сероводород немного тяжелее воздуха.
Определение
плотности по воздуху
Слайд 10
Сероводоро́д
(серни́стый водоро́д, сульфи́д водоро́да)
1. Бесцветный газ с запахом тухлых яиц и сладковатым
вкусом.2. Плохо растворим в воде, хорошо — в этаноле.
При t = 20 º в одном объеме воды растворяется 2,4 объема сероводорода, этот раствор называют сероводородной водой или слабой сероводородной кислотой.
3. Ядовит!
4. Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2).
Физические свойства
Слайд 11 1. В лаборатории сероводород получают взаимодействием сульфида железа
с соляной или разбавленной серной кислотами:
FeS + H2SO4 →
FeSO4 + H2S↑2. Синтезом из серы и водорода:
H2 + S → H2S↑
3. Взаимодействием сульфида
алюминия с водой
(эта реакция отличается
чистотой полученного сероводорода):
Al2S3+6H2O → 3H2S+2Al(OH)3
Способы получения
Слайд 12 1 ступень H2S → H+
+ HS-
2 ступень HS- ↔
H+ + S2- Диссоциация по второй ступени практически не протекает, так как это слабая кислота.
Она дает 2 типа солей:
HS- (I) S2-
гидросульфиды сульфиды
Диссоциация сероводородной кислоты:
Слайд 13
Взаимодействуют:
- меняют окраску индикаторов
-с основаниями
-основными и амфотерными оксидами
металлами
солями
Общие
свойства кислот
Слайд 14
H2S + NaOH → NaHS + H2O
избыток
H2S
+ 2NaOH → Na2S + 2H2O
избыток
NaHS – гидросульфид
натрияNa2S - сульфид натрия
Сероводородная кислота вступает со щелочами в реакцию нейтрализации:
Слайд 15
Сероводород горит на воздухе голубым пламенем
при этом образуется сернистый газ или оксид серы(IV)
2H2S-2 +
3O2 → 2H2O + 2S+4O2↑S-2 -6е→ S+4 Восстановитель
O2+4е → 2O -2 Окислитель
При недостатке кислорода образуются пары воды и серы:
2H2S-2 + O2 → 2H2O + 2S0
S-2 -2е→ S0 Восстановитель
O2+4е → 2O -2 Окислитель
Сероводород обладает свойствами восстановителя
Слайд 16 Сероводород обладает свойствами восстановителя: если в
пробирку с сероводородом прилить небольшое количество йодной воды, то
раствор обесцветится и на поверхности раствора появится сераH2S-2 + I02→ S0 + 2HI-1
S-2 -2е→ S0Восстановитель
I02 +2е → 2I-1 окислитель
Слайд 17
Влияние сероводорода на окружающую среду и здоровье человека
Очень токсичен. Вдыхание воздуха с содержанием сероводорода вызывает
головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкусПри большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается
Слайд 18 Сероводород из-за своей токсичности находит ограниченное
применение.
В аналитической химии сероводород
и сероводородная вода используются
как
реагенты для осаждения тяжёлых металлов, сульфиды
которых очень слабо растворимы.
Окрашенные сульфиды служат основой для изготовления красок, в том числе светящихся. Они же используются в аналитической химии.
Применение.
Слайд 19
Сероводород применяют д для получения серной кислоты, элементной серы, сульфидов.
В медицине — в составе
природных и искусственных
сероводородных ванн,
а также в составе некоторых
минеральных вод.
Слайд 20
Сульфиды калия, стронция и
бария используются в кожевенном деле для удаления шерсти со
шкур перед их выделкой.В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сыр
Слайд 22
Лабораторный опыт
Pb(NO3)2 + Na2S → PbS↓ + 2NaNO3
осадок черного цвета (Na2S + CuCl2 → CuS↓ + 2HCl)
осадок черного цвета
Качественная реакция
на сульфид-ион (S2-)





























