Слайд 2
Цели урока:
Ознакомить учащихся с составом, строением, способами
получения и
применением фенола;
На основе состава и строения молекулы фенола рассмотреть его
химические свойства.
Отметить токсичность фенола и его производных.
Слайд 3
Задачи урока:
Познавательные:
на примере фенола конкретизировать знания учащихся об

особенностях строения веществ, принадлежащих к классу фенолы, рассмотреть зависимость
взаимного влияния атомов в молекуле фенола на его свойства ;
познакомить учащихся с физическими и химическими свойствами фенола и некоторых его соединений, изучить качественные реакции на фенолы ;
рассмотреть нахождение в природе, применение фенола и его соединений, их биологическую роль
Развивающие:
совершенствовать умение учащихся прогнозировать свойства вещества на основе его строения ;
продолжать развивать умение наблюдать, анализировать, делать выводы при выполнении химического эксперимента
Воспитательные:
продолжить формирование химической картины мира через химическую картину природы (познаваемость, управление химическими процессами);
расширить представление учащихся о влиянии фенолсодержащих промышленных отходов и строительных материалов на окружающую среду и здоровье человека ;
рассмотреть биологическую роль фенола и его соединений на организм человека (положительную и отрицательную)
Слайд 4
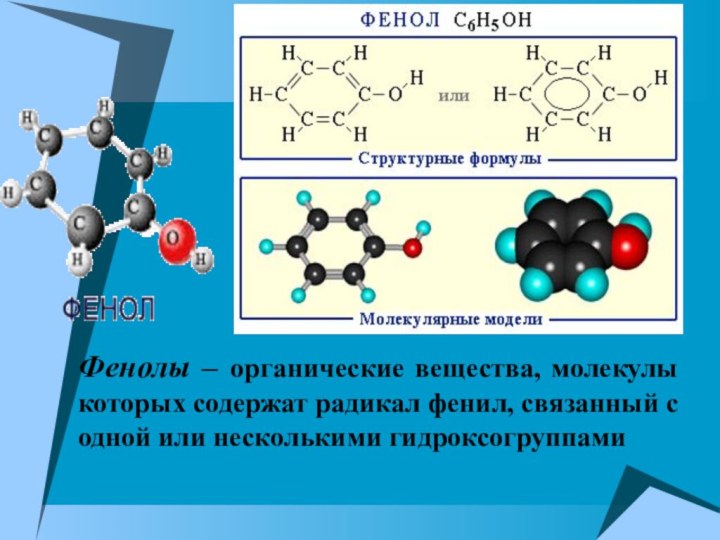
Фенолы – органические вещества, молекулы которых содержат радикал
фенил, связанный с одной или несколькими гидроксогруппами
Слайд 5
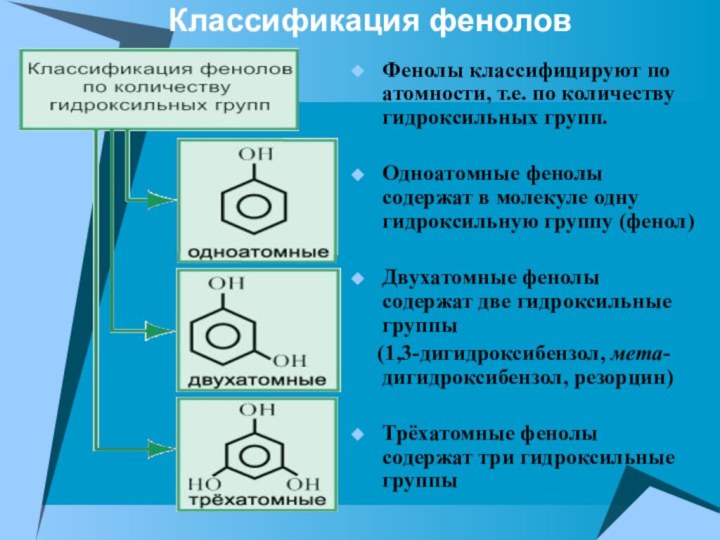
Фенолы классифицируют по атомности, т.е. по количеству гидроксильных
групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу
(фенол)
Двухатомные фенолы содержат две гидроксильные группы
(1,3-дигидроксибензол, мета-дигидроксибензол, резорцин)
Трёхатомные фенолы содержат три гидроксильные группы
Классификация фенолов
Слайд 6
По количеству бензольных колец фенолы бывают моноядерные и
многоядерные
Слайд 7
Номенклатура
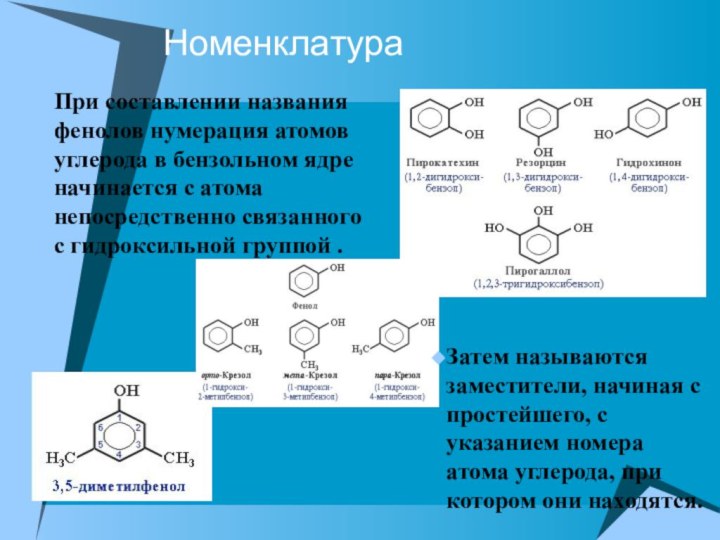
При составлении названия фенолов нумерация атомов углерода в
бензольном ядре начинается с атома непосредственно связанного с гидроксильной
группой .
Затем называются заместители, начиная с простейшего, с указанием номера атома углерода, при котором они находятся.
Слайд 8
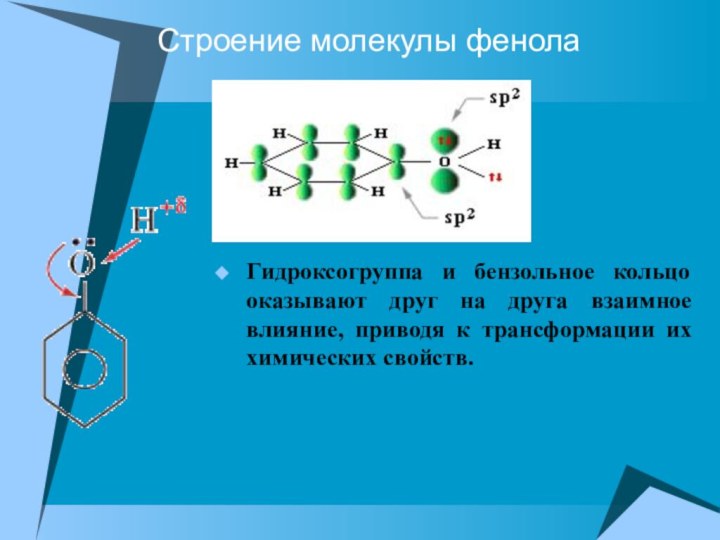
Строение молекулы фенола
Гидроксогруппа и бензольное кольцо оказывают друг
на друга взаимное влияние, приводя к трансформации их химических
свойств.
Слайд 9
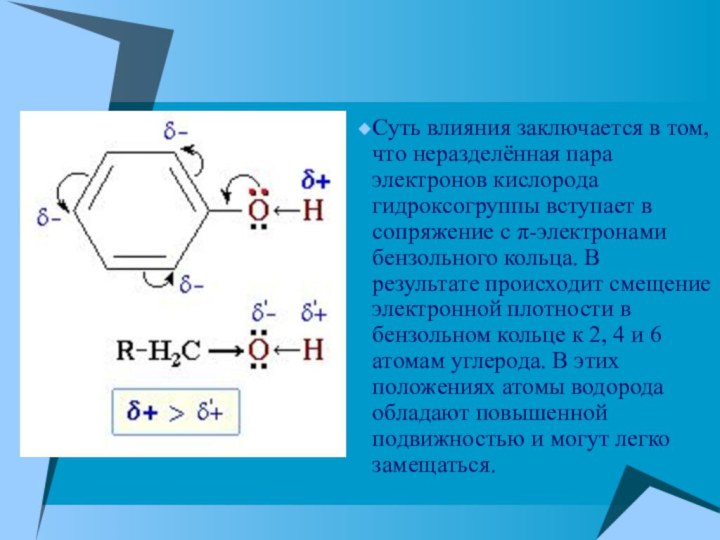
Суть влияния заключается в том, что неразделённая пара
электронов кислорода гидроксогруппы вступает в сопряжение с π-электронами бензольного
кольца. В результате происходит смещение электронной плотности в бензольном кольце к 2, 4 и 6 атомам углерода. В этих положениях атомы водорода обладают повышенной подвижностью и могут легко замещаться.
Слайд 10
Физические свойства фенола
Фенол - твёрдое бесцветное кристаллическое вещество.
Вследствие частичного окисления на воздухе он бывает окрашен в
розовый цвет. Его температура плавления +42ºС, температура кипения +181ºС. Фенол обладает резким характерным запахом. В холодной воде он мало растворим, но уже при 70 ºС растворяется в любых отношениях.
Фенол ядовит! При попадании на кожу вызывает ожоги поэтому с фенолом необходимо обращаться осторожно!
Слайд 13
Химические свойства фенола
Химические свойства фенола обусловлены наличием в
его молекуле
гидроксильной группы
бензольного ядра
Слайд 14
Химические свойства, обусловленные наличием гидроксильной группы
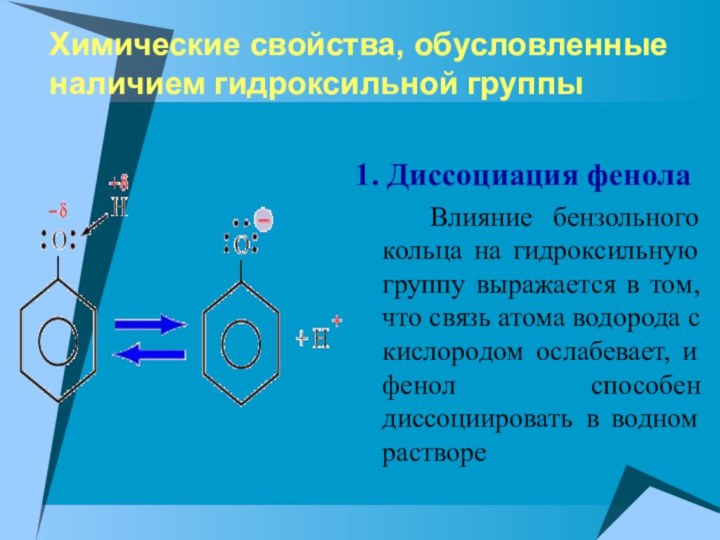
1. Диссоциация фенола
Влияние бензольного кольца на гидроксильную группу выражается в
том, что связь атома водорода с кислородом ослабевает, и фенол способен диссоциировать в водном растворе
Слайд 15
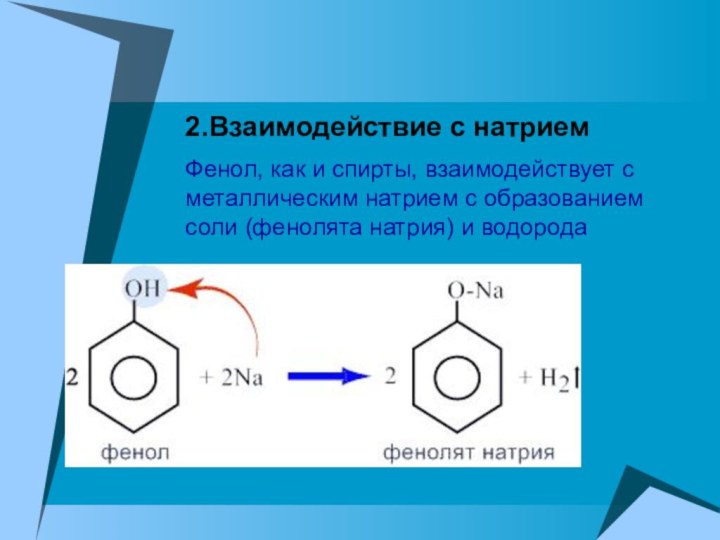
2.Взаимодействие с натрием
Фенол, как и спирты, взаимодействует с
металлическим натрием с образованием соли (фенолята натрия) и водорода
Слайд 17
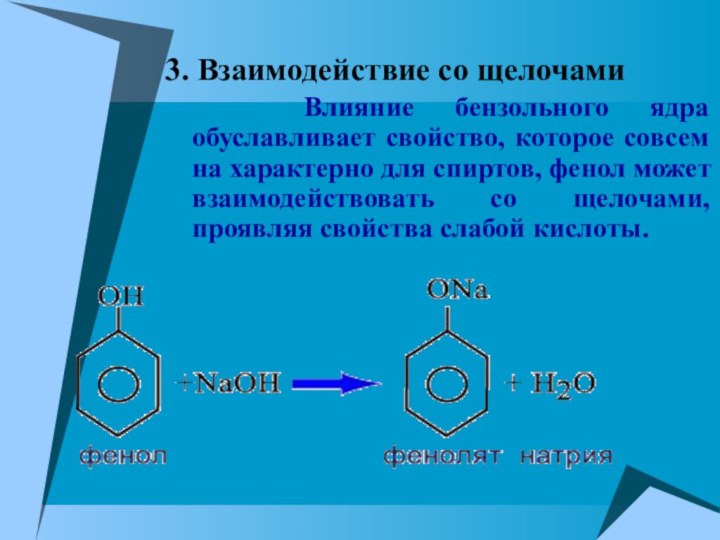
3. Взаимодействие со щелочами
Влияние бензольного
ядра обуславливает свойство, которое совсем на характерно для спиртов,
фенол может взаимодействовать со щелочами, проявляя свойства слабой кислоты.
Слайд 20
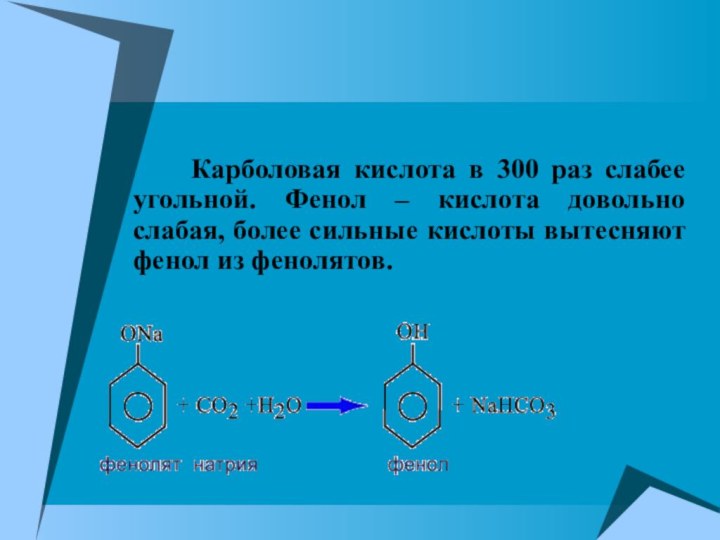
Карболовая кислота в 300
раз слабее угольной. Фенол – кислота довольно слабая, более
сильные кислоты вытесняют фенол из фенолятов.
Слайд 21
Химические свойства, обусловленные наличием бензольного ядра
Отличия от ароматических углеводородов:
1. Реакции окисления
Фенол окисляется кислородом
воздуха, приобретая фиолетовую окраску.
Слайд 22
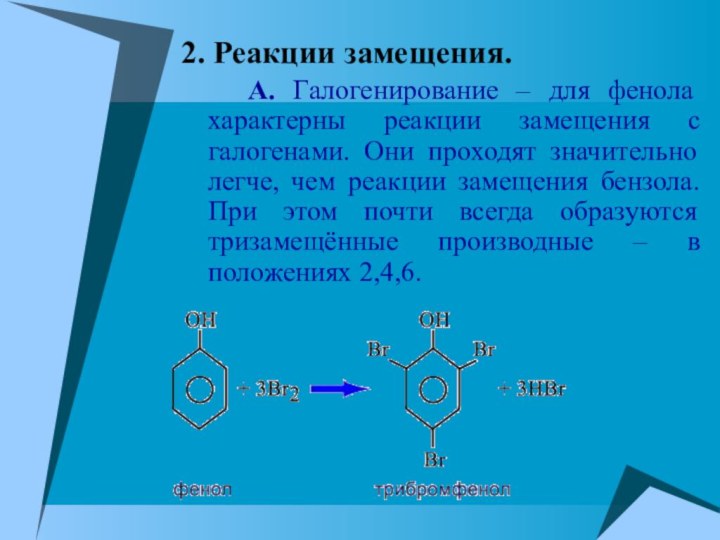
2. Реакции замещения.
А. Галогенирование – для
фенола характерны реакции замещения с галогенами. Они проходят значительно
легче, чем реакции замещения бензола. При этом почти всегда образуются тризамещённые производные – в положениях 2,4,6.
Слайд 25
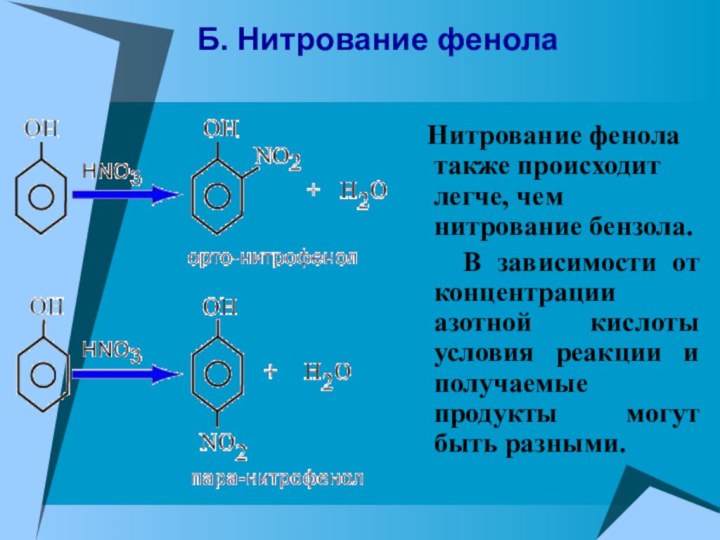
Б. Нитрование фенола
Нитрование фенола также происходит
легче, чем нитрование бензола.
В зависимости от концентрации
азотной кислоты условия реакции и получаемые продукты могут быть разными.
Слайд 26
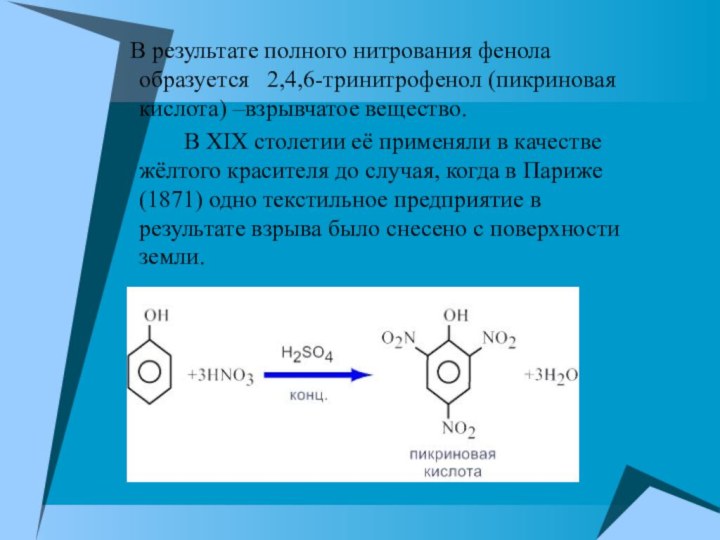
В результате полного нитрования фенола образуется
2,4,6-тринитрофенол (пикриновая кислота) –взрывчатое вещество.
В XIX столетии её применяли в качестве жёлтого красителя до случая, когда в Париже (1871) одно текстильное предприятие в результате взрыва было снесено с поверхности земли.
Слайд 27
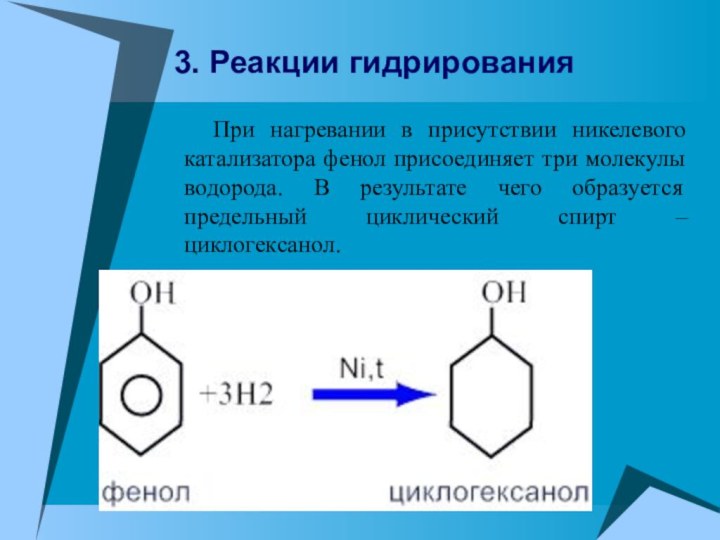
При нагревании в присутствии никелевого катализатора
фенол присоединяет три молекулы водорода. В результате чего образуется
предельный циклический спирт – циклогексанол.
3. Реакции гидрирования
Слайд 28
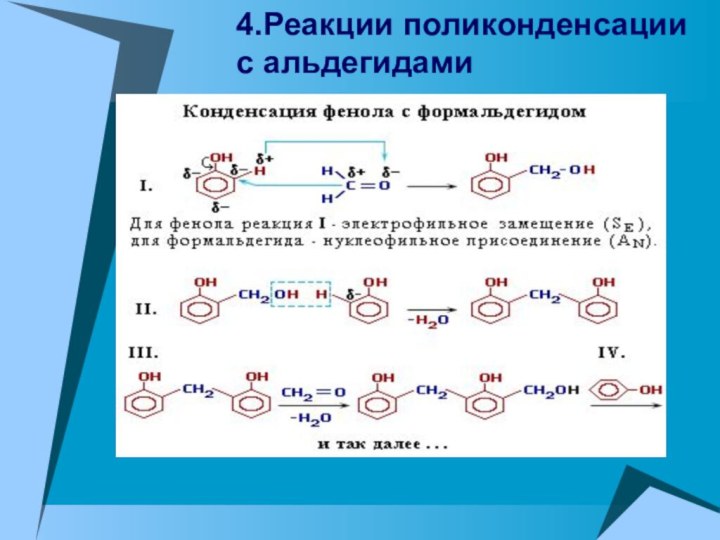
4.Реакции поликонденсации с альдегидами
Слайд 29
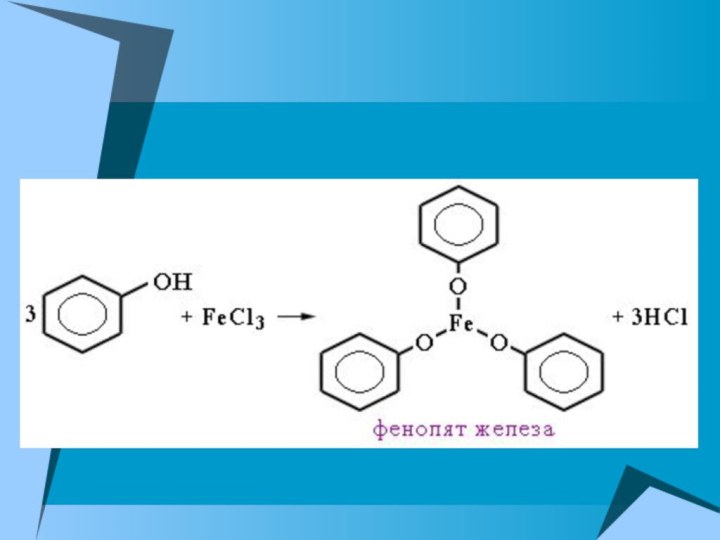
5. Качественная реакция на фенол
Слайд 32
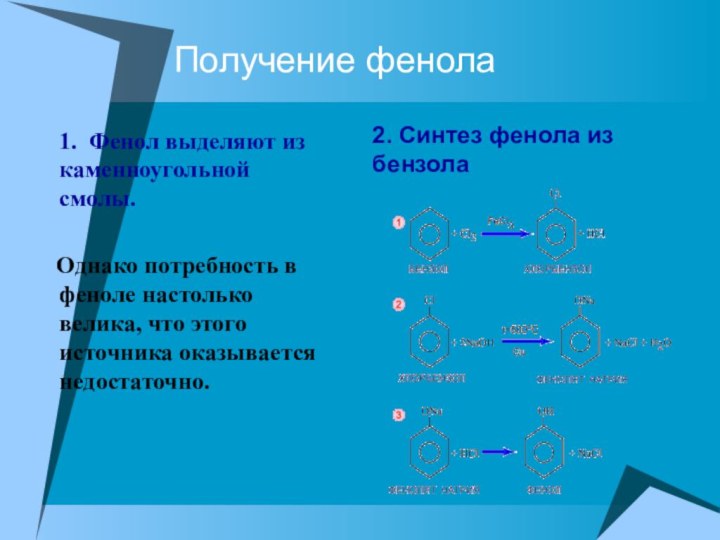
Получение фенола
1. Фенол выделяют из каменноугольной смолы.
Однако потребность в феноле настолько велика, что этого
источника оказывается недостаточно.
2. Синтез фенола из бензола
Слайд 33
Применение фенола.
Фенол применяют для производства фенолформальдегидных пластмасс, синтетического
волокна капролактам, красителей, лекарств, взрывчатых веществ и других продуктов.
Раствор фенола в воде обладает дезинфицирующими свойствами